




还剩12页未读,
继续阅读
成套系列资料,整套一键下载
- 人教版 (新课标)选修4 化学反应原理 第一章 化学反应与能量(章末复习PPT) 课件 0 次下载
- 人教版 (新课标)选修4 化学反应原理 1.1 化学反应与能量的变化(第1课时 焓变 反应热) 课后练习 课件 0 次下载
- 人教版 (新课标)选修4 化学反应原理 1.1 化学反应与能量的变化(第2课时 热化学方程式) 课后练习 课件 0 次下载
- 人教版 (新课标)选修4 化学反应原理 1.1 化学反应与能量的变化(第2课时 热化学方程式) 课件 课件 0 次下载
- 人教版 (新课标)选修4 化学反应原理 1.1 化学反应与能量的变化(第3课时 中和反应的反应热及其测量) 课后练习 课件 0 次下载
人教版 (新课标)选修4 化学反应原理 1.1 化学反应与能量的变化(第1课时 焓变 反应热) 课件
展开
这是一份人教版 (新课标)选修4 化学反应原理 1.1 化学反应与能量的变化(第1课时 焓变 反应热) 课件,共20页。
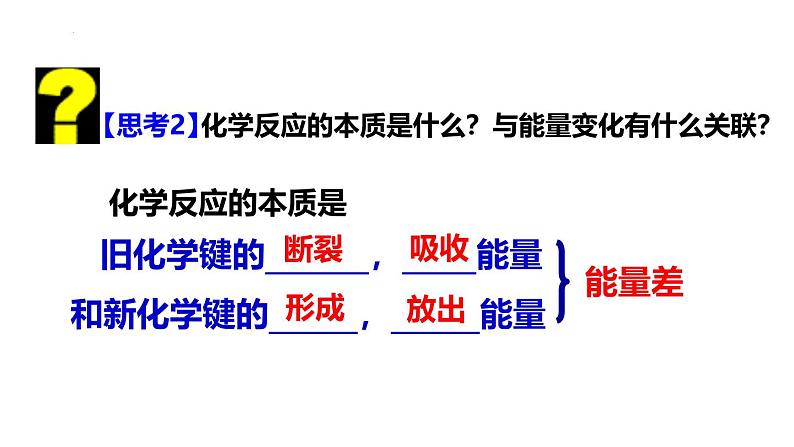
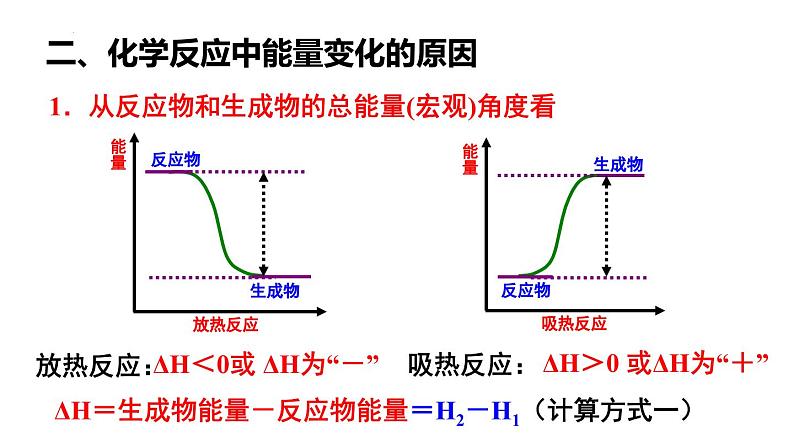
组织建设第一节 化学反应与能量的变化(第1课时 焓变 反应热 )第一章 化学反应与能量【思考1】放热反应吸热反应1.燃料的燃烧反应2.酸碱中和反应3.活泼金属与酸或水4.大多数化合反应归纳放热反应和吸热反应分别有哪些?(3分钟)1.许多分解反应,如CaCO3高温分解2.铵盐与碱,如NH4Cl+Ba(OH)2·8H2O 3.一些氧化物的还原反应,如C+CO2、H2+CuO、C+H2O 【温故知新】化学反应伴随着能量变化,反应产生的能量可以多种形式存在,如:热能、电能、光能等1.化学反应过程中,不仅有物质的变化,还有能量的变化。这种能量的变化常以_____、_____、____等形式表现出来。热能电能光能2.化学反应中的能量变化,通常主要表现为______的变化。对化学反应,以反应过程中放热或吸热为标准划分,分为放热反应和吸热反应两种类型。有热量________的反应叫做放热反应,需要_________热量的反应叫做吸热反应。热量放出吸收【复习巩固】化学反应的本质是什么?与能量变化有什么关联? 旧化学键的_______,_____能量和新化学键的______,______能量吸收放出能量差【思考2】化学反应的本质是断裂形成1.焓和焓变(1)焓(H):是一个与 有关的物理量。(2)焓变(ΔH):ΔH = 。内能H(生成物)-H(反应物)一、焓变 反应热2.反应热(1)定义:化学反应过程中 (数值上等于 条件下的焓变),用 表示。(2)单位: 。所释放或吸收的能量恒压ΔHkJ/mol【小试牛刀】下列说法不正确的是( ) A.恒压条件下的焓变在数值上等于变化过程中的热效应 B.焓变的符号是ΔH C.焓变的单位通常是kJ·mol-1 D.硝酸铵溶于水是吸热反应D【再来一刀】下列关于化学反应与能量变化的说法正确的是( ) A.放热反应的发生无须任何条件 B.化学键的断裂和形成与反应放热和吸热无关 C.化学反应过程都伴随着能量的变化 D.硫酸与氢氧化钠的反应是吸热反应C1.从反应物和生成物的总能量(宏观)角度看吸热反应:ΔH<0或 ΔH为“-”ΔH>0 或ΔH为“+”ΔH=生成物能量-反应物能量=H2-H1(计算方式一)二、化学反应中能量变化的原因放热反应: 【小试牛刀】对于放热反应2H2(g)+O2(g)=2H2O(l),下列说法正确的是 ( ) A.生成物H2O所具有的总焓高于反应物H2和O2所具有的总焓 B.反应物H2和O2所具有的总焓高于生成物H2O所具有的总焓 C.反应物H2和O2所具有的总焓等于生成物H2O所具有的总焓 D.反应物H2和O2比生成物H2O稳定B2.从键能(微观)角度看ΔH=破键吸收能量-成键放出能量如何计算此反应过程中的反应热?知识回顾:化学反应的本质是什么?旧化学键的破坏和新化学键的形成。吸收能量释放能量H2 + Cl2 = 2HClH-HCl-Cl436KJ/mol吸收243kJ/mol吸收键断裂HHClCl+ +键形成H-ClH-Cl431kJ/mol431kJ/mol释放=反应物总键能-生成物总键能ΔH=吸收能量-放出能量∆H= E1-E2(计算方式三)∆H=E(生成物的总能量)- E(反应物的总能量)ΔH=破键吸收能量-成键放出能量B3.从键焓(微观)角度看:ΔH=化学键键焓的代数和如何计算此反应过程中的反应热?∆H= +E1+(-E2)(计算方式三)∆H=E(生成物的总能量)- E(反应物的总能量)ΔH=破键吸收能量-成键放出能量H2H1⑹伴有能量变化的物质变化不一定都是化学变化 ( )√×⑷反应物的总能量高于生成物的总能量时该反应放热 ( )√×⑶化学键的断裂或形成一定伴有焓变 ( )⑴物质发生化学反应都伴有能量变化 ( )√⑵需要加热发生的反应一定是吸热反应 ( )×⑸反应物的总键能大于生成物的总键能时,该反应放热 ( ) 【小试牛刀】判断下列说法是否正确:放热反应与吸热反应的比较大于放出吸收小于大于小于ΔH<0ΔH>01.已知反应X+Y=M+N为放热反应,对该反应的下列说法中正确的是( ) A.X的能量一定高于M B.Y的能量一定高于N C.X和Y的总能量一定高于M和N的总能量 D.因该反应为放热反应,故不必加热就可发生 C2.氢气和氟气混合在黑暗处即可发生爆炸而释放出大量的热量。在反应过程中,断裂1 mol H2中的化学键消耗的能量为Q1 kJ,断裂1 mol F2中的化学键消耗的能量为Q2 kJ,形成1 mol HF中的化学键释放的能量为Q3 kJ。下列关系式中正确的是( ) A.Q1+Q2<2Q3 B.Q1+Q2>2Q3 C.Q1+Q2<Q3 D.Q1+Q2>Q3A3.反应A+B→C(放热)分两步进行:①A+B→X(吸热),②X→C(放热)。下列示意图中,能正确表示总反应过程中能量变化的是( )A B C DA更多精彩内容请登录:https://www.zxxk.com/organ/413/本课结束
组织建设第一节 化学反应与能量的变化(第1课时 焓变 反应热 )第一章 化学反应与能量【思考1】放热反应吸热反应1.燃料的燃烧反应2.酸碱中和反应3.活泼金属与酸或水4.大多数化合反应归纳放热反应和吸热反应分别有哪些?(3分钟)1.许多分解反应,如CaCO3高温分解2.铵盐与碱,如NH4Cl+Ba(OH)2·8H2O 3.一些氧化物的还原反应,如C+CO2、H2+CuO、C+H2O 【温故知新】化学反应伴随着能量变化,反应产生的能量可以多种形式存在,如:热能、电能、光能等1.化学反应过程中,不仅有物质的变化,还有能量的变化。这种能量的变化常以_____、_____、____等形式表现出来。热能电能光能2.化学反应中的能量变化,通常主要表现为______的变化。对化学反应,以反应过程中放热或吸热为标准划分,分为放热反应和吸热反应两种类型。有热量________的反应叫做放热反应,需要_________热量的反应叫做吸热反应。热量放出吸收【复习巩固】化学反应的本质是什么?与能量变化有什么关联? 旧化学键的_______,_____能量和新化学键的______,______能量吸收放出能量差【思考2】化学反应的本质是断裂形成1.焓和焓变(1)焓(H):是一个与 有关的物理量。(2)焓变(ΔH):ΔH = 。内能H(生成物)-H(反应物)一、焓变 反应热2.反应热(1)定义:化学反应过程中 (数值上等于 条件下的焓变),用 表示。(2)单位: 。所释放或吸收的能量恒压ΔHkJ/mol【小试牛刀】下列说法不正确的是( ) A.恒压条件下的焓变在数值上等于变化过程中的热效应 B.焓变的符号是ΔH C.焓变的单位通常是kJ·mol-1 D.硝酸铵溶于水是吸热反应D【再来一刀】下列关于化学反应与能量变化的说法正确的是( ) A.放热反应的发生无须任何条件 B.化学键的断裂和形成与反应放热和吸热无关 C.化学反应过程都伴随着能量的变化 D.硫酸与氢氧化钠的反应是吸热反应C1.从反应物和生成物的总能量(宏观)角度看吸热反应:ΔH<0或 ΔH为“-”ΔH>0 或ΔH为“+”ΔH=生成物能量-反应物能量=H2-H1(计算方式一)二、化学反应中能量变化的原因放热反应: 【小试牛刀】对于放热反应2H2(g)+O2(g)=2H2O(l),下列说法正确的是 ( ) A.生成物H2O所具有的总焓高于反应物H2和O2所具有的总焓 B.反应物H2和O2所具有的总焓高于生成物H2O所具有的总焓 C.反应物H2和O2所具有的总焓等于生成物H2O所具有的总焓 D.反应物H2和O2比生成物H2O稳定B2.从键能(微观)角度看ΔH=破键吸收能量-成键放出能量如何计算此反应过程中的反应热?知识回顾:化学反应的本质是什么?旧化学键的破坏和新化学键的形成。吸收能量释放能量H2 + Cl2 = 2HClH-HCl-Cl436KJ/mol吸收243kJ/mol吸收键断裂HHClCl+ +键形成H-ClH-Cl431kJ/mol431kJ/mol释放=反应物总键能-生成物总键能ΔH=吸收能量-放出能量∆H= E1-E2(计算方式三)∆H=E(生成物的总能量)- E(反应物的总能量)ΔH=破键吸收能量-成键放出能量B3.从键焓(微观)角度看:ΔH=化学键键焓的代数和如何计算此反应过程中的反应热?∆H= +E1+(-E2)(计算方式三)∆H=E(生成物的总能量)- E(反应物的总能量)ΔH=破键吸收能量-成键放出能量H2H1⑹伴有能量变化的物质变化不一定都是化学变化 ( )√×⑷反应物的总能量高于生成物的总能量时该反应放热 ( )√×⑶化学键的断裂或形成一定伴有焓变 ( )⑴物质发生化学反应都伴有能量变化 ( )√⑵需要加热发生的反应一定是吸热反应 ( )×⑸反应物的总键能大于生成物的总键能时,该反应放热 ( ) 【小试牛刀】判断下列说法是否正确:放热反应与吸热反应的比较大于放出吸收小于大于小于ΔH<0ΔH>01.已知反应X+Y=M+N为放热反应,对该反应的下列说法中正确的是( ) A.X的能量一定高于M B.Y的能量一定高于N C.X和Y的总能量一定高于M和N的总能量 D.因该反应为放热反应,故不必加热就可发生 C2.氢气和氟气混合在黑暗处即可发生爆炸而释放出大量的热量。在反应过程中,断裂1 mol H2中的化学键消耗的能量为Q1 kJ,断裂1 mol F2中的化学键消耗的能量为Q2 kJ,形成1 mol HF中的化学键释放的能量为Q3 kJ。下列关系式中正确的是( ) A.Q1+Q2<2Q3 B.Q1+Q2>2Q3 C.Q1+Q2<Q3 D.Q1+Q2>Q3A3.反应A+B→C(放热)分两步进行:①A+B→X(吸热),②X→C(放热)。下列示意图中,能正确表示总反应过程中能量变化的是( )A B C DA更多精彩内容请登录:https://www.zxxk.com/organ/413/本课结束
相关资料
更多









