

人教版 (2019)选择性必修2第一节 共价键精品导学案
展开1.共价键定义:原子间通过 电子对所形成的相互作用叫做共价键。
2.共价键本质:是在原子之间形成共用电子对。共价键形成的原因是成键原子相互接近,原子轨道发生
,自旋方向 的未成对电子形成共用电子对。
3.共价键特征
4.共价键的形成条件:通常电负性相同或差值较小的 原子之间形成共价键,大多数电负性之差小于 的 与非金属原子之间形成共价键。
5.共价键表示方法
(1)用“-”表示原子间 共用电子所形成的共价键,如H-H
(2)用“=”表示原子间 共用电子所形成的共价键,如C=C
(3)用“≡”表示原子间 共用电子所形成的共价键,如C≡C
6.共价键的分类
【特别提醒】①一般情况下,σ键比π键 ,但并不是所有分子中的σ键都比π键 (例如:N2)。
②并不是所有的分子都含有σ键,如 分子。
③不存在 π键、 π键等。
④分子中存在π键,则一定存在 键,但若存在σ键,则不一定存在 键。
【探究p36】共价键《问题和预测的答案》
(1)乙烷分子中的共价健由 个σ键构成;乙烯分子中的共价键由 个σ键和 个π键构成;乙炔分子中的共价键由 个σ键和 个π键构成。
(2)乙烯分子的碳原子采取sp2杂化,2个碳原子各以2个sp2杂化轨道与氢原子形成2个碳氢 键,而2个碳原子之间又各以1个sp2杂化轨道形成 个碳碳键,除此之外,2个碳原子中未参加杂化的p轨道形成了
个π键,因此,乙烯的双键中有 个σ键和 个π键。乙炔分子的碳原子采取sp杂化,2个碳原子各以1个sp杂化轨道与氢原子形成 个碳氢σ键,同时又各以其另一个sp杂化轨道形成 个碳碳σ键,除此之外,每个碳原子通过2个未参加杂化的p轨道形成了 个π键。
【探究p36】共价键《绘制图示》参考答案:
【探究p36】共价键《问题与讨论》参考答案:
结论:当成键原子的电负性相差很大时,形成的电子对不会被共用,形成的将是 键;而 是电负性相差不大的原子之间形成的化学键。
►问题一 共价健的形成与特征
【典例1】下列关于共价键的描述正确的是
A.两个原子的单电子若自旋方向相同,则两两配对可形成共价键
B.原子轨道具有一定的伸展方向,所形成的共价键都具有方向性
C.两个原子的p轨道不仅能形成σ键,也能形成π键
D.气体单质中一定存在σ键,可能存在π键
【变式1-1】下列说法不正确的是
A.共价键的饱和性是由成键原子的未成对电子数决定的
B.乙烯分子中的键关于镜面对称
C.共价键的饱和性决定了分子内部原子的数量关系
D.烯烃比烷烃的化学性质活泼是由于烷烃中的键比烯烃中的键稳定
【变式1-2】下列关于共价键的说法正确的是
A.共价键只存在于非金属原子间
B.两个原子形成共价键时,原子之间只能存在一对共用电子对
C.两个原子形成共价键时,每个原子周围都有8个电子
D.共价键是通过共用电子对形成的一种相互作用
►问题二 共价健类型的判断
【典例2】1.下列关于σ 键和π键的说法不正确的是
A.σ 键能单独形成,π键不能单独形成
B.σ 键可以绕键轴旋转,π键不能绕键轴旋转
C.双键中一定有一个σ 键,一个π键,三键中一定有一个σ 键,两个π键
D.CH3-CH3、CH2=CH2、CH≡CH中的σ 键都是C-C键,所以键能都相同
【变式2-1】下列关于σ键和π键的说法,不正确的是
A.σ键和π键不能同时存在于同一个分子中
B.σ键由原子轨道“头碰头”重叠而成,π键由原子轨道“肩并肩”重叠而成
C.乙烯分子中含有5个σ键和1个π键
D.氢分子中存在σ键,氮分子中存在σ键和π键
【变式2-2】下列关于σ键和π键说法正确的是
A.σ键是由两个p电子“肩并肩”重叠形成的
B.σ键和π键都是共价键,σ键比π键更稳定
C.乙烯分子和乙炔分子中π键数目相同
D.H2分子中含有σ键,HCl分子中含有π键
1.下列分子中的σ键是由一个原子的s轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成的是
A.H2B.HClC.Cl2D.N2
2.下列关于共价键的叙述中正确的是
A.只有不同种元素的原子之间才能形成共价键
B.由A失去电子,B接受电子的过程形成了共价键
C.原子核外有几个电子就一定能形成几个共价键
D.共用电子对必然偏向吸引电子能力强的一方
3.下列各组物质中既存在σ键又存在π键的是
A.B.乙烯C.D.
4.下列说法正确的是
A.π键是由两个电子的p轨道“头碰头”重叠形成的
B.σ键是镜面对称,而π键是轴对称
C.乙烷分子中的共价键全为σ键,而乙烯分子中含σ键和π键
D.H2分子中只含σ键,而Cl2分子中还含π键
5.下列说法中正确的是
A.键比键重叠程度大,形成的共价键稳定
B.两个原子之间形成共价键时,最多有一个键
C.气体单质中,一定有键,可能有键
D.分子中有一个键,二个键
6.下列关于σ键和π键的说法中,不正确的是
A.N2分子中的π键为p-pπ键,π键不能绕键轴旋转
B.HCl分子中的σ键为s-sσ键
C.乙烯分子中σ键与π键的个数比为5:1
D.p轨道和p轨道之间既能形成π键,又能形成σ键
7.下列关于共价键的理解正确的是
A.σ键和π键电子形状的对称性相同B.所有分子中都存在共价键
C.只有共价化合物中存在共价键D.多原子分子中的键角表明共价键有方向性
8.下列关于键和键的理解不正确的是
A.含有键的分子在进行化学反应时,分子中的键比键活泼
B.在有些分子中,共价键可能只含有键而没有键
C.有些原子在与其他原子形成分子时只能形成键,不能形成键
D.当原子形成分子时,首先形成键,可能形成键
9.几种分子的成键方式
①N2中含有 个σ键和 个π键,结构式为: 。
②乙烷分子中碳原子与碳原子之间形成 个σ键,乙烯分子中碳原子与碳原子之间形成 个σ键和 个π键,乙炔分子中碳原子与碳原子之间形成 个σ键和 个π键。
③有机化合物中,碳原子与碳原子之间形成σ键比π键 ,在化学反应中,π键 。
④苯分子中,每个碳原子分别与 个氢原子、 个碳原子形成σ键,同时每个碳原子各有一个垂直于分子平面的 轨道,形成了一个以 个碳原子为中心的 键。
10.如图的有机物,分子式为: 。分子中含有 个σ键, 个π键。
1.下列说法中不正确的是
A.键比键重叠程度大,形成的共价键通常更牢固
B.两个原子之间形成共价键时,最多有一个键
C.气体单质中,一定有键,可能有键
D.分子中有一个键,2个键
2.下列说法正确的是
A.所有的原子轨道都具有一定的伸展方向,因此所有的共价键都具有方向性
B.分子中键和键的数目之比为2∶1
C.乙烯与乙烷化学性质不同,主要是因为乙烯中的键不如键牢固
D.键与键的电子云对称性不同
3.下列含有π键的化合物是
A.N2B.H2OC.CO2D.石墨
4.下列说法中不正确的是
A.碳碳双键中σ键比π键重叠程度大,形成的共价键强
B.两个原子之间形成共价键时,最多有1个σ键
C.气体单质中,一定有σ键,可能有π键
D.一个白磷分子中有6个σ键
5.下列说法正确的是
A.气体单质中,一定有σ键,可能有π键B.所有共价键都有方向性
C.H只能形成σ键,O可以形成σ键和π键D.分子中σ键一定比π键牢固
6.下列说法中不正确的是
A.σ键比π键重叠程度大,形成的共价键强
B.两个原子之间形成共价键时,最多有一个σ键
C.气体单质中,一定有σ键,可能有π键
D.基态N原子核外电子有5种不同的空间运动状态
7.下列化学键是通过电子云“肩并肩”重叠形成的是
A.B.C.D.
8.下列关于化学键的说法正确的是:
①s-sσ键与s-pσ键的电子云对称性相同
②物质只有发生化学变化时才会有化学键的断裂
③成键的原子间原子轨道重叠越多,共价键越牢固
④非金属元素之间形成的化合物中只含有共价键
⑤1个N原子最多只能与3个H原子结合形成分子,这是由共价键的饱和性决定的
A.①②③B.①③⑤C.②④⑤D.③④⑤
9.按要求填空:
(1)柠檬酸的结构简式见图。1ml柠檬酸分子中碳原子与氧原子形成的键的数目为 ml。
(2)CO2分子中存在 个键和 个键。
(3)N2分子中键与键的数目比 。
10.按要求回答问题:
(1)1 ml HCHO分子中含有σ键的数目为 NA。
(2)CS2分子中,共价键的类型有 。
(3)下列物质中:①MgCl2;②Na2O2; ③CS2 ;④NaOH; ⑤H2,只存在极性键的是 (填序号,下同),只存在非极性键的是 ,只存在离子键的是 ,既存在离子键又存在极性共价键的是 ,既存在离子键又存在非极性共价键的是 。
1.认识共价键的特征。
2.了解共价键的形成。
3.学会σ键 和 π键 的判断
特征
概念
作用
存在情况
饱和性
每个原子所能形成的共价键的总数或以单键连接的原子数目是 的
饱和性决定了分子的 。
所有的 都具有饱和性
方向性
在形成共价键时,原子轨道重叠的 ,电子在核间出现的概率 ,所形成的共价键就
,因此共价键将尽可能沿着电子出现概率
的方向形成,所以共价键具有方向性
方向性决定了分子的 结构。
并 所有共价键都具有方向性
σ键
π键
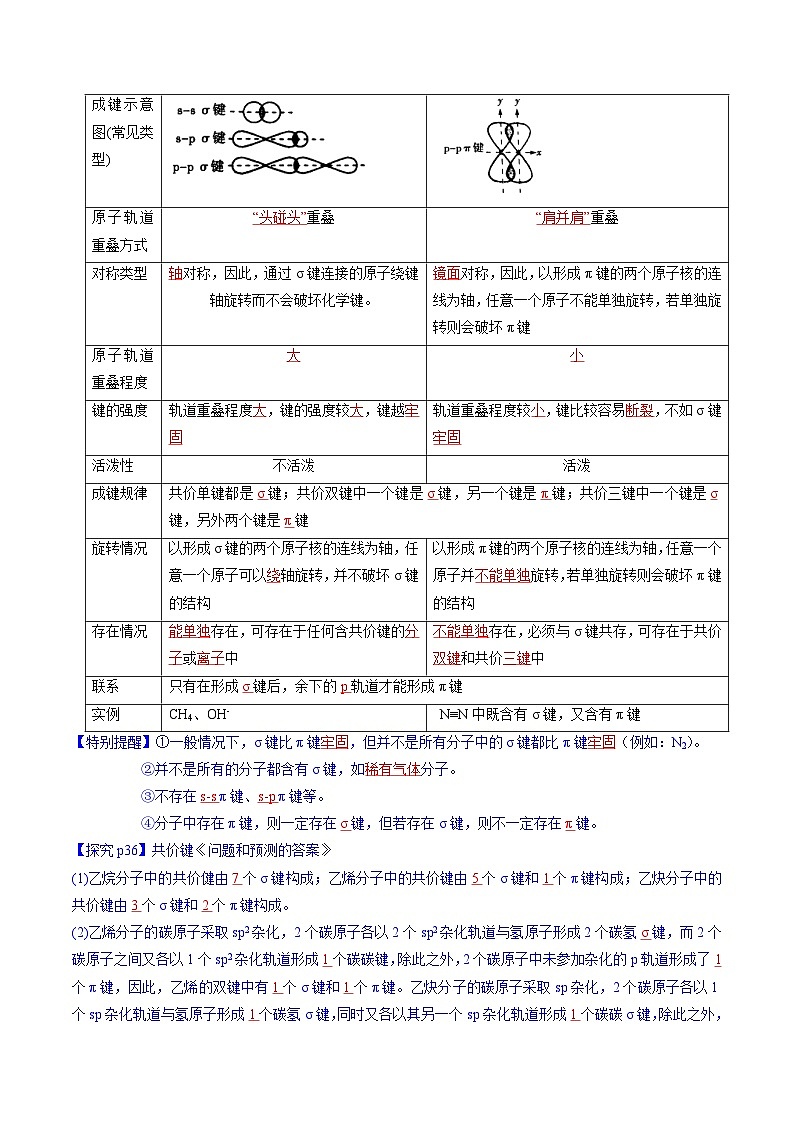
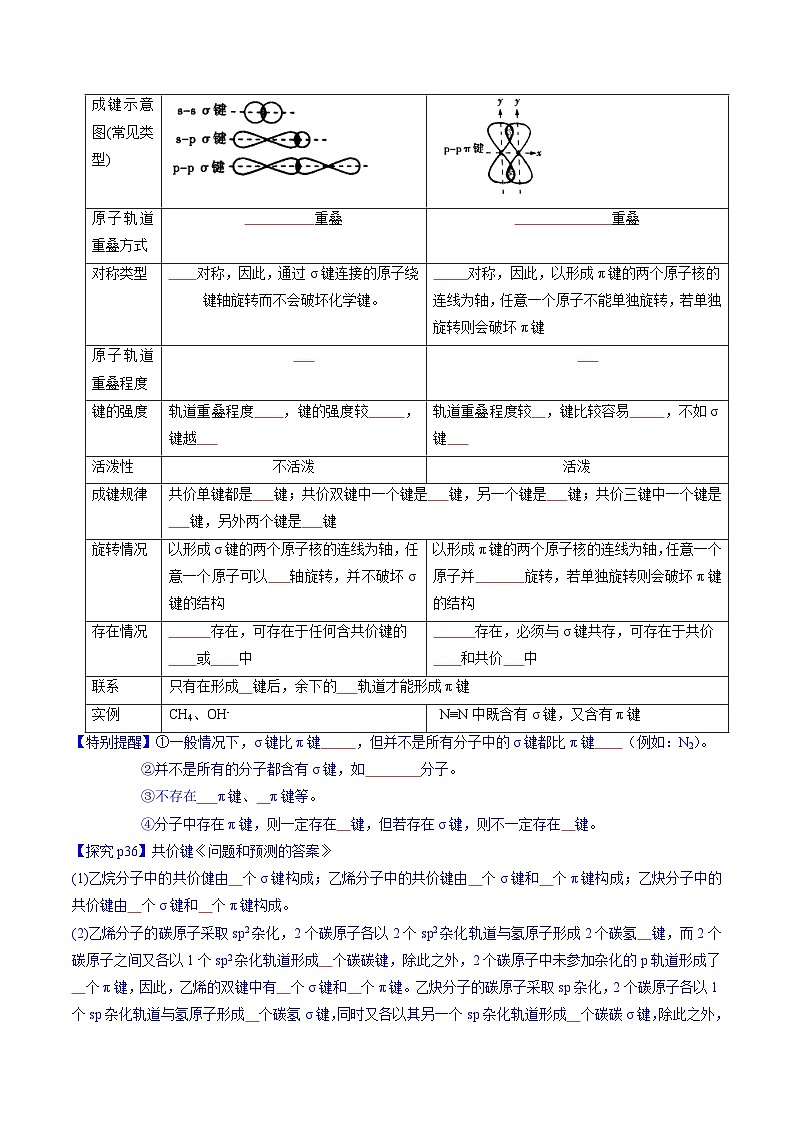
成键示意图(常见类型)
原子轨道重叠方式
重叠
重叠
对称类型
对称,因此,通过σ键连接的原子绕键轴旋转而不会破坏化学键。
对称,因此,以形成π键的两个原子核的连线为轴,任意一个原子不能单独旋转,若单独旋转则会破坏π键
原子轨道重叠程度
键的强度
轨道重叠程度 ,键的强度较 ,键越
轨道重叠程度较 ,键比较容易 ,不如σ键
活泼性
不活泼
活泼
成键规律
共价单键都是 键;共价双键中一个键是 键,另一个键是 键;共价三键中一个键是
键,另外两个键是 键
旋转情况
以形成σ键的两个原子核的连线为轴,任意一个原子可以 轴旋转,并不破坏σ键的结构
以形成π键的两个原子核的连线为轴,任意一个原子并 旋转,若单独旋转则会破坏π键的结构
存在情况
存在,可存在于任何含共价键的
或 中
存在,必须与σ键共存,可存在于共价
和共价 中
联系
只有在形成 键后,余下的 轨道才能形成π键
实例
CH4、OH-
N≡N中既含有σ键,又含有π键
原子
Na
Cl
H
Cl
C
O
电负性
0.9
3.0
2.1
3.0
2.5
3.5
电负性之差(绝对值)
2.1
0.9
1.0
高中化学第一节 化学反应速率优质学案: 这是一份高中化学<a href="/hx/tb_c4002419_t4/?tag_id=42" target="_blank">第一节 化学反应速率优质学案</a>,文件包含第04讲21化学反应速率教师版-2024年高中化学同步精品讲义选择性必修一docx、第04讲21化学反应速率学生版-2024年高中化学同步精品讲义选择性必修一docx等2份学案配套教学资源,其中学案共31页, 欢迎下载使用。
化学必修 第二册第二节 化学品的合理使用优质导学案: 这是一份化学必修 第二册<a href="/hx/tb_c4000055_t4/?tag_id=42" target="_blank">第二节 化学品的合理使用优质导学案</a>,文件包含第23讲83化学品的合理使用教师版-2024年高中化学同步精品讲义必修二docx、第23讲83化学品的合理使用学生版-2024年高中化学同步精品讲义必修二docx等2份学案配套教学资源,其中学案共19页, 欢迎下载使用。
人教版 (2019)必修 第二册第三节 无机非金属材料优秀学案: 这是一份人教版 (2019)必修 第二册<a href="/hx/tb_c4000035_t4/?tag_id=42" target="_blank">第三节 无机非金属材料优秀学案</a>,文件包含第07讲57无机非金属材料教师版-2024年高中化学同步精品讲义必修二docx、第07讲57无机非金属材料学生版-2024年高中化学同步精品讲义必修二docx等2份学案配套教学资源,其中学案共19页, 欢迎下载使用。













