









- 浙教版初中科学9上1.2 物质的酸碱性 课件 课件 1 次下载
- 浙教版初中科学9上1.3 常见的酸 课件 课件 0 次下载
- 浙教版初中科学9上1.5 酸和碱之间发生的反应 课件 课件 0 次下载
- 浙教版初中科学9上1.6 几种重要的盐 课件 课件 0 次下载
- 浙教版初中科学9上2.1 金属材料 课件 课件 0 次下载
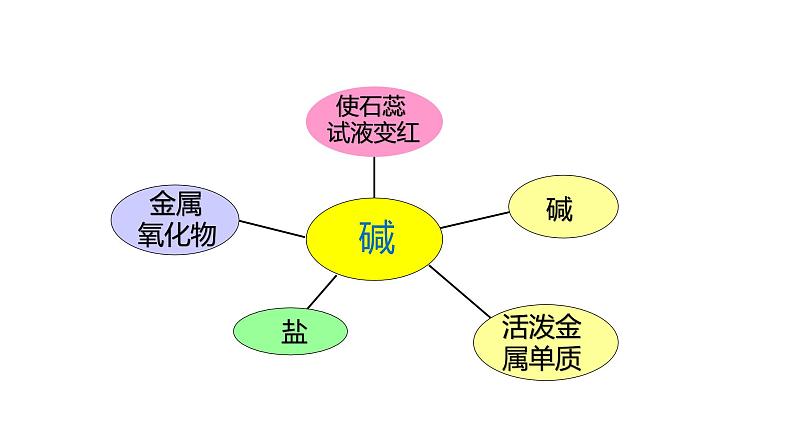
科学九年级上册第4节 常见的碱优质课课件ppt
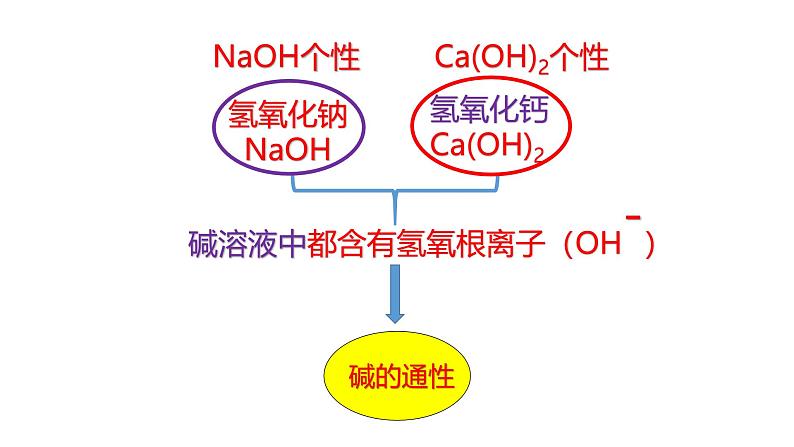
展开电离时,生成的阴离子全部是OH-的化合物
2、常见的碱有哪些 ?
3、这些碱之间是否也像酸一样有着碱的通性呢?
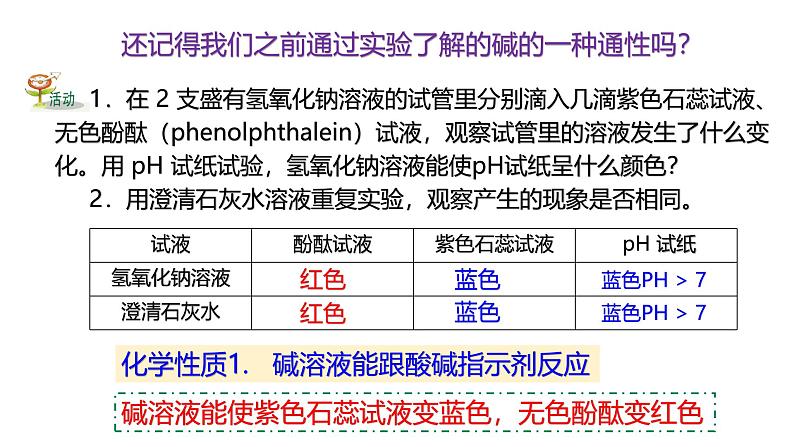
还记得我们之前通过实验了解的碱的一种通性吗?
1.在 2 支盛有氢氧化钠溶液的试管里分别滴入几滴紫色石蕊试液、无色酚酞(phenlphthalein)试液,观察试管里的溶液发生了什么变化。用 pH 试纸试验,氢氧化钠溶液能使pH试纸呈什么颜色? 2.用澄清石灰水溶液重复实验,观察产生的现象是否相同。
碱溶液能使紫色石蕊试液变蓝色,无色酚酞变红色
化学性质1. 碱溶液能跟酸碱指示剂反应
性质1. 碱溶液能跟指示剂反应
碱能使紫色石蕊试液变蓝色,无色酚酞变红色
性质1. 碱能跟指示剂反应
这里为什么要说成“碱溶液”,而不直接说成“碱”?
因为有些碱不能溶于水,由于不溶于水,它们不能使紫色石蕊试液、无色酚酞试液变色。
【查阅溶解性表了解不溶性碱】
1、如何检验二氧化碳气体?【请写出反应原理】
Ca(OH)2+CO2=CaCO3↓+H2O
2、如何吸收二氧化碳气体?【请写出反应原理】
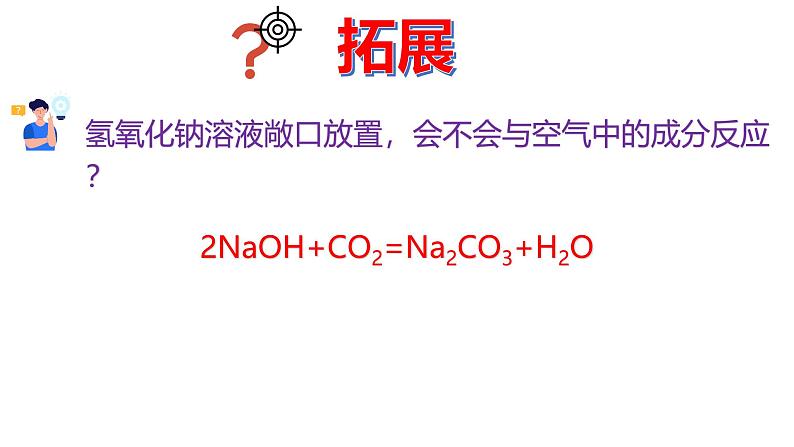
2NaOH+CO2=Na2CO3+H2O
化学性质2. (可溶性)碱 + 非金属氧化物 →盐 + 水
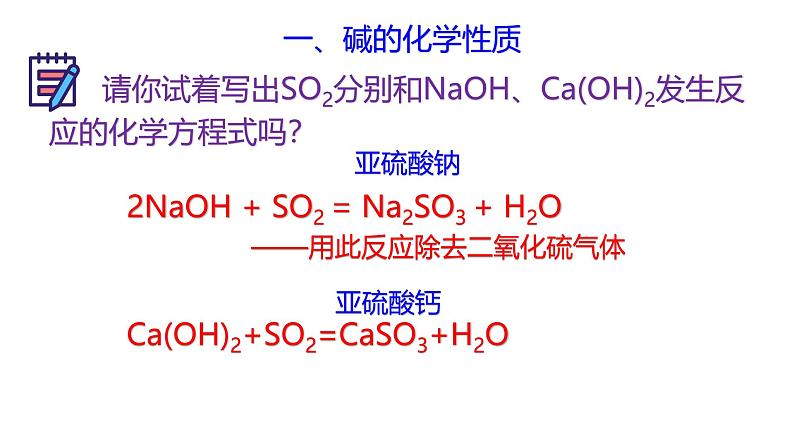
请你试着写出SO2分别和NaOH、Ca(OH)2发生反应的化学方程式吗?
2NaOH + SO2 = Na2SO3 + H2O
Ca(OH)2+SO2=CaSO3+H2O
——用此反应除去二氧化硫气体
氢氧化钠溶液敞口放置,会不会与空气中的成分反应?
1、NaOH溶液为什么不用玻璃塞(主要物质是SiO2)?
写出SiO2和NaOH反应的化学方程式
如果用玻璃瓶盖,玻璃的主要成分是二氧化硅要与氢氧化钠溶液反应,久置会与瓶子粘连。
1.在 2 支试管中分别注入 2~3 毫升氯化铜溶液和氯化铁溶液,它们各显什么颜色? ________________________________________________ 2.在上述 2 支试管中分别滴加 1~2 毫升氢氧化钠溶液,试管中发生了 什么变化? _______________________________________________ 写出反应的化学方程式:___________________________________________ ___________________________________________
氯化铜溶液呈蓝色;氯化铁溶液呈黄色
CuCl2中出现蓝色沉淀,FeCl3中出现红褐色沉淀。
2NaOH + CuCl2 = Cu(OH)2↓ + 2NaCl
3NaOH + FeCl3 = Fe(OH)3↓ + 3NaCl
3.在2支试管中各加入3毫升氢氧化钙溶液,然后分别滴加数滴碳酸钠溶液和氯化铁溶液,观察有什么变化发生。_________________________________________________写出反应的化学方程式为:______________________________________________________________________________________
Ca(OH )2 + Na2CO3 = CaCO3 ↓+2NaOH
3Ca(OH )2+ 2FeCl3 =2Fe(OH)3↓+3CaCl2
Na2CO3中出现白色沉淀,FeCl3中出现红褐色沉淀。
化学性质3. (可溶性)碱 +盐→ 新碱 +新盐
4.在4支试管中2支加入3毫升氢氧化钙溶液另2支加入氢氧化钠溶液,然后分别滴加盐酸和硫酸,观察有什么变化发生。_______________ 。
一、碱的化学性质【书p18】
发生了化学变化
1、一定未发生化学变化吗?说说你的想法
2、请你举几个生活中发生化学变化但没有明显现象的例子
3、请设计实验证明发生了反应?
5. 在2支试管中各加入3毫升氢氧化钙溶液,另2支加入氢氧化钠溶液,滴加无色酚酞试液,观察颜色变化?然后分别滴加盐酸和硫酸,观察有什么变化? _________________________________________________。
一、碱的化学性质【书p19】
滴加盐酸和硫酸后,红色逐渐消失
化学方程式为:_ __________ ____________; _________; _ ______ ____________; _________。
Ca(OH )2+ 2HCl= CaCl2+2H2O
Ca(OH )2+H2SO4 = Na2SO4 + 2H2O
NaOH + HCI = NaCI + H2O
2NaOH +H2SO4 = Na2SO4 + 2H2O
化学性质4. 碱 + 酸 → 盐 + 水
化学性质4. 碱 + 酸 = 盐 + 水
2. 把反应中生成的氢氧化铜及氢氧化铁沉淀分成2份,分别滴加盐酸和硫酸,观察有什么变化? _________________________________________________________。
蓝色沉淀逐渐消失,溶液变蓝色;
红棕色沉淀逐渐消失,溶液变黄色
碱电离产生的阴离子中都是OH—
1. 碱溶液能跟指示剂反应
2. (可溶性)碱 + 非金属氧化物 →盐 + 水
3. (可溶性)碱 +盐→新碱 +新盐
4. 碱 + 酸 → 盐 + 水
1.碱溶液有相似的化学性质的原因是碱溶液中都含有( ) A. 氢离子 B. 氢氧根离子 C. 金属离子 D. 酸根离子
2.关于Ba(OH)2性质的描述中不属于碱的共同性质的是( )A.能与CO2反应生成水B.能与盐酸反应生成水C.能与Na2SO4溶液反应生成BaSO4沉淀D.能使紫色石蕊试液变蓝色
4.已知氢氧化锂(LiOH)可溶于水,其化学性质与氢氧化钠相似。下列对氢氧化锂化学性质的说法错误的是( )A.能与二氧化碳反应 B.能使无色酚酞试液变红C.能与稀硫酸反应 D.能使紫色石蕊试液变红
3.下列物质不能用于鉴别氢氧化钠溶液和稀盐酸的是( )A.紫色石蕊试液 B.氯化钠溶液 C.铁粉 D.pH试纸
浙教版九年级上册第4节 常见的碱一等奖ppt课件: 这是一份浙教版九年级上册<a href="/kx/tb_c98614_t3/?tag_id=26" target="_blank">第4节 常见的碱一等奖ppt课件</a>,文件包含14+常见的碱第2课时教学课件pptx、14常见的碱第2课时教学设计docx、14常见的碱第2课时分层作业原卷版docx、14常见的碱第2课时分层作业解析版docx、14常见的碱第2课时导学案教师版docx、14常见的碱第2课时导学案学生版docx等6份课件配套教学资源,其中PPT共30页, 欢迎下载使用。
初中科学第1章 物质及其变化第4节 常见的碱评课课件ppt: 这是一份初中科学第1章 物质及其变化第4节 常见的碱评课课件ppt,共16页。PPT课件主要包含了蓝色PH7,结论1,化学方程式,如何证明,CO2,NaOH,Na2CO3,H2O,[化学方程式],碱具有哪些共性等内容,欢迎下载使用。
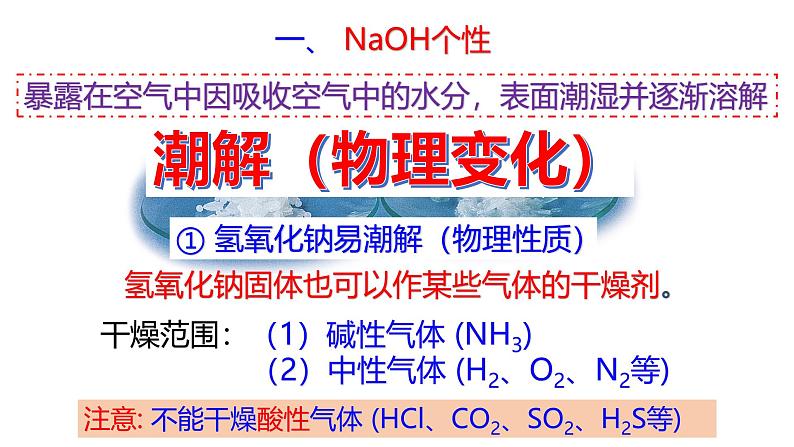
九年级上册第4节 常见的碱精品课件ppt: 这是一份九年级上册第4节 常见的碱精品课件ppt,共20页。PPT课件主要包含了碱的通性,你了解过碱的个性吗,几分钟后观察,白色片状固体,干燥剂,具有强烈的腐蚀性,兔毛溶解,粘合剂,易吸收水分而潮解,作干燥剂等内容,欢迎下载使用。













