




高中人教版 (2019)第一节 化学反应速率教课内容课件ppt
展开知识点一 影响化学反应速率的因素
1.化学反应速率的决定因素决定因素(内因):反应速率由反应物的______、______和______等因素决定。
(2)实验记录及结论(记录收集10 mL H2所用的时间)
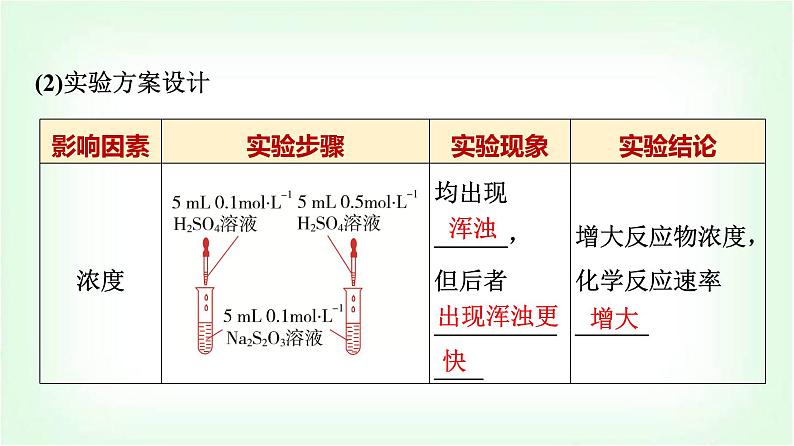
3.归纳总结在锌和不同浓度H2SO4溶液反应的实验中,比较反应速率快慢的方法:(1)定性描述——通过实验现象来判断反应的快慢:______________________________________________。(2)定量描述——通过实验测量来判断反应的快慢:__________________________________________________________________________________________________________________。
可以通过观察产生气泡的快慢判断反应速率的大小
可以根据产生相同体积的氢气所需要的时间来判断化学反应速率的快慢,也可通过相同时间内收集氢气的体积来比较反应的快慢
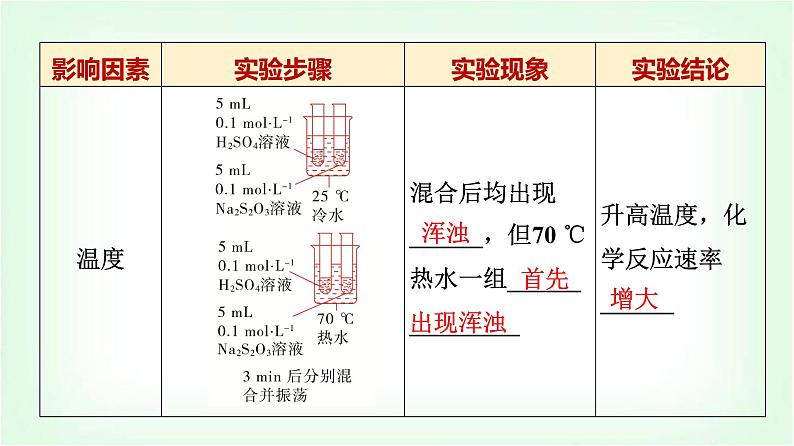
[教材·探究]1.某化学兴趣小组为探究外界条件对化学反应速率的影响,设计了四组实验。
回答下列问题:(1)V1、V2各是多少?(2)设计实验方案①和②的目的是什么?(3)设计实验方案②和④的目的是什么?(4)各实验方案为什么均需加入一定体积的水?
[提示] (1)5、10。(2)探究Na2S2O3的浓度对化学反应速率的影响。(3)探究温度对化学反应速率的影响。(4)保证各实验方案中混合液的体积均相等。
2.某同学在实验中发现酸性KMnO4溶液与H2C2O4溶液反应时,开始一段时间反应速率较慢,溶液褪色不明显,但不久突然褪色,反应速率明显加快,该同学认为是放热导致溶液温度升高所致。重做此实验,测定溶液不同时间的温度,结果如表:
回答下列问题:(1)写出此反应的离子方程式。(2)结合表中数据,解释反应速率明显加快的原因是什么?
3.设计实验测定锌与H2SO4溶液反应的速率,按下列实验步骤完成实验:
回答下列问题:(1)实验所用仪器,除锥形瓶、双孔塞、分液漏斗、直角导气管、50 mL注射器、铁架台外,还需要哪种仪器?(2)观察到的现象是什么?收集10 mL气体②所用时间比①所用时间长还是短?(3)通过该实验能得出的结论是什么?(4)利用硫代硫酸钠或重铬酸钾溶液与题述H2SO4溶液反应也可判断反应速率的快慢,请书写这两个反应的离子方程式。
知识点二 外界条件对化学反应速率的影响规律
1.改变固体或纯液体的量对化学反应速率无影响。2.浓度、温度、压强发生变化或加入催化剂时,正、逆反应速率均增大或减小,如升高温度,不论是放热反应还是吸热反应,化学反应速率均增大。
向一密闭容器中充入1 ml H2和1 ml I2,压强为p Pa,并在一定温度下使其发生反应:H2(g)+I2(g)⥫⥬2HI(g)。该密闭容器有一个可移动的活塞。
回答下列问题:(1)向下压缩活塞,使容器的压强增大,反应速率如何变化?(2)保持容器的容积不变,向其中充入氦气(He),反应速率如何变化?(3)保持容器内气体压强不变,向其中充入氦气(He),反应速率如何变化?
[提示] (1)压缩体积,增大压强,反应物的浓度增大,反应速率增大。(2)充入氦气,尽管总压强增大,但反应物的浓度不变,反应速率不变。(3)充入氦气,尽管压强不变,但容器的体积增大,反应物的浓度减小,反应速率减小。
2.在容器中发生反应C(s)+CO2(g)⥫⥬2CO(g),可使其化学反应速率增大的措施有( )①缩小体积 ②升高温度 ③恒容条件下通入CO2 ④增加碳的量 ⑤增大体积A.①②③④ B.②③④⑤C.①②③ D.②③④
C [有气体参与的反应,缩小体积,气态物质的浓度增大,化学反应速率增大,故①符合题意;升高温度,化学反应速率增大,故②符合题意;恒容条件下通入CO2,CO2浓度增大,化学反应速率增大,故③符合题意;增加碳的量,碳是固体,改变固体的量,化学反应速率不变,故④不符合题意;增大体积,气态物质的浓度减小,化学反应速率减小,故⑤不符合题意。]
3.硫酸工业是化学工业的基础工业之一。在密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g)⥫⥬2SO3(g),下列说法不正确的是( )A.保持容器压强不变,充入氦气,反应速率减小B.保持容器体积不变,充入氦气,反应速率增大C.保持容器体积不变,充入一定量的SO2,逆反应速率增大D.升高温度,正、逆反应速率均增大
B [A.保持容器压强不变,充入非反应气体氦气,容器体积增大,反应物浓度减小,化学反应速率减小,故A说法正确;B.保持容器体积不变,充入非反应气体氦气,反应物浓度不变,化学反应速率不变,故B说法不正确;C.保持容器体积不变,充入一定量的SO2,反应物浓度增大,化学反应速率增大,平衡向正反应方向移动,生成物浓度增大,逆反应速率增大,故C说法正确;D.升高温度,化学反应速率增大,即正、逆反应速率均加快,故D说法正确。]
题后归纳 解答压强对化学反应速率影响的关键——弄清“真”变还是“假”变若体系的压强变化使反应物或生成物的浓度发生变化即“真”变,否则是“假”变。如N2(g)+3H2(g)⥫⥬2NH3(g)(1)恒温恒容时:①充入气体反应物→总压增大→反应物浓度增大→反应速率增大。②充入不参与反应的气体(如He等)→引起总压增大,但各物质的浓度不变→反应速率不变。(2)恒温恒压时:充入不参与反应的气体(如He等)→引起体积增大→各反应物浓度减少→反应速率减小。
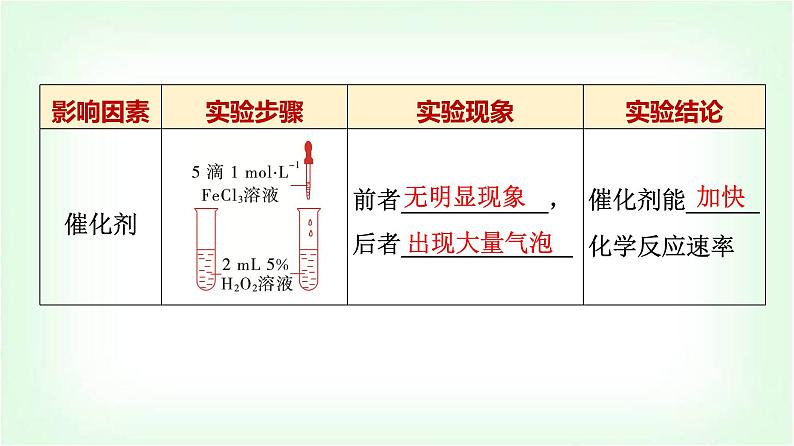
1.下列事实能说明影响化学反应速率的决定性因素是反应物本身性质的是( )A.Cu与浓硝酸剧烈反应,与稀硝酸缓慢反应B.H2和F2在低温时就可发生爆炸,而和I2在加热条件下才能反应C.H2、O2混合气体在常温、常压下无明显现象,点燃或放电时可剧烈反应D.H2O2溶液可缓慢分解放出无色气泡,加入FeCl3后无色气泡生成速率会明显加快
B [A.硝酸的浓度不同,反应速率不同,浓度为外因,故A不选;B.F的非金属性比I的强,所以H2和F2反应的条件较容易,即反应物本身性质决定反应速率,故B选;C.点燃或放电为反应条件,是外因,故C不选;D.加入FeCl3作为催化剂加快反应速率,为外因,故D不选。]
2.(教材互鉴:改编自鲁科版教材)在一密闭容器中充入1 ml H2和1 ml I2,在一定温度下使其发生反应:H2(g)+I2(g)⥫⥬2HI(g) ΔH<0。下列说法正确的是( )A.保持容器容积不变,向其中加入1 ml H2(g),反应速率加快B.保持容器容积不变,向其中加入1 ml N2(N2不参加反应),反应速率一定加快C.保持容器内气体压强不变,向其中加入1 ml N2(N2不参加反应),反应速率一定加快D.保持容器内气体压强不变,向其中加入1 ml H2(g)和1 ml I2(g),反应速率一定加快
A [增大反应物的浓度,反应速率加快,A项正确;加入氮气,因为容器容积不变,体系中各气体的浓度不变,故反应速率不变,B项错误;保持容器中压强不变,加入氮气,容器容积增大,反应体系中各气体的浓度减小,反应速率减慢,C项错误;保持压强不变,再次充入1 ml H2(g)和1 ml I2(g),则容器容积增大为原来的2倍,反应体系中各气体的浓度不变,反应速率不变,D项错误。]
3.对于在同一容器中进行的反应:C(s)+H2O(g)⥫⥬CO(g)+H2(g),下列说法错误的是( )A.增加C(s)的量,可以加快反应速率B.升高温度,可以加快反应速率C.保持体积不变,充入He,反应速率不变D.将容器体积扩大至原来2倍,反应速率减慢
A [A.C是固体,浓度视为常数,增加C(s)的量不影响反应速率,故A错误;B.升高温度,增大活化分子数目,有效碰撞概率增加,反应速率加快,故B正确;C.保持体积不变,充入He,各物质的浓度不变,则反应速率不变,故C正确;D.容器体积增大,压强减小,反应物浓度减小,反应速率减慢,故D正确。]
4.已知:2KMnO4+5H2C2O4+3H2SO4===2MnSO4+K2SO4+10CO2↑+8H2O。某化学小组欲探究该反应过程中浓度、温度对化学反应速率的影响,进行实验(忽略溶液体积变化)。
下列说法错误的是( )A.V1=1,V2=2B.实验Ⅲ中用KMnO4浓度变化表示的反应速率v(KMnO4)=0.01 ml·L-1·min-1C.实验Ⅰ、Ⅲ的目的是探究温度对化学反应速率的影响D.若改用0.1 ml·L-1酸性KMnO4溶液,也能达到实验目的
5.某同学利用反应:Na2S2O3+H2SO4===Na2SO4+SO2↑+S↓+H2O,探究外界条件对化学反应速率的影响。反应过程中溶液出现浅黄色浑浊和有刺激性气味的气体,得到各组实验数据如下表:
(1)实验Ⅰ、Ⅱ探究____________________对化学反应速率的影响。V=_______,加入V mL蒸馏水的目的是_________________ __________。(2)实验Ⅱ、Ⅲ探究温度对化学反应速率的影响。实验表明,实验Ⅲ的反应速率最快,支持这一结论的实验现象是___________ _________________。
Na2S2O3溶液浓度
保持H2SO4溶液浓
高中化学苏教版 (2019)选择性必修1第一单元 化学反应速率示范课ppt课件: 这是一份高中化学苏教版 (2019)选择性必修1<a href="/hx/tb_c4009315_t3/?tag_id=26" target="_blank">第一单元 化学反应速率示范课ppt课件</a>,共60页。PPT课件主要包含了每一步反应,基元反应,反应机理,有效碰撞,平均能量,活化能,放出的能量,逆反应,电磁波,超声波等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第一节 化学反应速率课文内容课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第一节 化学反应速率课文内容课件ppt,共40页。PPT课件主要包含了目录索引等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第二节 水的电离和溶液的pH示范课ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第二节 水的电离和溶液的pH示范课ppt课件,文件包含人教版高中化学选择性必修1第3章第2节基础课时11酸碱中和滴定课件ppt、人教版高中化学选择性必修1第3章第2节基础课时11酸碱中和滴定学案doc等2份课件配套教学资源,其中PPT共59页, 欢迎下载使用。













