





人教版 (2019)必修 第一册第四章 物质结构 元素周期律第三节 化学键集体备课课件ppt
展开知识点一 离子键与离子化合物
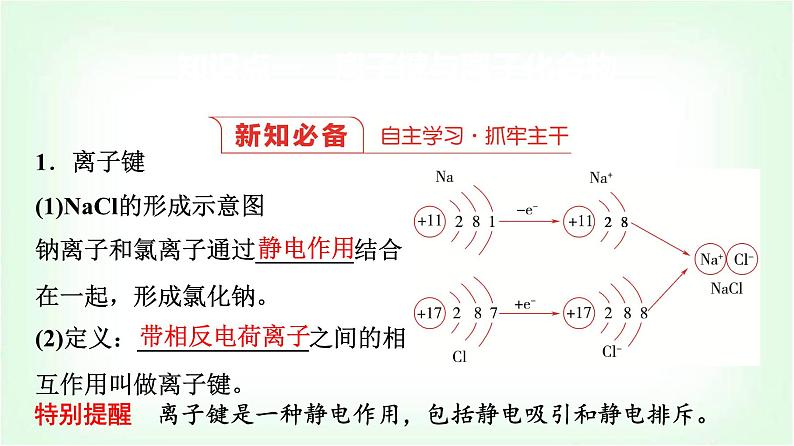
1.离子键(1)NaCl的形成示意图钠离子和氯离子通过________结合在一起,形成氯化钠。(2)定义:______________之间的相互作用叫做离子键。
特别提醒 离子键是一种静电作用,包括静电吸引和静电排斥。
2.离子化合物(1)定义:由______构成的化合物叫做离子化合物。(2)常见类别①碱:如NaOH、KOH、Ca(OH)2等。②大多数盐:如NaCl、K2SO4、NH4Cl等。③金属氧化物:如CaO、Na2O、Al2O3等。
特别提醒 (1)活泼金属元素与活泼非金属元素之间易形成离子键。(2)并不是所有的金属与非金属化合都能形成离子键,如AlCl3中不存在离子键。(3)非金属元素也可形成离子键。(4)离子化合物一定含有离子键,含离子键的化合物一定是离子化合物。
1.判断正误(正确的打“√”,错误的打“×”)。(1)离子化合物一定含有阴离子和阳离子。( )(2)熔融状态下能导电的物质一定是离子化合物。( )(3)离子键是阴离子和阳离子间的相互吸引力。( )(4)原子序数为12和9的原子所对应的元素可形成离子化合物。( )
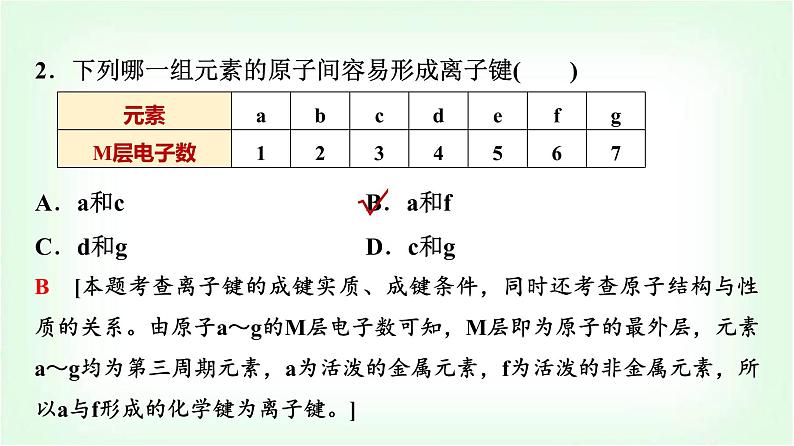
2.下列哪一组元素的原子间容易形成离子键( )A.a和c B.a和fC.d和gD.c和g
B [本题考查离子键的成键实质、成键条件,同时还考查原子结构与性质的关系。由原子a~g的M层电子数可知,M层即为原子的最外层,元素a~g均为第三周期元素,a为活泼的金属元素,f为活泼的非金属元素,所以a与f形成的化学键为离子键。]
3.有下列常见物质:①Na ②NaCl ③NaOH ④CaO ⑤Na2CO3 ⑥NaHCO3 ⑦CO2 ⑧H2SO4 ⑨Na2SO4 ⑩CaCl2(1)含有离子键的物质有____________________(填序号,下同)。(2)含有离子键的盐有_______________。(3)属于离子化合物的有____________________。
1.电子式的定义在元素符号周围用“·”或“×”来表示原子的________________的式子叫做电子式。
2.电子式的书写(1)原子的电子式:元素符号周围标明元素原子的最外层电子,每个方向不能超过2个电子。当最外层电子数小于或等于4时以单电子分布,多于4时多出部分以电子对分布。例如:
(2)简单阳离子的电子式:简单阳离子是由金属原子失电子形成的,原子的最外层已无电子,故用阳离子的符号表示,例如:Na+、Li+、Mg2+、Al3+等。(3)简单阴离子的电子式:不但要画出最外层电子数,而且还应用“[ ]”括起来,并在右上角标出“n-”以表示其所带的电荷。例如:
(4)离子化合物的电子式:
3.用电子式表示下列物质的形成过程(1)AB型(如NaCl): (2)AB2型(如MgCl2): (3)A2B型(如:Na2S):
4.书写电子式的注意事项(1)一个“·”或“×”代表一个电子,原子的电子式中“·”(或“×”)的个数即原子的最外层电子数。(2)“[ ]”在所有的阴离子、复杂的阳离子中出现。(3)在化合物中,如果有多个阴、阳离子,阴、阳离子必须是间隔的,即不能将两个阴离子或两个阳离子写在一起。(4)用电子式表示化合物形成过程时,由于不是化学方程式,不能出现“===”。“―→”前是原子的电子式,“―→”后是化合物的电子式。
1.下列化合物的电子式书写正确的是( )
2.下列用电子式表示的化合物的形成过程正确的是( )A. B. C. D.
C [NaBr的电子式应写成 ,A项错误;CaF2的电子式应写成 ,且方程式左边两个氟离子应分开写,B项错误;用电子式表示化合物的形成过程,应将“===”写成“―→”,D项错误。]
1.下列相关叙述不正确的是( )A.钠原子易失去一个电子,氯原子易得到一个电子B.钠离子与钠原子有相似的化学性质C.钠原子与氯原子作用生成NaCl后,其稳定性增强D.氯化钠是离子化合物
B [钠原子最外层只有1个电子,失去1个电子后形成的Na+具有最外层8个电子的稳定结构,氯原子最外层有7个电子,得到1个电子后形成的Cl-具有最外层8个电子的稳定结构,Na+和Cl-通过静电作用形成离子键,从而构成离子化合物NaCl。]
2.下列物质不是离子化合物的是( )A.HCl B.CaI2C.KOHD.NaNO3
3.下列各项中表达正确的是( )A.氟离子的结构示意图:B.氮原子的电子式:C.氯化钠的电子式:D.CaH2的形成过程:
D [A项,F-的核内质子数为9不是10,错误;B项,N的最外层电子数为5不是7,错误;C项,NaCl的电子式应为 ,错误。]
4.Y元素最高正价与最低负价的绝对值之差是4;Y元素与M元素形成离子化合物,并在水中电离出电子层结构相同的离子,该化合物是( )A.KClB.Na2SC.Na2OD.K2S
D [由信息“Y元素最高正价与最低负价的绝对值之差是4”,可确定Y元素位于第ⅥA族且不是氧元素;K2S电离出的K+与S2-具有相同的电子层结构。]
5.氮化钠(Na3N)是一种实施管制的化学品,它是一种重要的化合物,与水作用可产生NH3。请回答下列问题:(1)Na3N的电子式是____________________,该化合物是由________键形成的。(2)Na3N与盐酸反应生成_______________种盐,其电子式分别是_________________________________。
[解析] Na3N是由Na+和N3-通过离子键结合形成的离子化合物,电子式为 。由Na3N+3H2O===3NaOH+NH3↑,可知该反应属于复分解反应,当与盐酸反应时,生成NaCl、NH4Cl两种盐。
课时分层作业(三十) 离子键
(选择题只有一个选项符合题目要求)1.下列说法正确的是( )A.离子键就是阴、阳离子间的静电引力B.所有金属元素与所有非金属元素间都能形成离子键C.钠原子与氯原子结合成氯化钠后体系总能量降低D.在化合物CaCl2中,两个Cl-间也存在离子键
C [离子键是阴、阳离子间的静电作用力,包括静电吸引力和静电排斥力,A项错误;一般活泼金属元素与活泼非金属元素之间形成离子键,但不是所有金属元素与所有非金属元素间都能形成离子键,如AlCl3中就不存在离子键,B项错误;钠原子与氯原子结合成氯化钠后体系总能量降低,对外释放能量,C项正确;化合物CaCl2中,只存在Ca2+与Cl-之间的离子键,而两个Cl-间不存在离子键,D项错误。]
2.下列说法正确的是( )A.凡含离子键的化合物,一定含金属元素B.离子化合物一定导电C.强碱、盐、活泼金属氧化物不属于离子化合物D.原子序数为11与9的元素能够形成离子化合物,该化合物中存在离子键
D [A项,含离子键的化合物一定为离子化合物,不一定含金属元素,如NH4Cl中含有离子键,但不含金属元素。B项,离子化合物为固体时不导电,熔融态或水溶液导电。C项,强碱、盐、活泼金属氧化物中均含有离子键,都属于离子化合物。D项,原子序数为11与9的元素是Na、F,属于活泼金属元素与活泼非金属元素,可形成含离子键的离子化合物。]
B [A中锂原子的电子式应为Li·;C中Cl-的电子式应为 ;D中Na2O的电子式应为 。]
3.下列电子式的书写正确的是( )
4.用电子式表示下列离子化合物的形成过程:BaCl2:______________________________________________;NaF:________________________________________________;MgS:________________________________________________;K2O:__________________________________________________。
5.CaH2属于离子化合物,是一种生氢剂,其与水反应的化学方程式为CaH2+2H2O===Ca(OH)2+2H2↑,回答下列问题。(1)上述方程式中除CaH2外,属于离子化合物的还有__________。(2)CaH2中阴、阳离子个数比为________,写出CaH2的电子式_____________________。
[H∶]-Ca2+[∶H]-
(选择题有一个或两个选项符合题目要求)6.A元素原子的核电荷数为11,B元素原子的质子数为8,A和B化合形成化合物Z,下列说法中错误的是( )A.A形成+1价阳离子B.Z一定能与水反应C.Z一定是MO型离子化合物D.Z中含有离子键
C [由题意分析可知,A是Na,B是O,它们可以形成Na2O和Na2O2,均可以与水反应,均含有离子键。]
7.M元素的1个原子失去2个电子转移到Y元素的2个原子中去,形成离子化合物Z。下列说法中正确的是( )A.Z可表示为MY2B.Z可表示为M2YC.Z的电子式可表示为D.M形成+2价阳离子
AD [M的一个原子失去2个电子,转移到2个Y原子中,故离子化合物Z可表示为MY2,A正确、B错误;Z的电子式不应把2个Y-合并,C错误;M形成+2价阳离子,D正确。]
8.设X、Y、Z代表三种元素。已知:①X+和Y-两种离子具有相同的电子层结构;②Z元素原子核内质子数比Y元素原子核内质子数少9个;③Y和Z两种元素可以形成四核42个电子的-1价阴离子。据此,请填空:(1)写出X、Y、Z三种元素的名称:X________,Y________,Z________。
(2)X、Y两种元素最高价氧化物对应水化物反应的离子方程式为____________________________________________________。(3)用电子式表示X、Z形成化合物的过程:________________________________________________________。
H++OH-===H2O
高中化学人教版 (2019)必修 第一册第二章 海水中的重要元素——钠和氯第三节 物质的量说课课件ppt: 这是一份高中化学人教版 (2019)必修 第一册<a href="/hx/tb_c161983_t3/?tag_id=26" target="_blank">第二章 海水中的重要元素——钠和氯第三节 物质的量说课课件ppt</a>,共42页。PPT课件主要包含了含有一定数目粒子,物质的量,mol,02×1023,知识点二摩尔质量,5mol,g·mol-1,随堂评估·知能落实,709×1024,107×1024等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第一章 物质及其变化第三节 氧化还原反应课堂教学课件ppt: 这是一份高中化学人教版 (2019)必修 第一册<a href="/hx/tb_c161975_t3/?tag_id=26" target="_blank">第一章 物质及其变化第三节 氧化还原反应课堂教学课件ppt</a>,共48页。PPT课件主要包含了非氧化还原反应,随堂评估·知能落实,HNO3,铜元素,氮元素,NO2↑+2H2O等内容,欢迎下载使用。
高中第二节 离子反应课堂教学ppt课件: 这是一份高中<a href="/hx/tb_c161973_t3/?tag_id=26" target="_blank">第二节 离子反应课堂教学ppt课件</a>,共50页。PPT课件主要包含了实验探究,有白色沉淀产生,+H2O,不可以,随堂评估·知能落实,中和过量的NaOH,排除OH-的干扰,溶液由红色变为无色,可溶性硫酸盐,稀硫酸等内容,欢迎下载使用。













