





第十一章 第55讲 以物质含量(或组成)测定为主的综合实验-2025年高考化学一轮总复习课件
展开1.重量分析法(1)沉淀法先将某种成分转化为沉淀,然后称量纯净、干燥的沉淀的质量,再进行相关计算。
(2)热重法只要物质受热时发生质量变化,都可以用热重法来研究物质的组成。热重法是在控制温度的条件下,测量物质的质量与温度关系的方法。通过分析热重曲线,我们可以知道样品及其可能产生的中间产物的组成、热稳定性、热分解情况及生成产物等与质量相联系的信息。
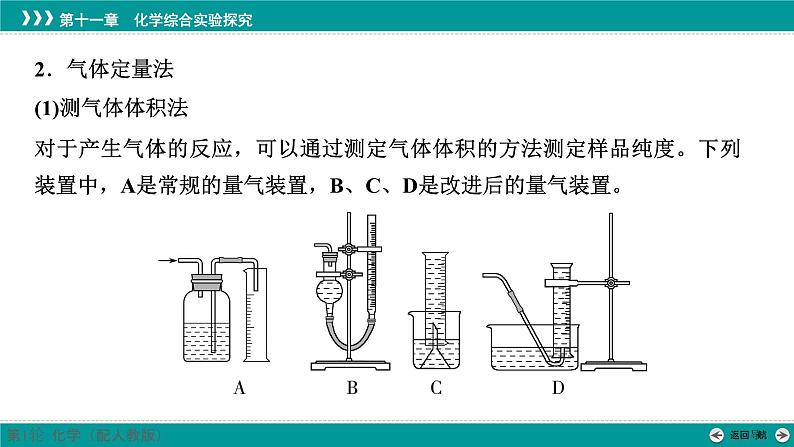
2.气体定量法(1)测气体体积法对于产生气体的反应,可以通过测定气体体积的方法测定样品纯度。下列装置中,A是常规的量气装置,B、C、D是改进后的量气装置。
(2)测气体质量法将生成的气体通入足量的吸收剂中,通过称量实验前后吸收剂的质量,求得所吸收气体的质量,然后进行相关计算。
3.滴定分析法(1)连续滴定法:第一步滴定反应生成的产物,还可以继续参加第二步的滴定。根据第二步滴定的消耗量,可计算出第一步滴定的反应物的物质的量。(2)返滴定法:第一步用的滴定剂是过量的,第二步再用另一种物质返滴定过量的物质。根据第一步加入的量减去第二步中过量的量,即可得出第一步所求物质的物质的量。
(1)制备SiHCl3时进行操作:(ⅰ)……;(ⅱ)将盛有硅粉的瓷舟置于管式炉中;(ⅲ)通入HCl,一段时间后接通冷凝装置,加热开始反应。操作(ⅰ)为________;判断制备反应结束的实验现象是__________________________。图示装置存在的两处缺陷是①________________;②__________________。
(2)采用如下方法测定溶有少量HCl的SiHCl3纯度。m1 g样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:①____________,②____________(填操作名称),③称量等操作,测得所得固体氧化物质量为m2 g,从下列仪器中选出①、②中需使用的仪器,依次为________(填标号)。测得样品纯度为______(用含m1、m2的代数式表示)。
答案:(1)组装好实验仪器,检查装置气密性 蒸馏烧瓶中液体不再增加 ①装置C、D之间缺少吸水(或干燥)装置 ②装置D之后无尾气(H2)收集装置
(1)因该实验中有气体通入和产生,故实验开始前必须先检查装置气密性;制备反应结束时,管式炉中硅粉转化为SiHCl3且被冷凝后进入蒸馏烧瓶,因此可通过观察蒸馏烧瓶中液体物质不再增加来判断反应结束。因SiHCl3易水解,需在装置C、D之间增加吸水(或干燥)装置;产物氢气是可燃性气体且无法被NaOH溶液吸收,需要另增加氢气收集装置(如储气瓶、气球等)。(2)样品经水解、干燥等预处理后,得到硅酸水合物;再将硅酸水合物置于坩埚中灼烧,转化为SiO2,然后将坩埚放入干燥器中干燥,反复2~3次后称量,m2 g即为所得固体氧化物SiO2的质量。依据上述分析,实验操作①为灼烧,②为干燥,①、②中需使用的仪器为A、C。
[练] (2023·湖北省九师联盟联考)氨基钠(NaNH2)常用作有机合成的还原剂、脱水剂。某学习小组的同学用如图1装置,以NH3和Na为原料加热至350~360 ℃制备氨基钠,并检验其生成的产物和测定产品的纯度。
已知:NaNH2极易水解且易被空气氧化。回答下列问题:(1)实验时,应先关闭K2,打开K1,通一段时间He,目的是______________________________________________________________。(2)仪器M名称为________,试剂X为_______________________________。(3)装置A中发生反应的化学方程式为________________________________,能证明气体产物的实验现象是_____________________________________。
(4)装置C的作用是_______________________________________________________________________________________________________________。(5)制备时,通入的氨过量,待钠充分反应后,取m g产品,按如图2装置进行实验(产品所含杂质与水反应不放气体)。用注射器向试管中缓慢加入H2O至恰好完全反应立即停止,G中液面从刻度V1变为V2(已知V2>V1,数据已折合为标准状况,单位mL),若忽略固体体积,读取刻度时保持两处液面相平,则产品纯度为________;若读取V1时,G中液面低于漏斗侧液面,则所测得的纯度比实际产品纯度________(填“偏高”“偏低”或“无影响”)。
物质组成计算的常用方法
考向 物质组成的测定及分析 [例] 碱式碳酸钴[Cx(OH)y(CO3)z]常用作电子材料、磁性材料的添加剂,受热时可分解生成三种氧化物。为了确定其组成,某化学兴趣小组的同学设计了如图所示装置进行实验。
(1)请完成下列实验步骤:①称取3.65 g样品置于硬质玻璃管内,称量装置乙、丙的质量;②按如图所示装置组装好仪器,并检查装置气密性;③加热装置甲中玻璃管,当装置乙中____________________________(填实验现象),停止加热;④打开活塞a,缓缓通入空气数分钟后,称量装置乙、丙的质量;⑤计算。
(2)步骤④中缓缓通入空气数分钟的目的是_______________________________________________________________________________________________。(3)某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用下列装置中的______(填标号)连接在________(填装置连接位置)。
(4)若按正确装置进行实验,测得如下数据:
则该碱式碳酸钴的化学式为_____________________________________。
答案:(1)不再有气泡产生时(2)将装置甲中产生的H2O(g)和CO2全部排入装置乙、丙中(3)D 活塞a前(或装置甲前)(4)C3(OH)4(CO3)2
[练] K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾晶体)为翠绿色晶体,可用于摄影和蓝色印刷,110 ℃失去结晶水,230 ℃分解。某化学研究小组的同学对K3[Fe(C2O4)3]·3H2O受热分解生成的气体产物和固体产物进行探究。实验一:探究实验所得的气体产物,按如图装置进行实验(夹持仪器已略去,部分装置可重复使用)。
(1)实验室常用饱和NH4Cl和饱和NaNO2的混合液制N2,反应的化学方程式为____________________________________________________________________________________________________________________________________。(2)装置的连接顺序为A→_____→_____→_____→________→________→F(填各装置的字母代号)。
(3)检查装置气密性后,先通一段时间N2,其目的是______________________,实验结束时熄灭A、C两处的酒精灯,继续通N2至常温,其目的是________________________________________________________________________。(4)实验过程中观察到前一个F中的溶液变浑浊,C中有红色固体生成,则气体产物为____________________________________________(填化学式)。
实验二:分解产物中固体成分的探究(5)定性实验:经检验,固体成分含有K2CO3、FeO、Fe。定量实验:将固体产物加水溶解、过滤、洗涤、干燥,得到含铁样品。完成上述实验操作,需要用到下列仪器中的________(填仪器标号)。
你认为以上方案中可以确定样品组成的有________方案。(6)经测定产物中n(FeO)∶n(Fe)=1∶1,写出K3[Fe(C2O4)3]·3H2O分解的化学方程式:________________________________________________________________________________________________________________________。
1.碱式碳酸镁可用于生产牙膏、医药和化妆品等,化学式为4MgCO3·Mg(OH)2·5H2O,某碱式碳酸镁样品中含有SiO2杂质,为测定其纯度,某兴趣小组的同学设计了如下几个方案:方案 Ⅰ 取一定质量的样品,与稀硫酸充分反应,通过测定生成CO2的质量计算纯度。
(1)装置乙中发生反应的化学方程式为______________________________________________________________________________________________________。(2)仪器接口的连接顺序为(装置可以重复使用)a→_______________________。方案 Ⅱ ①称取碱式碳酸镁样品m g;②将样品充分高温煅烧,冷却后称量;③重复操作②,测得剩余固体质量为m1 g。
(3)下列仪器中,方案 Ⅱ 不会用到的是_________________________(填标号)。
(4)判断样品完全分解的方法是_____________________________________________________________________________________________________________。
(2)打开K,通过装置甲吸收通入的空气中的二氧化碳,防止干扰产生的二氧化碳的测定,排净装置内的空气,关闭K,通过装置乙的分液漏斗滴入稀硫酸发生反应生成二氧化碳、水和硫酸镁,通过装置丁吸收气体中的水蒸气,通过装置丙吸收生成的二氧化碳测定其质量,为避免空气中二氧化碳、水蒸气进入干燥管,可以再连接一个干燥管,则装置顺序为a→d→e→b→c→b。
2.(2024·山西忻州名校联考)LiAlH4是一种优质还原剂,是运载火箭的固体燃料。某实验小组的同学利用“循环利用氯化锂法”制备LiAlH4,实验步骤如下:①制备LiH:氯化锂、钠、氢气在500~600 ℃下反应得到混合物;②制备LiAlH4:将LiH与乙醚的混合物与无水氯化铝直接反应。
回答下列问题:(1)装置C中的试剂是________,装置E的作用是________________________________________________________________。(2)制备LiAlH4的化学方程式为________________________________________________________________________________________________________。
(3)纯锌与稀硫酸反应制氢气比粗锌与稀硫酸反应制氢气慢,其原因是________________________________________________________________;装置B中发生反应的离子方程式为_____________________________________________________________________________________________________。(4)用上述方法合成四氢铝锂产品。设计如下方案测LiAlH4产品纯度。已知:LiAlH4+4H2O===Li[Al(OH)4]+4H2↑,LiH+H2O===LiOH+H2↑。
方案1:取w g产品与足量水反应,向溶液中通入足量CO2,经过滤、洗涤、灼烧至恒重,冷却、称重,测得固体质量为a g。方案2:如图,反应前,量气管内液体读数为V1 mL。Y形管中固体完全反应后,充分冷却,调平液面、读数,测得读数为V2 mL(常温下,气体摩尔体积为Vm L/ml)。
①若不含LiH,根据方案2测得数据计算出产品纯度为________(已知该量气管0刻度线在上方)。②下列情况会导致测定结果偏高的是______(填标号)。A.方案2的产品中混有少量LiHB.方案1中灼烧时粉末外溅C.方案2中终点读数时M中液面低于量气管中液面D.方案2中Y形管内残留有氢气
3.(2023·重庆卷)煤的化学活性是评价煤气化或燃烧性能的一项重要指标,可用与焦炭(由煤样制得)反应的CO2的转化率α来表示。研究小组设计测定α的实验装置如下:
(1)装置 Ⅰ 中,仪器a的名称是________________;b中除去的物质是________________(填化学式)。(2)①将煤样隔绝空气在900 ℃加热1小时得焦炭,该过程称为________。②装置 Ⅱ 中,高温下发生反应的化学方程式为________________________________________________________________。
③装置 Ⅲ 中,先通入适量的气体X,再通入足量氩气。若气体X被完全吸收,则可依据d和e中分别生成的固体质量计算α。i.d中的现象是__________________________________________________。ii.e中生成的固体为Ag,反应的化学方程式为________________________________________________________________。iii.d和e的连接顺序颠倒后将造成α________(填“偏大”“偏小”或“不变”)。
iv.在工业上按照国家标准测定α:将干燥后的CO2(含杂质N2的体积分数为n)以一定流量通入装置 Ⅱ 反应,用奥氏气体分析仪测出反应后某时段气体中CO2的体积分数为m,此时α的表达式为________。
(1)装置 Ⅰ 中,仪器a的名称是分液漏斗;由于二氧化碳中含有挥发的氯化氢,因此b中碳酸氢钠与氯化氢反应,则除去的物质是HCl。(2)①将煤样隔绝空气在900 ℃加热1小时得焦炭,即隔绝空气加强热使之分解,则该过程称为干馏。③i.d中二氧化碳和氢氧化钡反应生成碳酸钡沉淀和水,其反应的现象是有白色沉淀生成。ii.e中生成的固体为Ag,根据氧化还原反应分析得到CO变为碳酸铵,则反应的化学方程式为CO+2[Ag(NH3)2]OH===2Ag↓+(NH4)2CO3+2NH3。
iii.d和e的连接顺序颠倒,二氧化碳和银氨溶液反应,导致二氧化碳消耗,与氢氧化钡反应的二氧化碳的量减少,则将造成α偏大。iv.将干燥后的CO2(含杂质N2的体积分数为n)以一定流量通入装置 Ⅱ 反应,用奥氏气体分析仪测出反应后某时段气体中CO2的体积分数为m,设此时气体物质的量为b ml,二氧化碳物质的量为bm ml,原来气体的物质的量为a ml,原来二氧化碳的物质的量为a(1-n)ml,氮气的物质的量为an ml,则消耗二氧化碳的物质的量为[a(1-n) -bm] ml,生成CO的物质的量为2[a(1-n) -bm] ml,
高考化学一轮复习第11章化学综合实验第55讲物质制备型综合实验课件: 这是一份高考化学一轮复习第11章化学综合实验第55讲物质制备型综合实验课件,共60页。PPT课件主要包含了答案68%,答案91,相关信息列表如下,答案b等内容,欢迎下载使用。
2025届高考化学一轮总复习第11章化学综合实验第55讲物质制备型综合实验课件: 这是一份2025届高考化学一轮总复习第11章化学综合实验第55讲物质制备型综合实验课件,共60页。PPT课件主要包含了答案68%,答案91,相关信息列表如下,答案b等内容,欢迎下载使用。
大单元六 第十六章 第73讲 以物质含量或组成测定为主的综合实验-备战2025年高考化学大一轮复习课件(人教版): 这是一份大单元六 第十六章 第73讲 以物质含量或组成测定为主的综合实验-备战2025年高考化学大一轮复习课件(人教版),文件包含大单元六第十六章第73讲以物质含量或组成测定为主的综合实验pptx、大单元六第十六章第73讲以物质含量或组成测定为主的综合实验教师版docx、大单元六第十六章第73讲以物质含量或组成测定为主的综合实验学生版docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。












