






课件 高考化学一轮复习第九单元 水溶液中的离子反应和平衡 第36讲 盐类的水解
展开第36讲 盐类的水解
考点一 盐类的水解考点二 盐类水解的影响因素及应用经典真题·明考向作业手册
夯实必备知识 | 提升关键能力
水电离产生的H+或OH-
2. 水解离子方程式的书写
(1)多元弱酸盐水解: 进行,以 为主。 如Na2CO3水解的离子方程式: , 。 (2)多元弱碱阳离子水解:方程式 完成。 如FeCl3水解的离子方程式: 。 (3)阴、阳离子相互促进水解:水解程度较大,书写时要用“ = ”“↑”“↓”等。如NaHCO3与AlCl3溶液混合,反应的离子方程式: 。
Fe3++3H2O ⇌ Fe(OH)3+3H+
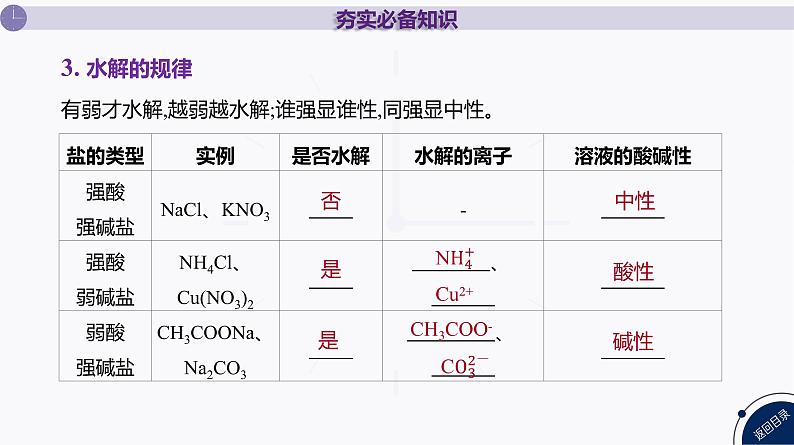
有弱才水解,越弱越水解;谁强显谁性,同强显中性。
(1)含义:盐类水解的平衡常数,称为水解常数,用Kh表示。(2)表达式:①对于A-+H2O ⇌ HA+OH-, Kh= ; ②对于B++H2O B ⇌ OH+H+, Kh= 。 (3)意义和影响因素①Kh越大,表示相应盐的水解程度 。 ②Kh只受温度的影响,升高温度,Kh值 。
1.判断正误(正确的打“√”,错误的打“×”)(1)溶液呈中性的盐一定是强酸、强碱生成的盐( )(2)某盐溶液呈酸性,该盐一定发生了水解反应( )(3)酸式盐溶液可能呈酸性,也可能呈碱性( )
[解析] (2)NaHSO4溶液呈酸性,因为电离产生H+,错误。
[解析] (1)溶液呈中性的盐可能是弱酸弱碱盐,错误。
(4)NaHCO3、NaHSO3都能促进水的电离( )(5)Na2S溶液显碱性的原因:S2-+2H2O ⇌ H2S+2OH-( )(6)在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-)( )
[解析] (5)S2-分步水解,分步书写其水解方程式,错误。
[解析] (6)CH3COONa溶液因水解呈碱性,加入适量CH3COOH后若溶液呈中性,则存在c(Na+)=c(CH3COO-),正确。
[解析] (7)常温下pH=10的CH3COONa溶液中水电离的c(OH-)=10-4 ml·L-1, pH=4的NH4Cl溶液中水电离的c(H+)=10-4 ml·L-1,水的电离程度相同,正确。
2.已知25 ℃时,草酸的电离常数K1=5.0×10-2、K2=5.2×10-5;碳酸的电离常数K1=4.4×10-7、K2=4.7×10-11,则NaHC2O4溶液的pH (填“>”“<”或“=”,下同)7,NaHCO3溶液的pH 7。
题组一 盐类水解原理及规律
2.[2023·浙江镇海中学模拟] 25 ℃时,浓度均为1.0 ml·L-1的四种正盐溶液:AX、BX、AY、BY;AX溶液的pH=7,且溶液中c(X-)=1.0 ml·L-1,BX溶液的pH=4,BY溶液的pH=6。下列说法正确的是( )A.电离平衡常数Kb(BOH)小于Ka(HY)B.AY溶液的pH小于BY溶液的pHC.稀释相同倍数,溶液pH的变化:BX等于BYD.将浓度均为1 ml·L-1的HX和HY溶液分别稀释到体积为原来的10倍,HX溶液的pH大于HY
[解析] 根据BY溶液的pH=6,B+比Y-更易水解,则BOH比HY更难电离,因此电离平衡常数Kb(BOH)小于Ka(HY),A正确;根据AX、BX、BY溶液的pH及1.0 ml·L-1AX溶液中c(X-)=1.0 ml·L-1可知,AX为强酸强碱盐,BX为强酸弱碱盐,BY为弱酸弱碱盐,则AY为弱酸强碱盐,其溶液的pH>7,故AY溶液的pH大于BY溶液的pH,B错误;稀释相同倍数,BX、BY溶液的pH均增大,且BX溶液的pH变化大于BY溶液,C错误;HX为强酸,HY为弱酸,浓度相同时,稀释到体积为原来的10倍后,HY的电离程度增大,但仍不可能全部电离,故HX溶液的酸性强,pH小,D错误。
题组二 电离常数与盐类水解常数的关系
4. 25 ℃时,相关物质的电离常数如下表:请回答下列问题:(1)25 ℃时,在0.5 ml·L-1的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的 倍。
(2)写出向氰化钠溶液中通入少量CO2的离子方程式: 。
(4)25 ℃时,将a ml·L-1的醋酸溶液与b ml·L-1氢氧化钠溶液等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离常数为 。
(6)某温度时,纯水的pH=6。向该温度下的纯水中加入少量的碳酸钠固体,使溶液pH为9,则水电离出的c(OH-)= ml·L-1。
考点二 盐类水解的影响因素及应用
1. 影响盐类水解平衡的因素
(1)内因:形成盐的酸或碱越弱,其盐就越易水解。如水解程度:Na2CO3 Na2SO3,Na2CO3 NaHCO3。 (2)外因
(3)以FeCl3水解为例[Fe3++3H2O ⇌ Fe(OH)3+3H+],填写外界条件对水解平衡的影响。
生成红褐色沉淀,放出气体
Al3+水解形成Al(OH)3胶体
Fe3++3H2O ⇌ Fe(OH)3+3H+,H+可抑制Fe3+的水解
Fe3++3H2O ⇌ Fe(OH)3+3H+,MgO+2H+ = Mg2++H2O,使Fe3+水解平衡右移直至沉淀完全
判断正误(正确的打“√”,错误的打“×”)(1)能水解的盐的浓度越低,水解程度越大,溶液的酸碱性越强( )(2)加水稀释,水解常数Kh增大,pH减小( )(3)试管中加入2 mL饱和Na2CO3溶液,滴入两滴酚酞,加热,溶液先变红,后红色变浅( )
[解析] (2)水解常数只受温度影响,加水稀释,水解常数不变,错误。
[解析] (1)能水解的盐的浓度越低,水解程度越大,溶液的酸碱性越弱,错误。
[解析] (4)加入CuSO4固体,生成硫化铜沉淀,硫离子浓度降低,S2-水解平衡逆向进行,HS-浓度减小,正确。
[解析] (6)酚酞的变色范围是8.2~10,恰好变成无色时,pH>7,错误。
题组一 盐类水解的影响因素
【归纳总结】从定性、定量两个角度理解影响盐类水解的因素(1)盐类水解易受温度、浓度、溶液的酸碱性等因素的影响,以氯化镁水解为例,当改变条件如升温、通入HCl气体、加水、加碳酸氢钠等时,应从平衡移动方向、pH的变化、水解程度、现象等方面去分析。(2)稀释溶液过程中,盐的浓度减小,水解程度增大,但由于溶液中盐电离出来的离子浓度是减小的,故水解引起溶液的酸性(或碱性)减弱。(3)水解平衡常数(Kh)只受温度的影响,它与电离平衡常数(Ka)、水的离子积(KW)的定量关系为Ka·Kh=KW。
题组二 盐类水解的应用
3.下列事实与盐类水解有关的是( )①NaHCO3水溶液呈碱性 ②NaHSO4水溶液呈酸性 ③长期使用铵态氮肥,会使土壤酸度增大 ④铵态氮肥不能与草木灰混合施用 ⑤加热能使纯碱溶液去污能力增强 ⑥配制FeCl3溶液,需用盐酸溶解FeCl3固体⑦泡沫灭火器中硫酸铝溶液与碳酸氢钠溶液混合⑧用FeS除去废水中的Cu2+A.除⑥以外B.除②⑥以外C.除②⑧以外D.以上全部
[解析] ①NaHCO3是强碱弱酸盐,水解使溶液呈碱性,与盐的水解反应有关;②NaHSO4是强酸的酸式盐,电离产生H+使其水溶液呈酸性,与盐的水解反应无关;③铵态氮肥中铵根离子水解使溶液显酸性,因此长期使用铵态氮肥,会使土壤酸度增大,与盐的水解反应有关;④铵态氮肥水解使溶液显酸性,草木灰的主要成分是K2CO3,水解使溶液显碱性,二者混合使用,会导致部分铵态氮肥变为NH3逸出,从而使肥效降低,故铵态氮肥不能与草木灰混合施用,与盐的水解反应有关;⑤纯碱是强碱弱酸盐,水解使溶液显碱性,盐的水解反应是吸热反应,加热升高温度,盐水解程度增大,能使溶液碱性增强,因而导致纯碱溶液去污能力增强,与盐的水解反应有关;
⑥FeCl3是强酸弱碱盐,水解产生难溶性Fe(OH)3,导致配制的FeCl3溶液变浑浊,为抑制盐的水解反应,在配制FeCl3溶液时,需用盐酸溶解FeCl3固体,然后加水稀释至所需浓度,与盐的水解反应有关;⑦铝离子水解显酸性,灭火器中溶液混合,硫酸铝和碳酸氢钠溶液发生反应生成氢氧化铝沉淀和二氧化碳气体,与盐类水解有关;⑧FeS溶解产生的S2-与溶液中的Cu2+结合产生CuS沉淀,与盐类水解无关。
4.已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性。将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需要溶液的pH分别为6.4、9.6、3.7。现有含FeCl2杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按如图所示步骤进行提纯: 请回答下列问题:(1)本实验最适合的氧化剂X是 (填字母)。 A.K2Cr2O7B.NaClOC.H2O2D.KMnO4
[解析] (1)能将Fe2+氧化为Fe3+,同时又不能引入新的杂质,符合要求的只有H2O2。
(2)物质Y是 。 (3)本实验用加碱沉淀法能不能达到目的? , 原因是 。 (4)除去Fe3+的离子方程式是 。 (5)加氧化剂的目的是 。 (6)最后能不能直接通过蒸发结晶得到CuCl2·2H2O晶体? 。应如何操作? 。
CuO[或Cu(OH)2或CuCO3或Cu2(OH)2CO3]
因为加碱的同时也会使Cu2+生成Cu(OH)2沉淀
2Fe3++3CuO+3H2O = 2Fe(OH)3+3Cu2+(或其他合理答案)
将Fe2+氧化为Fe3+,便于生成沉淀而与Cu2+分离
应在HCl气流中加热蒸发
[解析] (2)当CuCl2溶液中混有Fe3+时,可以利用Fe3+的水解:Fe3++3H2O ⇌ Fe(OH)3+3H+,加入CuO、Cu(OH)2、CuCO3或Cu2(OH)2CO3与溶液中的H+作用,从而使水解平衡右移,使Fe3+转化为Fe(OH)3沉淀而除去。(3)若用加碱法使Fe2+沉淀,同时也必将使Cu2+沉淀。(6)为了抑制CuCl2水解,应在HCl气流中加热蒸发。
【归纳总结】 盐溶液蒸干时所得产物的判断(1)盐溶液水解生成难挥发性酸时,蒸干后一般得原物质,如CuSO4(aq) CuSO4(s)。盐溶液水解生成易挥发性酸时,蒸干灼烧后一般得对应的氧化物,如AlCl3(aq) Al(OH)3 Al2O3。(2)酸根阴离子易水解的强碱盐,如Na2CO3溶液等蒸干后可得到原物质。(3)考虑盐受热时是否分解。Ca(HCO3)2、NaHCO3、KMnO4、NH4Cl固体受热易分解,因此蒸干灼烧后分别得到:CaCO3(CaO)、Na2CO3、K2MnO4和MnO2、NH3和HCl。(4)还原性盐在蒸干时会被O2氧化。例如Na2SO3(aq) Na2SO4(s)。
1. [2023·北京卷] 下列过程与水解反应无关的是( )A.热的纯碱溶液去除油脂B.重油在高温、高压和催化剂作用下转化为小分子烃C.蛋白质在酶的作用下转化为氨基酸D.向沸水中滴入饱和FeCl3溶液制备Fe(OH)3胶体
[解析] 纯碱溶液因碳酸根离子水解显碱性,升温促进水解反应正向进行,油脂在碱性条件下能水解生成易溶于水的高级脂肪酸盐和甘油,故可用热的纯碱溶液去除油脂,A不符合题意;重油在高温、高压和催化剂作用下发生裂化或裂解反应生成小分子烃,与水解反应无关,B符合题意;
蛋白质在酶的作用下可以发生水解反应生成氨基酸,C不符合题意;Fe3+能发生水解反应生成Fe(OH)3,加热能增大Fe3+的水解程度,D不符合题意。
1. 用含铁废铜制备胆矾的流程如图所示,下列说法错误的是( )A.流程中Cu2(OH)2CO3可用CuO代替B.“溶解”中加H2O2只是将Fe2+氧化为Fe3+C.加热煮沸的目的是使Fe3+充分水解进而去除沉淀D.“系列操作”前加入H2SO4的目的是抑制Cu2+的水解
[解析] Cu2(OH)2CO3和CuO都能消耗溶液中的氢离子,调节溶液pH使铁离子生成氢氧化铁沉淀,所以Cu2(OH)2CO3可用CuO代替,故A正确;“溶解”中加H2O2将Fe2+氧化为Fe3+,同时发生反应Cu+H2O2+2H+ = Cu2++2H2O使铜溶解,故B错误;加热能促进Fe3+水解,加热煮沸的目的是使Fe3+充分水解进而去除沉淀,故C正确;Cu2+易水解,“系列操作”前加入H2SO4的目的是抑制Cu2+的水解,防止生成氢氧化铜,故D正确。
2. [2023·湖北宜昌调研] 某小组同学探究KCl对Fe3++3SCN- ⇌ Fe(SCN)3平衡体系的影响。ⅰ.将等体积的0.005 ml·L-1 FeCl3溶液(已用稀盐酸酸化)和0.01 ml·L-1 KSCN溶液混合,静置至体系达平衡,得红色溶液a。ⅱ.各取3 mL溶液a放入3支比色皿中,分别滴加0.1 mL不同浓度的KCl溶液,并测定各溶液的透光率随时间的变化,结果如图所示:已知:①溶液的透光率与溶液颜色深浅有关,颜色深,透光率低。②在水溶液中,[FeCl4]-显黄色。
下列有关说法错误的是( )A.稀盐酸酸化FeCl3溶液的目的是抑制Fe3+水解B.实验中采用浓度较低的FeCl3溶液,主要是为了避免Fe(OH)3的颜色对实验产生干扰C.加入KCl溶液,Fe3+和SCN-平衡体系的K值不变D.随着KCl溶液浓度增大,Fe3++3SCN- ⇌ Fe(SCN)3平衡向逆反应方向移动
[解析] 氯化铁是强酸弱碱盐,铁离子在溶液中水解使溶液呈酸性,向氯化铁溶液中加入稀盐酸酸化的目的是抑制铁离子水解,故A正确;[FeCl4]-有颜色,采用浓度较低的FeCl3溶液制备Fe3+和SCN-平衡体系,是为了避免[FeCl4]-的颜色对实验产生干扰,故B错误;化学平衡常数K为温度的函数,温度不变,平衡常数不变,所以向平衡体系中加入氯化钾溶液时,反应的平衡常数不变,故C正确;
溶液中氯化钾浓度增大,溶液中氯离子浓度增大,生成[FeCl4]-的平衡即Fe3++4Cl- ⇌ [FeCl4]-向正反应方向移动,溶液中铁离子浓度越小,生成硫氰化铁的平衡即Fe3++3SCN- ⇌ Fe(SCN)3向逆反应方向移动,故D正确。
考点一 盐类水解的原理
1. [2023·广东惠州一模] 勤劳致富,越努力越幸福。下列劳动项目与所述的化学知识没有关联的是( )
[解析] 明矾净水的基本原理是明矾在水中能电离出铝离子,铝离子水解产生氢氧化铝胶体,胶体吸附水中杂质,与明矾具有氧化性无关;小苏打为NaHCO3,受热分解出CO2气体,可以用作发泡剂烘焙面包,B有关;碳酸钠为强碱弱酸盐,水解显碱性,加热促进盐类的水解,油脂可以在碱性环境下水解生成可溶性盐和甘油,所以可以用热的纯碱溶液洗去油污,C有关;厨余垃圾含N、P等元素,是植物生长需要的元素,所以可以用厨余垃圾制肥料,D有关。
2. 常温下,对于体积相等、pH相等的盐酸和氯化铵两溶液,下列说法正确的是( )A.两溶液导电能力相同 B.分别与等量且同条件的锌反应,平均反应速率后者大 C.稀释10倍后,盐酸的pH比氯化铵溶液的pH小 D.分别与等浓度的氢氧化钠溶液恰好反应,消耗的氢氧化钠溶液的体积相同
4. 已知:25 ℃时,Ka(CH3COOH)=1.8×10-5, Ka(HCN)=4.9×10-10。下列说法正确的是( )A.25 ℃时,CN-的水解常数Kh(CN-)≈2.04×10-4B.25 ℃时,反应CH3COOH+CN- ⇌ CH3COO-+HCN的平衡常数K≈3.67×104C.同浓度的CH3COONa溶液和NaCN溶液中,CH3COONa溶液的离子总浓度较小D.若加水稀释醋酸溶液,溶液中所有离子浓度均减小
5. 下列措施能使NaClO溶液的水解平衡正向移动,水解程度反而减小的是( )A.增大NaClO溶液浓度B.加水稀释C.升高温度D.加入适量NaOH固体
[解析] NaClO的水解方程式为ClO-+H2O ⇌ HClO+OH-,增大NaClO溶液浓度,水解平衡正向移动,但由于溶液浓度增大,所以水解程度减小,A正确;加水稀释,水解平衡正向移动,水解程度增大,B错误;水解是吸热过程,升高温度,水解平衡正向移动,水解程度增大,C错误;加入适量NOH固体,c(OH-)增大,水解平衡逆向移动,水解程度减小,D错误。
6. 用棕黄色FeCl3溶液探究影响盐类水解的因素,根据实验现象和原理,下列对水解程度的判断正确的是( )
[解析] 加FeCl3固体,c(Fe3+)增大,水解平衡向右移动,溶液变成红褐色,但水解程度减小,A错误;加热,水解平衡右移,溶液变成红褐色,水解程度增大,B错误;通入HCl气体,c(H+)增大,水解平衡左移,溶液颜色变浅,水解程度减小,C正确;加入NaCl溶液,相当于加水稀释,水解平衡向右移动,水解程度增大,D错误。
7. [2023·安徽合肥六中模拟] 用实验探究镁片与不同溶液反应的情况,下列基于实验现象得出的结论错误的是( )
8. 盐类水解在实验室和生产生活中有广泛的应用。(1)AgNO3的水溶液呈 (填“酸”“中”或“碱”)性,原因是 (用离子方程式表示);实验室在配制AgNO3溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后用蒸馏水稀释到所需浓度,目的是 。
[解析] (1)AgNO3溶液由于Ag+水解而呈酸性,Ag+水解的离子方程式为Ag++H2O ⇌ AgOH+H+;实验室在配制AgNO3溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后用蒸馏水稀释到所需浓度,目的是抑制Ag+水解。
Ag++H2O ⇌ AgOH+H+
(2)FeCl3净水的原理是 (用离子方程式表示);把AlCl3溶液蒸干、灼烧,最后得到的主要固体产物是 (写化学式)。
[解析] (2)FeCl3净水是因为Fe3+水解生成Fe(OH)3胶体,胶体具有吸附性,原理可表示为Fe3++3H2O ⇌ Fe(OH)3(胶体)+3H+;AlCl3水解的化学方程式为AlCl3+3H2O ⇌ Al(OH)3+3HCl,加热能促进水解平衡正移,而且盐酸易挥发,进一步使平衡正移,所以把AlCl3溶液蒸干、灼烧,Al(OH)3分解,最后得到的主要固体产物是Al2O3。
Fe3++3H2O ⇌ Fe(OH)3(胶体)+3H+
(3)泡沫灭火器内装有NaHCO3饱和溶液和Al2(SO4)3溶液,当意外失火时,使泡沫灭火器倒过来摇动即可使药液混合,喷出大量的白色泡沫,阻止火势蔓延,其相关反应的离子方程式为 。
考点三 盐类水解综合考查
12. 化学上把外加少量酸、碱,而pH基本不变的溶液,称为缓冲溶液。Ⅰ.现有25 ℃时,浓度均为0.10 ml·L-1的CH3COOH和CH3COONa的缓冲溶液,pH=4.76。已知25 ℃时Ka(CH3COOH)=1.75×10-5,Kh为盐的水解常数。回答下列问题:(1)25 ℃时Kh(CH3COO-)= (写表达式),计算Kh(CH3COO-)= (保留三位有效数字)。
(2)该缓冲溶液中离子浓度由大到小的顺序是 。
[解析] (2) 浓度均为0.10 ml·L-1的CH3COOH和CH3COONa的缓冲溶液,pH=4.76,溶液呈酸性,说明醋酸电离程度大于醋酸钠水解程度,该缓冲溶液中离子浓度由大到小的顺序是c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
(3)向1.0 L上述缓冲溶液中滴加几滴NaOH稀溶液(忽略溶液体积的变化),反应后溶液中c(H+)= ml·L-1。
[解析] (3)向1.0 L题述缓冲溶液中滴加几滴NaOH稀溶液(忽略溶液体积的变化),pH几乎不变,反应后溶液中c(H+)=1×10-4.76 ml·L-1。
课件 高考化学一轮复习第九单元 水溶液中的离子反应和平衡 第35讲 酸碱中和滴定及拓展应用: 这是一份课件 高考化学一轮复习第九单元 水溶液中的离子反应和平衡 第35讲 酸碱中和滴定及拓展应用,共60页。PPT课件主要包含了夯实必备知识,实验原理,滴定终点,实验用品,⑥使用注意事项,⑦使用方法,是否漏水,3mL,“0”刻度,粉红色等内容,欢迎下载使用。
课件 高考化学一轮复习第九单元 水溶液中的离子反应和平衡 第34讲 水的电离和溶液的pH: 这是一份课件 高考化学一轮复习第九单元 水溶液中的离子反应和平衡 第34讲 水的电离和溶液的pH,共60页。PPT课件主要包含了考点一水的电离,夯实必备知识,水的电离,水的离子积常数,×10-14,电解质,OH-,对点自测,③④⑤⑦,①②⑥等内容,欢迎下载使用。
课件 高考化学一轮复习第九单元 水溶液中的离子反应和平衡 第33讲 电离平衡: 这是一份课件 高考化学一轮复习第九单元 水溶液中的离子反应和平衡 第33讲 电离平衡,共60页。PPT课件主要包含了使用建议,教学建议,第33讲电离平衡,夯实必备知识,弱电解质,1定义与物质类别,大多数盐,电离产生离子,离子结合成分子,结合成弱电解质分子等内容,欢迎下载使用。












