





备战2025届新高考化学一轮总复习第8章水溶液中的离子反应与平衡第42讲盐类的水解课件
展开1.能用化学用语正确表示水溶液中的盐类水解平衡。能从盐类水解平衡的角度分析溶液的酸碱性等。2.通过实验证明水溶液中存在的盐类水解平衡,认识影响盐类水解的主要因素。3.结合真实情境中的应用实例,能综合运用离子反应、化学平衡原理,分析和解决生产、生活中有关电解质溶液的实际问题。
考点一 盐类的水解及规律
考点二 盐类水解的影响因素及应用
1.盐类的水解(1)盐类水解的条件
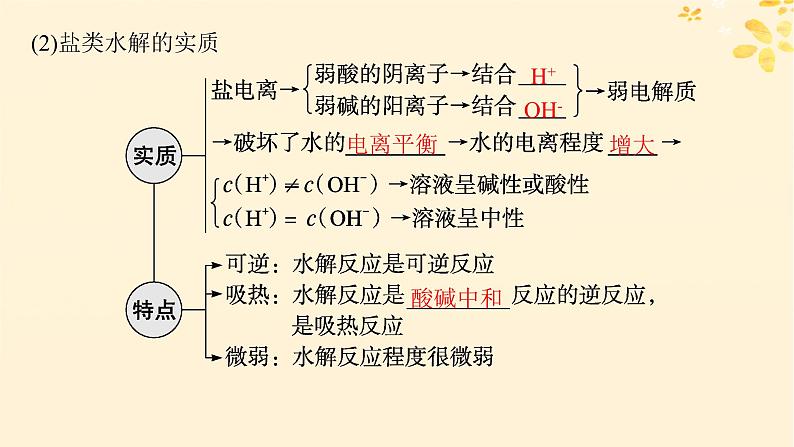
(2)盐类水解的实质
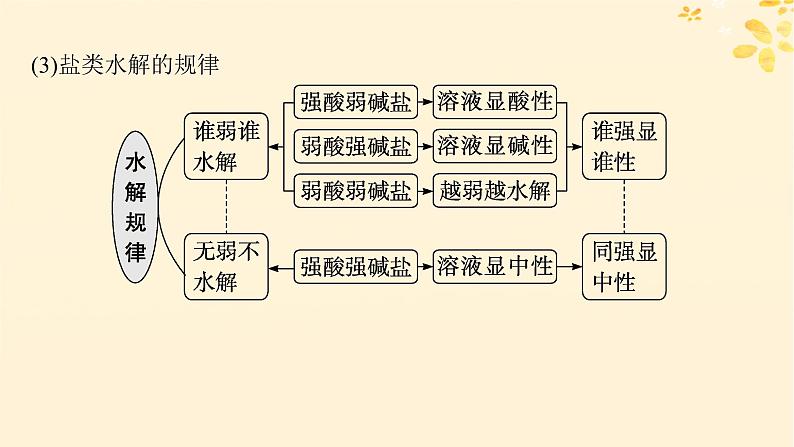
(3)盐类水解的规律
【应用示例】写出下列盐溶液中水解的离子方程式。(1)NH4Cl: __________________________________。 (2)Na2CO3: ______________________________________________。 (3)FeCl3: __________________________________。 (4)CH3COONH4: __________________________________________。 (5)Al2S3: __________________________________。 (6)AlCl3溶液和NaHCO3溶液混合: _________________________________。
2Al3++3S2-+6H2O══ 2Al(OH)3↓+3H2S↑
考向1 盐类水解的实质及规律例1已知HClO、CH3COOH在常温下的电离常数分别为4.0×10-8、1.8×10-5。常温下,物质的量浓度均为0.1 ml·L-1的六种溶液:①(NH4)2SO4溶液;②KNO3溶液;③NH4HSO4溶液;④NH4Cl溶液;⑤NaClO溶液;⑥CH3COONa溶液,则上述六种溶液的pH由小到大的顺序是( )A.③①④②⑤⑥B.③①④②⑥⑤C.③②①⑥④⑤D.⑤⑥②④①③
考向2 水解产物判断与方程式的书写例2下列离子方程式不正确的是( )
解析 硫化钠分步水解,生成的硫化氢具有臭味,离子方程式必须分步书写、没有气体符号、应使用可逆符号,D项错误。
[对点训练2] 物质与水发生的复分解反应称为水解反应。例如: Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑。在一定条件下,BrCl、CuCl2、Mg2C3和K3P均可以发生水解。根据上述观点,下列说法不正确的是( )A.BrCl的水解产物是HBrO和HClB.K3P的水解产物是KOH和H3PO4C.Mg2C3的水解产物是Mg(OH)2和C3H4D.CuCl2的水解产物是Cu(OH)2和HCl
考点二盐类水解的影响因素及应用
生成红褐色沉淀,放出气体
2.盐类水解在生产生活中的应用(1)水解产物性质的应用
③ZnCl2溶液可作焊接时的除锈剂的原因: _______________________。
Zn2+水解使溶液显酸性,能溶解铁锈
升高温度水解平衡向右移动,溶液的碱性增强,去污效果增强
碳酸钠的水解为吸热反应,
(3)抑制盐类水解的应用举例①在配制FeCl3、AlCl3、SnCl2等溶液时为抑制水解,常先将盐溶于少量________中,再加蒸馏水稀释到所需浓度。 ②用MgCl2·6H2O晶体得到纯的无水MgCl2操作方法及理由是__________________________________。
在干燥的HCl气流中加热MgCl2·6H2O,可以得到无水MgCl2,HCl气流能抑制MgCl2的水解,且带走MgCl2·6H2O因受热产生的水蒸气
考向1 外界条件对盐类水解的影响例1已知[FeCl4(H2O)2]-为黄色。加热指的是微热,忽略体积变化。
[对点训练1] 关于下列实验的说法不正确的是( )
解析 加热醋酸钠溶液促进CH3COO-的水解,使溶液的碱性增强,pH增大,故B错误。
考向2 盐类水解在生产和生活中的应用例2下列有关问题与盐的水解有关的是( )①NH4Cl与ZnCl2溶液可作焊接金属时的除锈剂②NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂③草木灰与铵态氮肥不能混合施用④实验室中盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞⑤加热蒸干CuCl2溶液得到Cu(OH)2固体⑥要除去FeCl3溶液中混有的Fe2+,可先通入氧化剂Cl2,再调节溶液的pHA.①②③B.②③④C.①④⑤⑥D.①②③④⑤
[对点训练2] 在空气中加热蒸干并灼烧下列盐溶液,将所得产物填入表格中。
CaO(或Na2CO3)
Fe2O3(或Al2O3)
Al2(SO4)3[或Fe2(SO4)3、CuSO4]
Na[Al(OH)4](或Na2CO3)
2.关于相同物质的量浓度的NaHCO3溶液和NaHSO3溶液,下列说法正确的是( )A.滴加酚酞后溶液均变红B.滴加饱和澄清石灰水均产生白色沉淀C.滴加氯水均产生能使澄清石灰水变浑浊的气体D.所含阳离子的总浓度相等
3.(2023·广东惠州检测)某化学研究学习小组对所学部分内容作了归纳总结(均指常温下),现摘录6条,其中错误的有( )①物质的量浓度相同的2种盐,若pH:NaX>NaY,则酸性:HX>HY②已知CH3COOH电离平衡常数为Ka,CH3COO-水解常数为Kh,水的离子积为KW,则三者关系为Ka·Kh=KW
⑤冰晶胞中水分子的空间排列方式与干冰晶胞类似⑥1 ml [Cu(NH3)4]2+中含有σ键的数目为12NAA.①⑤⑥B.①③⑤C.②④⑥D.③④⑥
进阶2 练热点·提素能4.实验测得0.5 ml·L-1 CH3COONa溶液、0.5 ml·L-1 CuSO4溶液以及H2O的pH随温度变化的曲线如图所示。下列说法正确的是( )A.随温度升高,纯水中c(H+)>c(OH-)B.随温度升高,CH3COONa溶液的c(OH-)减小C.随温度升高,CuSO4溶液的pH变化是KW改变与水解平衡移动共同作用的结果D.随温度升高,CH3COONa溶液和CuSO4溶液的pH均降低,是因为CH3COO-、Cu2+水解平衡移动方向不同
解析 任何温度时,纯水中H+浓度与OH-浓度始终相等,A项错误;随温度升高,CH3COONa水解程度增大,溶液中c(OH-)增大,且温度升高,水的电离程度增大,c(OH-)也增大,B项错误;温度升高,水的电离程度增大,c(H+)增大,又Cu2+水解使溶液显酸性,温度升高,水解平衡正向移动,故c(H+)增大,C项正确;温度升高,能使电离平衡和水解平衡均正向移动,CH3COONa溶液随温度升高pH降低的原因是水的电离程度增大得多,而CuSO4溶液随温度升高pH降低的原因是Cu2+水解程度增大得多,D项错误。
5.(2023·广东梅州联考)常温下,在体积均为20 mL、浓度均为0.1 ml·L-1的HX溶液、HY溶液中分别滴加浓度为0.1 ml·L-1的NaOH溶液,反应后溶液中水电离的c(H+)表示为pH水=-lg c水(H+),pH水与滴加氢氧化钠溶液体积的关系如图所示。下列推断正确的是( )
A.HX、HY都是弱酸B.常温下,Ka(HY)的数量级为10-8C.常温下用蒸馏水分别稀释B、D点溶液,pH都降低D.C、D两点溶液中都有c(H+)=c(OH-)
6.已知在常温下测得浓度均为0.1 ml·L-1的下列6种溶液的pH如表所示:
下列反应不能成立的是( )A.CO2+H2O+2NaClO═Na2CO3+2HClOB.CO2+H2O+NaClO═NaHCO3+HClOC.CO2+H2O+C6H5ONa═NaHCO3+C6H5OHD.CH3COOH+NaCN═CH3COONa+HCN
备战2025届新高考化学一轮总复习第8章水溶液中的离子反应与平衡热点专攻19电离平衡常数的计算课件: 这是一份备战2025届新高考化学一轮总复习第8章水溶液中的离子反应与平衡热点专攻19电离平衡常数的计算课件,共10页。PPT课件主要包含了热点精讲,热点精练,2×10-7等内容,欢迎下载使用。
新教材适用2024版高考化学一轮总复习第8章水溶液中的离子反应与平衡第26讲沉淀溶解平衡课件: 这是一份新教材适用2024版高考化学一轮总复习第8章水溶液中的离子反应与平衡第26讲沉淀溶解平衡课件,共60页。PPT课件主要包含了考点一,考点二,必备知识·梳理夯实,沉淀溶解,沉淀生成,溶解的方向,生成沉淀的方向,7×10,0pH71,0×10-6等内容,欢迎下载使用。
新教材适用2024版高考化学一轮总复习第8章水溶液中的离子反应与平衡第25讲盐类的水解课件: 这是一份新教材适用2024版高考化学一轮总复习第8章水溶液中的离子反应与平衡第25讲盐类的水解课件,共60页。PPT课件主要包含了第25讲盐类的水解,考点一,考点二,考点三,必备知识·梳理夯实,盐类的水解,NH3·H2O+H+,pH=7,pH7,2盐类水解规律等内容,欢迎下载使用。












