
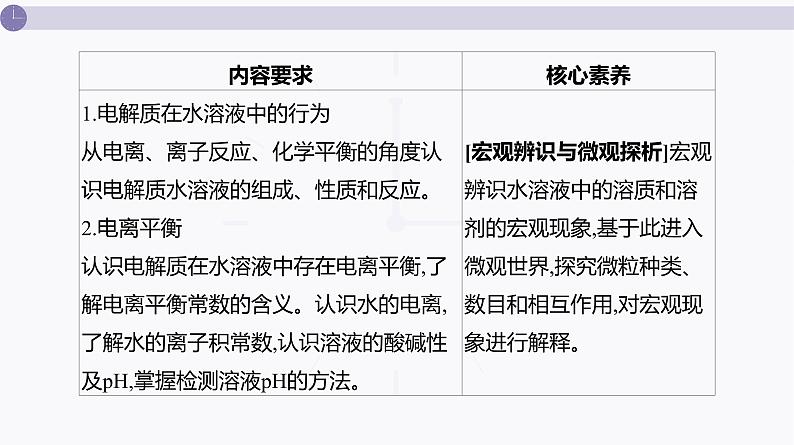
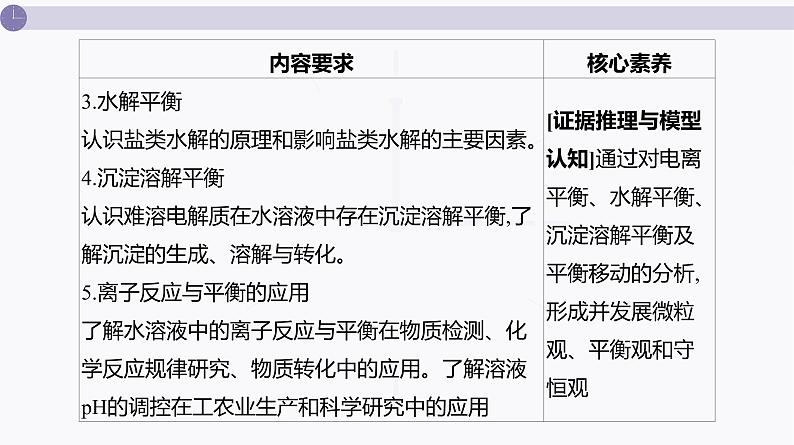





课件 高考化学一轮复习第九单元 水溶液中的离子反应和平衡 第33讲 电离平衡
展开本单元概念抽象、原理复杂、计算烦琐,是考生较为头疼的知识板块之一。 对于本单元的复习,首先要牢记水溶液中存在各种平衡的原理,找共性,知个性,澄清基本的思维认知;在打牢教材知识的基础上,重点突破4个难点:酸碱中和滴定、溶液中的粒子浓度关系、溶度积的计算及沉淀溶解图像分析;最后理清四大平衡常数之间的相互关系。做到原理清、关系明、难点通,思维的出发点和落脚点统一到“离子平衡”这一观点上来。二、课时安排 本单元共6讲,建议14课时完成,其中8课时用于在课堂上互动式完成第33~38讲,4课时用于处理各讲的习题讲评,2课时用于测试和讲评。
考点一 弱电解质的电离平衡考点二 电离度与电离常数经典真题·明考向作业手册
夯实必备知识 | 提升关键能力
考点一 弱电解质的电离平衡
(2)电离方程式的书写——“强等号,弱可逆,多元弱酸分步离”①强电解质,如H2SO4: 。 ②弱电解质a.一元弱酸,如CH3COOH: 。 b.多元弱酸,分步电离,分步书写且第一步的电离程度远大于第二步的电离程度,如H2CO3: 。 c.多元弱碱,分步电离,一步书写,如Fe(OH)3: 。 ③酸式盐弱酸的酸式盐,“强中有弱”,如NaHCO3: 。
CH3COOH ⇌ CH3COO-+H+
Fe(OH)3 ⇌ Fe3++3OH-
[微点拨1] ①中学阶段常见的六大强酸是指:HCl、H2SO4、HNO3、HBr、HI、HClO4,其他一般是中强酸或弱酸。②中学阶段常见的四大强碱是指:NaOH、KOH、Ca(OH)2、Ba(OH)2,其他一般是中强碱或弱碱。
2. 弱电解质的电离平衡
(1)电离平衡的建立在一定温度下,当弱电解质 的速率和 的速率相等时,电离过程达到了平衡。 (2)电离平衡的建立与特征
(3)外因对电离平衡的影响①浓度:在一定温度下,同一弱电解质溶液,浓度越小,越 电离。 ②温度:温度越高,电离程度 。 ③相同离子:加入与弱电解质具有相同离子的电解质时,可使电离平衡向 的方向移动。 ④化学反应:加入能与弱电解质电离出的离子反应的物质时,可使电离平衡向 方向移动。
[微点拨2] 外界条件对电离平衡影响的两个“不一定”①稀醋酸加水稀释时,溶液中不一定所有的离子浓度都减小。因为温度不变,KW=c(H+)·c(OH-)是定值,稀醋酸加水稀释时,溶液中的c(H+)减小,c(OH-)增大。②电离平衡右移,电离程度不一定增大,如增大弱电解质的浓度,使电离平衡向右移动,但电离程度减小。
3. 电解质溶液的导电性
[微点拨3] 电解质溶液的导电能力与溶液中离子浓度的大小有关,与电解质的强弱无关。强电解质溶液的导电能力不一定强(如CaCO3溶液),弱电解质溶液的导电能力不一定弱(如氨水)。
[解析] (2)当NH3·H2O电离的速率等于形成分子的速率时,表明NH3·H2O电离处于平衡状态,错误。
[解析] (1)NH3在水溶液中或熔融状态下自身不能电离,NH3属于非电解质,错误。
[解析] (3)室温下,若0.1 ml·L-1一元碱BOH完全电离,则pH=13,题目中pH=10,则BOH为弱碱,溶液中存在BOH ⇌ B++OH-,错误。
(5)25 ℃时,0.1 ml·L-1 CH3COOH溶液加水稀释,各离子浓度均减小( )(6)电离平衡向右移动,弱电解质的电离度一定增大( )
[解析] (5)25 ℃时,0.1 ml·L-1 CH3COOH溶液加水稀释,OH-浓度增大,错误。
[解析] (6)电离平衡向右移动,电离程度不一定增大,如增大弱电解质的浓度,电离平衡向右移动,但弱电解的电离度减小。
2.以0.1 ml·L-1 CH3COOH溶液为例,填写下列外界条件对CH3COOH(aq) ⇌ CH3COO-(aq)+H+(aq) ΔH>0的影响。①加水稀释;②加入少量冰醋酸;③通入HCl(g);④加NaOH(s);⑤加CH3COONa(s);⑥加入镁粉;⑦升高温度。平衡向左移动 ;溶液中n(H+)增大 ;溶液中c(H+)增大 ;溶液导电能力减弱 ;CH3COOH的Ka增大(不考虑反应温度影响) 。
3.分别画出冰醋酸加水稀释过程中溶液的电导率和pH随加水体积变化的曲线。
题组一 强电解质与弱电解质
1.下列事实一定能说明HNO2为弱电解质的是( )A.用HNO2溶液做导电实验灯泡很暗B.常温下0.1 ml·L-1的HNO2溶液加水稀释,c(H+)减小C.1 L c(H+)=0.1 ml·L-1的HNO2和1 L c(H+)=0.1 ml·L-1的盐酸与足量的NaOH溶液完全反应,最终HNO2消耗的NaOH溶液多D.0.1 ml·L-1的HNO2溶液能使紫色石蕊溶液变红色
[解析] 如果强酸的浓度很小,溶液中的离子浓度很小,灯泡也会很暗,则用未知浓度的亚硝酸溶液做导电实验,灯泡很暗不能说明亚硝酸为弱酸,A错误;不论是强酸的溶液还是弱酸的溶液,加水稀释时,溶液中氢离子浓度均减小,则常温下0.1 ml·L-1的亚硝酸溶液加水稀释时,氢离子浓度减小不能说明亚硝酸为弱酸,B错误;氢离子浓度相等的亚硝酸溶液和盐酸与足量的氢氧化钠溶液反应时,亚硝酸溶液消耗氢氧化钠溶液多说明亚硝酸是弱酸,在溶液中部分电离,C正确;亚硝酸溶液能使紫色石蕊溶液变红色,只能说明亚硝酸溶液呈酸性,不能说明亚硝酸为弱酸,D错误。
2.[2023·重庆垫江五中模拟] 常温下pH=2的两种酸溶液A和B,分别加水稀释1000倍,其pH与所加水的体积变化如图所示。下列结论正确的是( )A.B比A的电离度大B.A为弱酸,B为强酸C.B的物质的量浓度比A的大D.稀释至相同的pH,A加的水比B多
[解析] 根据图示可知A溶液稀释1000倍,其pH增大3 (由pH=2变成pH=5),可判定A为强酸,而B溶液中稀释1000倍其pH增大小于3,说明B为弱酸,A的电离程度更大,A、B错误;由于B中存在电离平衡,所以氢离子浓度相等时(即pH相等),B的浓度更大,C正确;稀释至相同的pH,即稀释到氢离子浓度相等,由于稀释过程中促进B的电离,所以氢离子浓度要想减小相同的倍数,需要加更多的水,D错误。
【思维建模】 判断弱电解质的三个角度(以弱酸为例)1.弱电解质不能完全电离(1)测定一定浓度的HA溶液的pH。(2)与同浓度盐酸比较导电性。(3)与同浓度的盐酸比较和锌反应生成气泡的快慢。2.弱电解质溶液中存在电离平衡(1)从一定pH的HA溶液稀释前后pH的变化判断。(2)从升高温度后pH的变化判断。(3)从等体积、等pH的HA溶液、盐酸分别与过量的锌反应生成H2的量判断。
3.弱电解质形成的盐类能水解(1)如配制某浓度的醋酸钠溶液,向其中加入几滴酚酞溶液,溶液变为浅红色。(2)如用玻璃棒蘸取一定浓度的醋酸钠溶液滴在pH试纸上,测其pH,pH>7。
题组二 弱电解质的电离平衡
3.H2S水溶液中存在电离平衡:H2S ⇌ H++HS-和HS- ⇌ H++S2-。若向H2S溶液中 ( )A.加水,平衡向右移动,溶液中氢离子浓度增大B.通入过量SO2气体,平衡向左移动,溶液pH增大C.滴加新制氯水,平衡向左移动,溶液pH减小D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
[解析] 加水促进电离,但氢离子浓度减小,A项错误;通入过量SO2气体发生反应:2H2S+SO2 = 3S↓+2H2O,当SO2过量时溶液显酸性,而且酸性比H2S强,pH减小,B项错误;滴加新制氯水,发生反应:Cl2+H2S = 2HCl+S↓,平衡向左移动,生成了HCl,溶液pH减小,C项正确;加入少量硫酸铜固体,发生反应:H2S+CuSO4 = CuS↓+H2SO4,H+浓度增大,D项错误。
(3)电离平衡右移,离子的浓度不一定增大,如在CH3COOH溶液中加水稀释或加少量NaOH固体,都会引起平衡右移,但c(CH3COOH)、c(H+)都比原平衡时要小。(4)电离平衡右移,电离程度也不一定增大,如增大弱电解质的浓度,电离平衡向右移动,弱电解质的电离程度减小。
考点二 电离度与电离常数
(1)概念在一定条件下的弱电解质达到电离平衡时, 占原电解质总数的百分比。 (2)表达式α= ×100%, 也可表示为α= ×100%。
已经电离的电解质分子数
(3)影响因素①浓度相同温度下,同一弱电解质,浓度越大,其电离度(α)越 。 ②温度相同浓度下,同一弱电解质,温度越高,其电离度(α)越 。 (4)意义衡量弱电解质的电离程度,相同条件下(浓度、温度相同),不同弱电解质的电离度越大,弱电解质的电离程度越 。
(1)概念在一定条件下,弱电解质在达到电离平衡时,溶液中 的乘积与 之比是一个常数,这个常数叫作电离平衡常数,又称电离常数,用K(弱酸用Ka,弱碱用Kb)表示。
电离所生成的各种离子浓度
溶液中未电离分子的浓度
(3)意义相同条件下,K的值越大,表示该弱电解质 电离,所对应酸或碱的酸性或碱性相对 。 (4)特点①电离常数只与 有关,与电解质的浓度、酸碱性无关,由于电离过程是 的,故温度升高,K增大。 ②多元弱酸是分步电离的,各级电离常数的大小关系是K1≫K2……,所以其酸性主要取决于 电离。
(5)电离常数的四大应用①判断弱酸(或弱碱)的相对强弱,电离常数越大,酸性(或碱性) 。如常温下,CH3COOH的Ka=1.75×10-5,HClO的Ka=4.0×10-8,则酸性强弱为CH3COOH (填 “>”“<”或“=”)HClO。 ②判断盐溶液的酸性(或碱性)强弱。弱酸或弱碱的电离常数越大,对应盐的水解程度越 ,盐溶液的碱性(或酸性)越 ,如醋酸的Ka=1.75×10-5,次氯酸的Ka=4.0×10-8,则相同浓度的醋酸钠和次氯酸钠溶液的pH:醋酸钠 (填“>”“<”或“=”)次氯酸钠。
C6H5ONa+CO2+H2O = C6H5OH+NaHCO3
3. 电离度和电离常数的关系
[解析] (2)电离是吸热过程,升高温度,电离平衡右移,电离度增大,正确。
[解析] (1)当弱电解质的浓度增大时,电离平衡虽然右移,但电离度减小,错误。
[解析] (5)弱电解质的电离常数只与温度有关,与浓度无关,错误。
[解析] (4)电离常数的大小表示弱电解质电离的难易程度,可以表示弱电解质的相对强弱,正确。
(7)电离常数大的酸溶液中的c(H+)一定比电离常数小的酸溶液中的c(H+)大( )
[解析] (7)酸溶液中的c(H+)既与酸的电离常数有关,还与酸的浓度有关,电离常数大的c(H+)不一定大,错误。
题组一 电离平衡常数的意义
[解析] Ka为醋酸的电离常数,只与温度有关,与离子浓度无关,故A、B项错误;由于醋酸的电离过程吸热,则升高温度,Ka增大,降低温度,Ka减小,所以标准状况下(0 ℃),Ka应小于1.75×10-5,故C项错误。
【方法技巧】 电离平衡常数与酸(碱)性强弱的关系
题组二 电离平衡常数的定量计算
(3)25 ℃时,在2.0×10-3 ml·L-1的氢氟酸水溶液中,调节溶液pH(忽略调节时溶液体积的变化),测得平衡体系中c(F-)、c(HF)与溶液pH的关系如图所示。则25 ℃时,HF的电离平衡常数Ka(HF)= (列式求值)。
[解析] 从图中可以看出Fe(Ⅲ)主要与L2-进行络合,pH=1时,Fe3+与[FeL]+的分布系数均为0.5,则c([FeL]+)=1.0×10-4 ml·L-1,pH<7.46时富含L的物种主要为H2L,则c(H2L)≈5.0×10-3 ml·L-1,此时电离出的HL-较少,根据H2L的一级电离常数,此时溶液中c(HL-)≈5.0×10-9.46 ml·L-1,由KW可知c(OH-)=10-13 ml·L-1,因此这四种离子的浓度大小为c(H2L)>c([FeL]+)>c(HL-)>c(OH-),A错误;
3. [2022·浙江卷] 已知25 ℃时二元酸H2A的Ka1=1.3×10-7,Ka2=7.1×10-15。下列说法正确的是( )A.在等浓度的Na2A、NaHA溶液中,水的电离程度前者小于后者B.向0.1 ml·L-1的H2A溶液中通入HCl气体(忽略溶液体积的变化)至pH=3,则H2A的电离度为0.013%C.向H2A溶液中加入NaOH溶液至pH=11,则c(A2-)>c(HA-)D.取pH=a的H2A溶液10 mL,加蒸馏水稀释至100 mL,则该溶液pH=a+1
3. 磷能形成次磷酸(H3PO2)、亚磷酸(H3PO3)等多种含氧酸。(1)次磷酸是一种精细化工产品,已知10 mL 1 ml·L-1 H3PO2与20 mL 1 ml·L-1 NaOH溶液充分反应后生成组成为NaH2PO2的盐,回答下列问题:①NaH2PO2属于 (填“正盐”“酸式盐”或“无法确定”)。 ②若25 ℃时,Ka(H3PO2)=1×10-2,则0.02 ml·L-1的H3PO2溶液的pH= 。 ③设计两种实验方案,证明次磷酸是弱酸: 。
测NaH2PO2溶液的pH,若pH>7,则证明次磷酸为弱酸;向等物质的量浓度的盐酸和次磷酸溶液中各滴入2滴石蕊溶液,若次磷酸溶液中红色浅一些,则说明次磷酸为弱酸(答案合理即可)
(2)亚磷酸是二元中强酸,某温度下,0.11 ml·L-1的H3PO3溶液的pH为2,该温度下H3PO3的一级电离平衡常数Ka1约为 (Ka2=2×10-7,H3PO3的二级电离和水的电离忽略不计)。
考点一 强电解质和弱电解质
1. 相同温度下,100 mL 0.1 ml·L-1的醋酸溶液与10 mL 1 ml·L-1的醋酸溶液相比较,下列说法正确的是 ( )A.发生中和反应时所需NaOH的量前者大于后者B.前者的电离程度小于后者C.所含H+的物质的量前者大于后者D.所含CH3COOH的物质的量前者大于后者
[解析] 由于溶质n(CH3COOH)都为0.01 ml,中和时所需NaOH的量相同,A错误;醋酸为弱电解质,浓度越大,电离程度越小,故前者的电离程度大于后者,B错误;两种溶液中醋酸的物质的量相同,且前者醋酸的电离程度大,所以溶液中H+的物质的量前者大于后者,C正确;两者溶液中溶质均为0.01 ml,发生部分电离,前者电离程度大于后者,故溶液中CH3COOH的物质的量前者小于后者,D错误。
2. [2023·浙江宁波模拟] 下列说法正确的是( )A.25 ℃时,将pH=5的醋酸溶液与pH=5的盐酸等体积混合,混合后溶液pH>5B.25 ℃时,等浓度的盐酸与醋酸溶液分别稀释相同倍数,稀释后溶液pH:盐酸<醋酸溶液C.25 ℃时,等体积、等pH的盐酸与醋酸溶液分别用等浓度的NaOH溶液中和,盐酸消耗NaOH溶液多D.25 ℃时,pH=3的一元酸HA溶液与pH=11的一元碱MOH溶液等体积混合后溶液呈酸性,则HA是强酸
[解析] pH=5的醋酸溶液与pH=5的盐酸中氢离子浓度相同,都是10-5 ml·L-1,等体积混合后,氢离子浓度不变,故pH为5,A错误;等浓度的盐酸与醋酸溶液分别稀释相同倍数后其浓度依然相同,醋酸是弱酸,部分电离,氢离子浓度较小,pH大,B正确;等体积、等pH的盐酸与醋酸溶液,其中醋酸的浓度大,用氢氧化钠中和时消耗的氢氧化钠较多,C错误;混合后溶液呈酸性,说明酸的浓度较大,则酸HA为弱酸,MOH是相对较强的碱,但不一定是强碱,D错误。
3. 在体积均为0.5 L、pH均等于1的盐酸、醋酸溶液中,分别投入1.4 g铁粉,则如图所示曲线比较符合客观事实的是( ) A B C D
[解析] HCOOH是一种有机弱酸,在水溶液中的电离方程式为HCOOH ⇌ HCOO-+H+,加热有利于电离平衡的正向移动,溶液pH减小,A项错误;加水稀释,溶液中c(H+)减小,pH增大,B项正确;
4. 甲酸(HCOOH)是一种有机弱酸。下列关于甲酸溶液的说法正确的是( )A.升高温度,溶液pH增大B.加水稀释,溶液pH增大C.加入少量NaOH固体,溶液pH减小D.加入少量HCOONa固体,溶液pH减小
考点二 弱电解质的电离平衡
加入少量NaOH固体,反应消耗氢离子,溶液的pH增大,C项错误;加入少量HCOONa固体,溶液中c(HCOO-)增大,电离平衡逆向移动,c(H+)减小,溶液pH增大,D项错误。
若向稀氨水中加NaOH固体,c(OH-)增大,平衡逆向移动,③符合题意;若向稀氨水中加水,稀释溶液,平衡正向移动,c(OH-)减小,④不符合题意;电离为吸热过程,加热使平衡正向移动,⑤不符合题意;若向稀氨水中加少量 MgSO4固体,Mg2+与OH-反应生成 Mg(OH)2沉淀,使c(OH-) 减小,平衡正向移动,⑥不符合题意。
7. 25 ℃时,向20.0 mL 0.100 ml·L-1 HR溶液中滴加0.100 ml·L-1 MOH溶液,混合溶液的pH与加入MOH溶液体积的变化关系如图所示。设NA为阿伏伽德罗常数的值。下列说法错误的是( )A.HR的电离常数的数量级为10- ml·L-1 MOH溶液的电离度大于1%C.P点溶液中水电离出的H+数目为4×10-9NAD.Q点溶液中存在c(M+)>c(R-)>c(MOH)>c(HR)
由题干图示信息结合B项分析可知,P点溶液的体积约为40 mL,溶液由于M+和R-发生双水解,且水解程度相同导致溶液呈中性,盐类水解促进水的电离,即该溶液中水电离出的H+的浓度大于1×10-7 ml·L-1,故水电离出的H+数目大于40×10-3 L×1×10-7 ml·L-1×NA ml-1=4×10-9NA,C错误;由题干图示信息结合B项分析可知,Q点溶液为等浓度的MR和MOH的混合溶液,由于M+和R-的水解程度相同,同时存在MOH ⇌ M++OH-,M+的水解程度小于MOH的电离程度,则溶液中存在c(M+)>c(R-)>c(MOH)>c(HR),D正确。
8. 研究电解质在水溶液中的平衡能了解它的存在形式。(1)已知部分弱酸的电离常数如下表:①写出H2S的Ka1表达式: 。
考点三 弱电解质电离平衡的综合考查
②常温下,pH相同的三种溶液NaF、Na2CO3、Na2S,物质的量浓度最大的是 。
③将过量H2S通入Na2CO3溶液,反应的离子方程式是 。
(2)二元弱酸H2A溶液中H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示。则H2A的二级电离平衡常数Ka2= 。
[解析] (2)当c(HA-)=c(A2-)时,H2A的二级电离平衡常数Ka2=c(H+)=10-4.2。
9. [2022·广东卷节选 ] 食醋是烹饪美食的调味品,有效成分主要为醋酸(用HAc表示)。HAc的应用与其电离平衡密切相关。25 ℃时, HAc的Ka=1.75×10-5=10-4.76。(1)某小组研究25 ℃下HAc电离平衡的影响因素。提出假设 稀释HAc溶液或改变Ac-浓度,HAc电离平衡会发生移动。设计方案并完成实验 用浓度均为0.1 ml·L-1的HAc和NaAc溶液,按下表配制总体积相同的系列溶液;测定pH,记录数据。
①根据表中信息。补充数据:a= ,b= 。
[解析] (1)①实验Ⅶ的溶液中n(NaAc)∶n(HAc)=3∶4,V(HAc)=4.00 mL,且所用HAc和NaAc溶液的浓度相等,因此V(NaAc)=3.00 mL,即a=3.00,由实验Ⅰ可知,溶液最终的体积为40.00 mL,因此V(H2O)=40.00 mL-4.00 mL- 3.00 mL=33.00 mL,即b=33.00。
②由实验Ⅰ和Ⅱ可知,稀释HAc溶液,电离平衡 (填“正”或“逆”)向移动;结合表中数据,给出判断理由: 。
实验Ⅱ相较于实验Ⅰ,醋酸溶液稀释了10倍,而实验Ⅱ的pH增大值小于1
③由实验Ⅱ~Ⅷ可知,增大Ac-浓度,HAc电离平衡逆向移动。实验结论 假设成立。
[解析] (2)(ⅰ)滴定过程中发生反应:HAc+NaOH = NaAc+H2O,由反应的化学方程式可知,滴定至终点时,n(HAc)= n(NaOH),因此22.08 mL×0.1 ml·L-1=20.00 mL× c(HAc),解得c(HAc)=0.110 4 ml·L-1。
高考化学一轮复习第9章水溶液中的离子反应与平衡第43讲水的电离和溶液的pH课件: 这是一份高考化学一轮复习第9章水溶液中的离子反应与平衡第43讲水的电离和溶液的pH课件,共46页。PPT课件主要包含了H2O⇌H++OH-,×10-14,稀的电解质溶液,玻璃棒,标准比色卡,答案10,答案1∶4,强氧化性,2滴定前准备,蒸馏水等内容,欢迎下载使用。
模块3 主题3 第2讲 水的电离平衡及应用 课件 2025高考化学一轮复习: 这是一份模块3 主题3 第2讲 水的电离平衡及应用 课件 2025高考化学一轮复习,共41页。PPT课件主要包含了学习目标,活动方案,链接真题等内容,欢迎下载使用。
2025届高考化学一轮总复习第9章水溶液中的离子反应与平衡第43讲水的电离和溶液的pH课件: 这是一份2025届高考化学一轮总复习第9章水溶液中的离子反应与平衡第43讲水的电离和溶液的pH课件,共46页。PPT课件主要包含了H2O⇌H++OH-,×10-14,稀的电解质溶液,玻璃棒,标准比色卡,答案10,答案1∶4,强氧化性,2滴定前准备,蒸馏水等内容,欢迎下载使用。












