










高中化学沪科技版(2020)必修第一册物质的量 阿伏加德罗常数优质课ppt课件
展开物质的量 阿伏加德罗常数
古时,皇帝给公主招驸马出了一个这样问题是:100 石小米是多少粒?同学们你们能不能帮帮他?哪种方法最科学?(古代十六两为一斤,一百五十斤为一石)
把微小物质扩大倍数形成一定数目的集体以便于方便生活、方便科学研究。
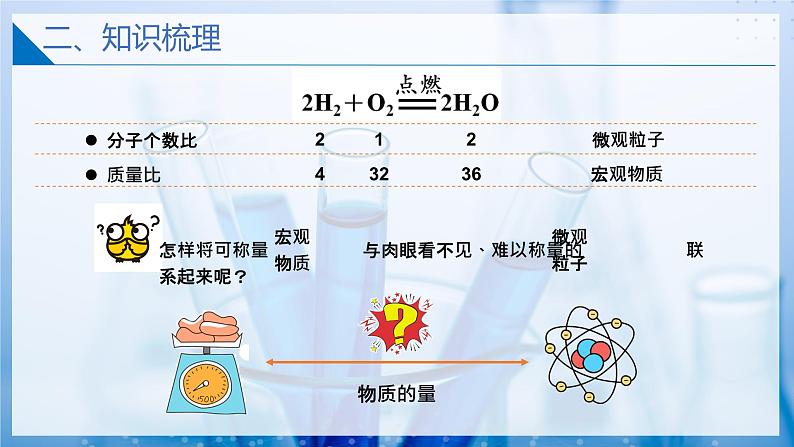
请同学们正确读出下列化学反应方程的意义(定量描述)
每2个氢分子可以和1个氧分子发生反应产生2个水分子
每4份质量的氢气就可以和32份质量的氧气恰好完全反应生成36份质量的水
每2体积的氢气就可以和1体积的氧气恰好完全反应生成水
物质的量的单位——摩尔
国际单位制(SI)中的7个基本单位
(国际单位制七个基本物理量之一)
表示含有一定数目粒子集合体的物理量。
原子、分子、离子、电子、原子团等微观粒子。
物质的量的数值可以是整数,也可以是小数。
1971年,由41个国家参加的第14届国际计量大会上,正式宣布国际纯粹和应用化学联合会、国际纯粹和应用物理联合会和国际标准化组织关于必须定义一个物理量单位的提议,并作出决议。从此,“物质的量”就成为国际单位制中的一个基本物理量,物质的量的单位为摩尔。
同时规定:0.012 kg 12C中所含的碳原子数目作为 1 ml的标准。
也就是说:1 ml粒子集体所含的粒子数= 0.012 kg12C中所含的碳原子数。
=6.02×1023
(已知一个12C原子的质量为1.993×10-26 kg)
阿伏加德罗常数到底有多大呢?如果把 6.02×1023 粒米给全球70亿人吃,每人每天吃一斤,同学们计算下,可以吃多少年?
数值: 近似等于6.02 ×1023
单位: ml-1 (每摩尔)
规定: 0.012 Kg12C 中所含的碳原子数
也就是说:若某物质含有与 0.012 Kg12C 中所含的碳原子数相同的粒子数,该物质的物质的量为1ml 。
0.012Kg12C中所含原子数
学习活动:探究物质的量(n)与微粒数(N)之间的换算关系
【规律】微粒之间的物质的量之比等于微粒的_______之比
1 ml H2O 约含有6.02×1023个水分子,质量是18g
1 ml Al约含有6.02×1023 个铝原子,质量是27g
1ml任何微观物质都约含6.02×1023个粒子,那么,这1ml物质的质量到底有多大?
分析以上计算结果可得出什么规律?
(6.02×1023)
1ml任何原子的质量(以克为单位)在数值上等于这种原子的相对原子质量。
1ml任何分子的质量(以克为单位)在数值上等于这种分子的相对分子质量。
1ml任何离子的质量(以克为单位)在数值上等于这种离子的式量。
1ml任何微粒或物质的质量,当以g为单位时,在数值上等于该微粒的相对原子质量或相对分子质量。
常用单位:g · ml-1
数值:等于物质的相对原子(分子)质量
单位物质的量(即1ml)的物质所具有的质量叫做该物质的摩尔质量。
确定性:对于指定的物质来说,其摩尔质量的值是一个定值,不随物质的物质的量的多少而改变。
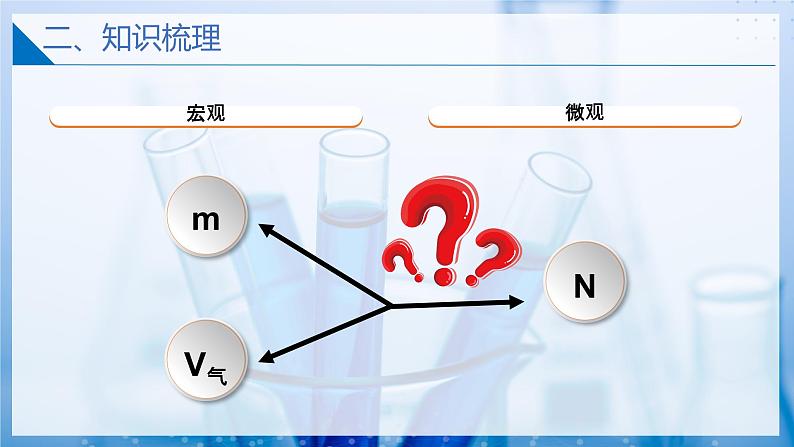
物质的量将宏观物质和微观粒子联系起来的一座桥梁
思考题:1 ml 物质的质量、摩尔质量、相对分子质量(或相对原子质量)是否等同?
不等同。1 ml 物质的质量、摩尔质量、相对分子质量(或相对原子质量)是不同的概念。当摩尔质量以“g·ml-1”为单位时,三者在数值上相等,但单位不同,故三者不等同。
【例题1】判断正误(正确的打“√”,错误的打“×”)。(1) 1 ml铅笔( ) (2) 2 ml氧( ) (3) 4 ml H2( ) (4) 1 ml Na2CO3中含有2 ml Na+( ) (5) 0.012 kg 12C中约含有6.02×1023个碳原子( )
N(O2) = n × NA
【例2】在0.5 ml O2中含有的氧分子数目是多少?氧原子数目是多少?
N(O2) = 0.5 ml × 6.02×1023ml-1
N(O2) = 3.01 × 1023
N(O) = 2 × N(O2)
N(O) = 2 × 3.01 × 1023
N(O) = 6.02×1023
【例3】(1)若agCO2含b个原子,则阿伏加德罗常数的值为___________(2)一定量的Na2CO3中,碳原子和氧原子的物质的量之比为___________(3)质量比为11∶6的CO2和NO,其物质的量之比为___________,它们所含质子数之比为___________。
【例4】(1)等质量的O2和O3所含分子数之比为_______, 原子个数比为________。 (2)①已知NH3的相对分子质量为17,则NH3的摩尔质量为___________。 ②1.28 g某气体含有的分子数目为1.204×1022,则该气体的摩尔质量为___________ ③NA为阿伏加德罗常数,已知一个铁原子的质量为b g,则铁的摩尔质量为______。 ④NA为阿伏加德罗常数,已知a g某气体中含分子数为b,则该气体的摩尔质量为___________。
aNA/b g·ml-1
高考化学一轮复习第2章物质的量第8讲阿伏加德罗常数应用突破课件: 这是一份高考化学一轮复习第2章物质的量第8讲阿伏加德罗常数应用突破课件,共33页。
2025版高考化学一轮总复习第2章物质的量第6讲物质的量阿伏加德罗常数课件: 这是一份2025版高考化学一轮总复习第2章物质的量第6讲物质的量阿伏加德罗常数课件,共60页。PPT课件主要包含了n·NA,摩尔质量,2气体摩尔体积,b-aNA,afecbd,标准状况,NO2和NO,SO2和H2等内容,欢迎下载使用。
2023届高考化学二轮复习阿伏加德罗常数的应用课件: 这是一份2023届高考化学二轮复习阿伏加德罗常数的应用课件,共25页。PPT课件主要包含了考情预测,方法技巧,解题思路,Content,方法指导,在电解质溶液角度设陷,应对真题,典例集训等内容,欢迎下载使用。













