




还剩25页未读,
继续阅读
成套系列资料,整套一键下载
【新课标】人教版(2019)高中化学选择性必修二 第三章《晶体结构与性质》单元解读课件
展开
这是一份【新课标】人教版(2019)高中化学选择性必修二 第三章《晶体结构与性质》单元解读课件,共33页。
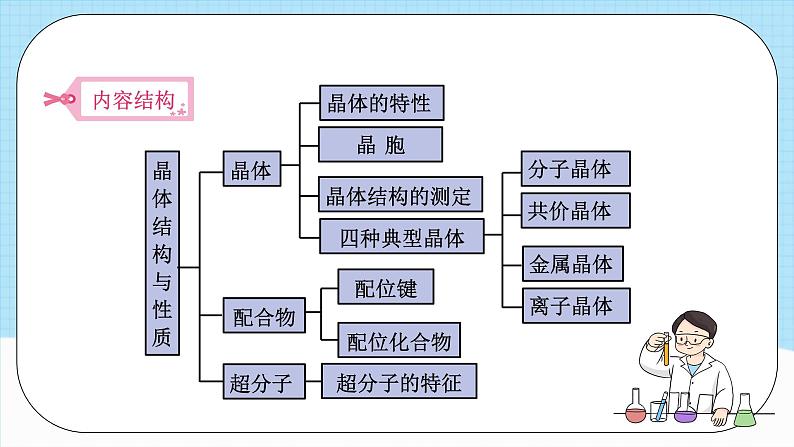
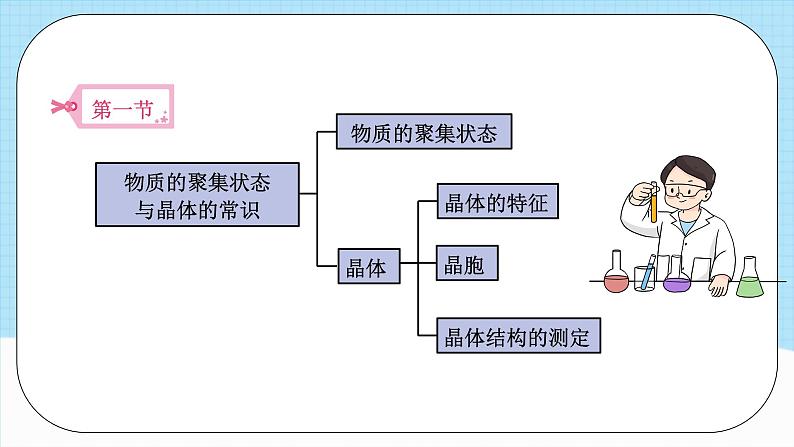
单元解读第三章教学策略、学生活动 模块一 课标要求、教材解读 课标要求第三章 晶体结构与性质 本章增加了一些反映学科发展新成就的内容,这些内容都是首次被选进中学化学教材中,主要有物质的聚集状态、晶体结构的测定(晶体X射线衍射法)、准晶、过渡晶体、超分子等内容。这些新增加的内容,都是通过典型例子加以简单的介绍。另外,教材在选材方面,增选了一些与现实生活和科学前沿密切相关的素材,以拓展学生的视野,如等离子体、液晶、离子液体、纳米晶体等。教材解读晶体结构与性质晶体配合物超分子晶体的特性 晶 胞晶体结构的测定四种典型晶体分子晶体 共价晶体 金属晶体 离子晶体 配位键配位化合物超分子的特征物质的聚集状态物质的聚集状态与晶体的常识晶体晶体的特征晶胞晶体结构的测定本节内容主要包括分子晶体和共价晶体两部分。本节内容主要包括分子晶体和共价晶体两部分。主要包括金属晶体、离子晶体、过渡晶体与混合型晶体三部分。主要包括金属晶体、离子晶体、过渡晶体与混合型晶体三部分。主要包括金属晶体、离子晶体、过渡晶体与混合型晶体三部分。 模块二 教学目标、教学重难点 教学目标 模块三 教学策略第一节 物质的聚集状态 与晶体的常识1.关于晶体与非晶体的教学从教材“晶体与非晶体”正文的第一句话“走进化学实验室”引课,走进探究晶体与非晶体的情境之中,挖掘课本素材背后的新意,展示实验室里的一些常见固体,休现宏微结合。创新在于从宏观(肉眼可见)到微观(电子显微镜)的过程中,发现各种颜色掩盖之下,晶体形态的异同,从而引出晶体结构。教学策略第一节 物质的聚集状态 与晶体的常识2.关于自范性的教学 以硫酸铜为线索且贯穿始终,从实物到实验,从自然界到实验室。自范性是晶体能自发地呈现多面体外形的性质,晶体表现出自范性是有一定条件的。例如,晶体的生长速率要适当,并以教材中的天然水晶球里的玛瑙和水晶的形成为例帮助学生理解,同时感受地质学中的化学。 对于制备晶体的三条途径,即熔融态物质凝固、气态物质冷却不经液态直接凝固(凝华)和溶质从溶液中析出。第一节 物质的聚集状态 与晶体的常识3.关于晶胞的教学 要重点帮助学生理解晶胞的特征。整块晶体可以看作是数量巨大的晶胞“无隙并置”而成,所谓“无隙”,是指相邻晶胞之间没有任何间隙;所谓“并置”,是指所有晶胞都是平行排列的,取向相同。晶胞是8个顶角相同、三套各4根平行棱分别相同、三套各两个平行面分别相同的最小平行六面体。晶胞只是晶体微观空间里的一个基本单元,在它的上下左右前后无隙并置地排列着无数晶胞,而且所有晶胞的形状及内部的原子种类、个数及几何排列均完全相同。第二节 分子晶体与共价晶体1.关于分子晶体的教学一是如何理解氢键对分子晶体结构的影响,二是分子间只存在范德华力时分子晶体结构的特点。干冰和冰的晶体结构特点是分子晶体体结构中的普遍性和特殊性,由于冰中氢键的方向性决定了冰晶体的结构特点有其特殊性。氢键的作用力大于分子间的范德华力,所以冰和干冰的性质存在差异。第二节 分子晶体与共价晶体2.关于共价晶体的教学在金刚石教学环节,要从碳原子的结构特点出发,即金刚石中的C采取sp’杂化轨道形成共价键来理解金刚石的三维骨架结构,并结合金刚石的实物结构模型或多媒体课件,让学生感受金刚石的三维骨架结构。SiO2是另一种典型的共价晶体,可要求学生注意从分子品体和共价晶品体的不同点加以分析,组织学生认识共价晶体和分子晶体的区别。第三节 金属晶体与离子晶体1.关于金属晶体的教学 从金属原子结构的视角去认识金属键的本质。金属原子的价电子比较少,有易失去价电子的性质。在金属晶体中,每个金属原子都有机会失去价电子成为金属阳离子,每个阳离子都有机会结合价电子成为金属原子,这些价电子被许多原子或离子所共有,从而把所有的金属原子维系在一起。围绕“电子气”模型,分小组讨论金属具有导电性、导热性和延展性的原因,进一步加深结构决定性质的化学观念。第三节 金属晶体与离子晶体2.关于离子晶体的教学 氯化钠是学生日常生活中真实接触的物质,可以让学生通过生活中的一些实例来概括它的一些性质。可以通过对比CO2、金刚石、NaCl的晶体结构模型或演示多媒体课件,观察并对比三种晶体模型的各自特点,把分子晶体、共价晶体与离子晶体列表进行对比。为了开阔学生的思路,可以让学生观察硫酸铜晶体结构图,从中发现离子晶体中同时还存在共价键和氢键。第四节 配合物与超分子 1.关于配合物的教学教学时应充分发挥实验的功能,培养学生的实验能力,引导学生探究配合物的结构特点。学生通过[实验3-2]观察一系列盐溶于水前后的颜色变化,比较异同,得知天蓝色是由四水合铜离子引起的。在对四水合铜离子的组成与结构的不断探究中,总结出以“电子对给予一接受”方式形成的配位键,引出配位键和配合物的概念。归纳配位化合物形成的条件:①配体或配位体含有孤电子对,是“电子对给予体”。②中心原子或离子能接受电子对,是“电子对接受体”。第四节 配合物与超分子 2.关于超分子的教学对超分子的教学要求不高,重点是帮助学生理解超分子的概念。教材中通过案例和图示的方式给出了具体的超分子,结合案例,可以把“杯酚”和冠醚的结构作进一步的介绍。“杯酚”结构看似几个单体“手牵手”围成圈,通过分离C60和C70的原理,理解“杯酚”和C60形成的超分子,感受化学在分子识别上的精确性。冠醚的形状好似皇冠,类似教材图2-13中的皇冠状分子S8。可结合冠醚的分子结构图理解冠醚名称的含义,探究冠醚环上的氧原子在离子识别上的作用。课时建议课程结束
单元解读第三章教学策略、学生活动 模块一 课标要求、教材解读 课标要求第三章 晶体结构与性质 本章增加了一些反映学科发展新成就的内容,这些内容都是首次被选进中学化学教材中,主要有物质的聚集状态、晶体结构的测定(晶体X射线衍射法)、准晶、过渡晶体、超分子等内容。这些新增加的内容,都是通过典型例子加以简单的介绍。另外,教材在选材方面,增选了一些与现实生活和科学前沿密切相关的素材,以拓展学生的视野,如等离子体、液晶、离子液体、纳米晶体等。教材解读晶体结构与性质晶体配合物超分子晶体的特性 晶 胞晶体结构的测定四种典型晶体分子晶体 共价晶体 金属晶体 离子晶体 配位键配位化合物超分子的特征物质的聚集状态物质的聚集状态与晶体的常识晶体晶体的特征晶胞晶体结构的测定本节内容主要包括分子晶体和共价晶体两部分。本节内容主要包括分子晶体和共价晶体两部分。主要包括金属晶体、离子晶体、过渡晶体与混合型晶体三部分。主要包括金属晶体、离子晶体、过渡晶体与混合型晶体三部分。主要包括金属晶体、离子晶体、过渡晶体与混合型晶体三部分。 模块二 教学目标、教学重难点 教学目标 模块三 教学策略第一节 物质的聚集状态 与晶体的常识1.关于晶体与非晶体的教学从教材“晶体与非晶体”正文的第一句话“走进化学实验室”引课,走进探究晶体与非晶体的情境之中,挖掘课本素材背后的新意,展示实验室里的一些常见固体,休现宏微结合。创新在于从宏观(肉眼可见)到微观(电子显微镜)的过程中,发现各种颜色掩盖之下,晶体形态的异同,从而引出晶体结构。教学策略第一节 物质的聚集状态 与晶体的常识2.关于自范性的教学 以硫酸铜为线索且贯穿始终,从实物到实验,从自然界到实验室。自范性是晶体能自发地呈现多面体外形的性质,晶体表现出自范性是有一定条件的。例如,晶体的生长速率要适当,并以教材中的天然水晶球里的玛瑙和水晶的形成为例帮助学生理解,同时感受地质学中的化学。 对于制备晶体的三条途径,即熔融态物质凝固、气态物质冷却不经液态直接凝固(凝华)和溶质从溶液中析出。第一节 物质的聚集状态 与晶体的常识3.关于晶胞的教学 要重点帮助学生理解晶胞的特征。整块晶体可以看作是数量巨大的晶胞“无隙并置”而成,所谓“无隙”,是指相邻晶胞之间没有任何间隙;所谓“并置”,是指所有晶胞都是平行排列的,取向相同。晶胞是8个顶角相同、三套各4根平行棱分别相同、三套各两个平行面分别相同的最小平行六面体。晶胞只是晶体微观空间里的一个基本单元,在它的上下左右前后无隙并置地排列着无数晶胞,而且所有晶胞的形状及内部的原子种类、个数及几何排列均完全相同。第二节 分子晶体与共价晶体1.关于分子晶体的教学一是如何理解氢键对分子晶体结构的影响,二是分子间只存在范德华力时分子晶体结构的特点。干冰和冰的晶体结构特点是分子晶体体结构中的普遍性和特殊性,由于冰中氢键的方向性决定了冰晶体的结构特点有其特殊性。氢键的作用力大于分子间的范德华力,所以冰和干冰的性质存在差异。第二节 分子晶体与共价晶体2.关于共价晶体的教学在金刚石教学环节,要从碳原子的结构特点出发,即金刚石中的C采取sp’杂化轨道形成共价键来理解金刚石的三维骨架结构,并结合金刚石的实物结构模型或多媒体课件,让学生感受金刚石的三维骨架结构。SiO2是另一种典型的共价晶体,可要求学生注意从分子品体和共价晶品体的不同点加以分析,组织学生认识共价晶体和分子晶体的区别。第三节 金属晶体与离子晶体1.关于金属晶体的教学 从金属原子结构的视角去认识金属键的本质。金属原子的价电子比较少,有易失去价电子的性质。在金属晶体中,每个金属原子都有机会失去价电子成为金属阳离子,每个阳离子都有机会结合价电子成为金属原子,这些价电子被许多原子或离子所共有,从而把所有的金属原子维系在一起。围绕“电子气”模型,分小组讨论金属具有导电性、导热性和延展性的原因,进一步加深结构决定性质的化学观念。第三节 金属晶体与离子晶体2.关于离子晶体的教学 氯化钠是学生日常生活中真实接触的物质,可以让学生通过生活中的一些实例来概括它的一些性质。可以通过对比CO2、金刚石、NaCl的晶体结构模型或演示多媒体课件,观察并对比三种晶体模型的各自特点,把分子晶体、共价晶体与离子晶体列表进行对比。为了开阔学生的思路,可以让学生观察硫酸铜晶体结构图,从中发现离子晶体中同时还存在共价键和氢键。第四节 配合物与超分子 1.关于配合物的教学教学时应充分发挥实验的功能,培养学生的实验能力,引导学生探究配合物的结构特点。学生通过[实验3-2]观察一系列盐溶于水前后的颜色变化,比较异同,得知天蓝色是由四水合铜离子引起的。在对四水合铜离子的组成与结构的不断探究中,总结出以“电子对给予一接受”方式形成的配位键,引出配位键和配合物的概念。归纳配位化合物形成的条件:①配体或配位体含有孤电子对,是“电子对给予体”。②中心原子或离子能接受电子对,是“电子对接受体”。第四节 配合物与超分子 2.关于超分子的教学对超分子的教学要求不高,重点是帮助学生理解超分子的概念。教材中通过案例和图示的方式给出了具体的超分子,结合案例,可以把“杯酚”和冠醚的结构作进一步的介绍。“杯酚”结构看似几个单体“手牵手”围成圈,通过分离C60和C70的原理,理解“杯酚”和C60形成的超分子,感受化学在分子识别上的精确性。冠醚的形状好似皇冠,类似教材图2-13中的皇冠状分子S8。可结合冠醚的分子结构图理解冠醚名称的含义,探究冠醚环上的氧原子在离子识别上的作用。课时建议课程结束
相关资料
更多









