

- 第04讲 氧化还原反应的规律及配平-【暑假学与练】2024年新高一化学暑假精品讲义+分层练习(人教版2019必修第一册)(含答案) 试卷 0 次下载
- 第05讲 钠及钠的氧化物-【暑假学与练】2024年新高一化学暑假精品讲义+分层练习(人教版2019必修第一册)(含答案) 试卷 0 次下载
- 第07讲 氯气的性质-【暑假学与练】2024年新高一化学暑假精品讲义+分层练习(人教版2019必修第一册)(含答案) 试卷 0 次下载
- 第08讲 氯气的制法 氯离子的检验-【暑假学与练】2024年新高一化学暑假精品讲义+分层练习(人教版2019必修第一册)(含答案) 试卷 0 次下载
- 第09讲 物质的量 摩尔质量-【暑假学与练】2024年新高一化学暑假精品讲义+分层练习(人教版2019必修第一册)(含答案) 试卷 0 次下载
第06讲 碳酸钠和碳酸氢钠 焰色试验-【暑假学与练】2024年新高一化学暑假精品讲义+分层练习(人教版2019必修第一册)(含答案)
展开[基础知识梳理]
一、碳酸钠和碳酸氢钠
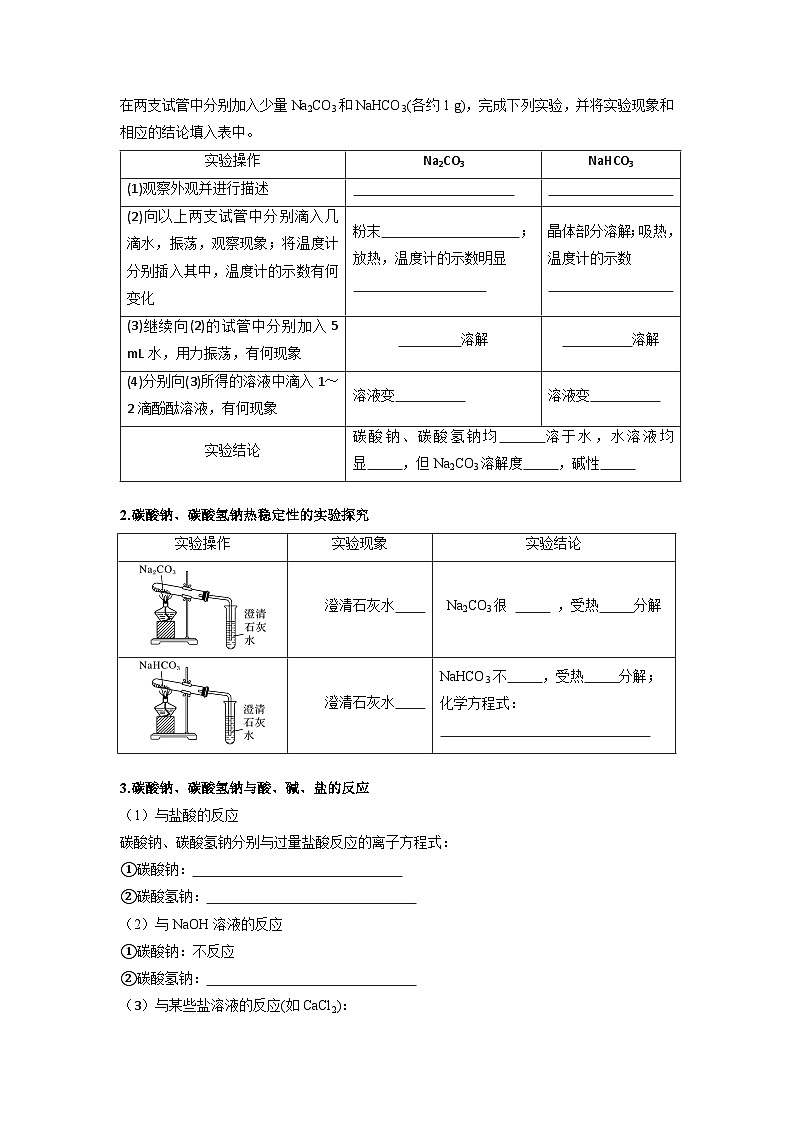
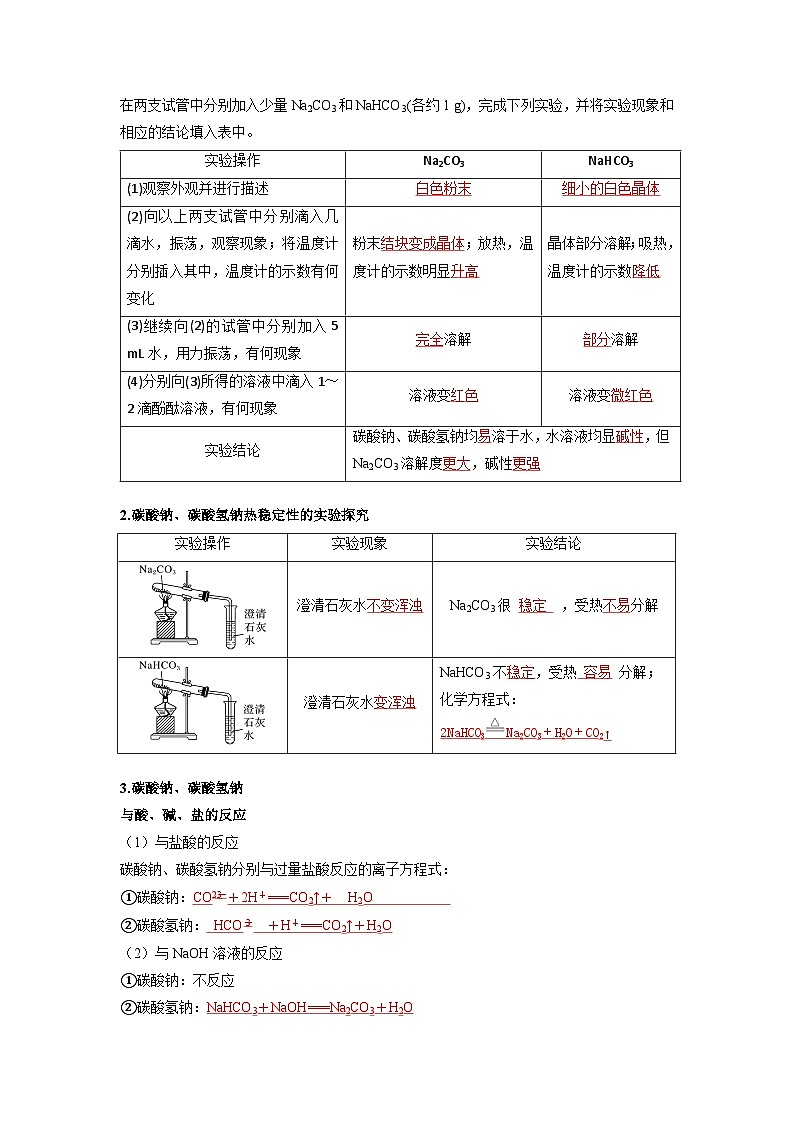
1.碳酸钠、碳酸氢钠的水溶性及酸碱性的实验探究
在两支试管中分别加入少量Na2CO3和NaHCO3(各约1 g),完成下列实验,并将实验现象和相应的结论填入表中。
2.碳酸钠、碳酸氢钠热稳定性的实验探究
3.碳酸钠、碳酸氢钠
与酸、碱、盐的反应
(1)与盐酸的反应
碳酸钠、碳酸氢钠分别与过量盐酸反应的离子方程式:
①碳酸钠:COeq \\al(2-,3)+2H+===CO2↑+ H2O
②碳酸氢钠: HCOeq \\al(-,3) +H+===CO2↑+H2O
(2)与NaOH溶液的反应
①碳酸钠:不反应
②碳酸氢钠:NaHCO3+NaOH===Na2CO3+H2O
(3)与某些盐溶液的反应(如CaCl2):
①碳酸钠:COeq \\al(2-,3)+Ca2+===CaCO3↓;
②碳酸氢钠:不反应。
【易错提醒】鉴别Na2CO3和NaHCO3的易错点:
①Na2CO3和盐酸可以用互滴法鉴别,但NaHCO3和盐酸不可以用互滴法鉴别。
②鉴别Na2CO3和NaHCO3时,不能用NaOH溶液(虽然前者不反应后者反应,均无明显现象),也不能用澄清的石灰水或Ba(OH)2溶色液,均产生白色沉淀。
4.碳酸钠与碳酸氢钠的相互转化
5.碳酸钠和碳酸氢钠的应用
Na2CO3和NaHCO3的水溶液均显碱性,可作为食用碱或工业用碱。Na2CO3的主要用途为纺织、制皂、造纸、制玻璃等;NaHCO3的主要用途为制药、焙制糕点等。
二、侯氏制碱法——制纯碱
往饱和食盐水中依次通入足量的NH3、CO2,利用NaHCO3的溶解性小于NH4HCO3的溶解性原理,使NaHCO3从溶液中析出。反应的化学方程式为:
NH3+CO2+H2O+NaCl(饱和)=NaHCO3↓+NH4Cl
2NaHCO3eq \(====,\s\up6(Δ))Na2CO3+H2O+CO2↑
【易错提醒】不能先通入CO2、再通入NH3至饱和。
三、焰色试验
1.定义:很多金属或它们的化合物在灼烧时都会使火焰呈现出特征 颜色。根据火焰呈现的特征颜色,可以判断试样所含的金属元素,化学上把这样的定性分析操作称为焰色试验。
2.操作
操作过程以铂丝做被灼烧物质的载体,焰色反应的操作方法是:
3.常见元素的焰色:钠元素黄色;钾元素紫色(透过蓝色钴玻璃观察)。
【易错提醒】(1)焰色试验是物理变化而不是化学变化。
(2)焰色试验是金属元素的性质,不是物质的性质。焰色试验产生的火焰颜色与元素的存在状态无关,如灼烧钠的化合物和单质时,火焰颜色均为黄色。
(3)并不是所有的金属元素都能发生焰色反应,如Fe。
(4)在中学化学实验中要求掌握钠、钾的焰色反应,对于K+的火焰颜色必须透过蓝色钴玻璃进行观察,目的是滤去黄色的光,避免少量的钠元素对鉴别钾元素的干扰。
4.应用
(1)检验金属元素的存在,如鉴别NaCl和KCl溶液。
(2)制造节日烟花。
[核心考点剖析]
考点一: 碳酸钠和碳酸氢钠的性质
[典例1](23-24高一上·山西大同·期中)某兴趣小组设计了如图所示实验来验证热稳定性:碳酸钠>碳酸氢钠。忽略空气中的对澄清石灰水的影响,下列说法错误的是
A.甲为小苏打,乙为纯碱
B.甲为Na2CO3,乙为NaHCO3
C.要证明碳酸钠或碳酸氢钠受热能产生水,可在两支试管内均放置含有无水硫酸铜粉末的棉花
D.整个实验过程中烧杯中的澄清石灰水不变浑浊
【答案】B
【分析】碳酸钠加热不分解,碳酸氢钠加热分解生成使澄清石灰水变浑浊的二氧化碳气体,碳酸钠放入大试管温度高不分解,碳酸氢钠放入小试管温度低能分解,说明碳酸氢钠热稳定性差;
【详解】A.加热时内管的温度低于外管的温度,要证明碳酸钠的热稳定性比碳酸氢钠的热稳定性强,应将碳酸氢钠放置于内管中,故甲为碳酸氢钠(或小苏打),乙为碳酸钠(或纯碱),A正确;
B.由分析可知,甲为,乙为,B错误;
C.无水硫酸铜遇水变蓝,在试管内放置含有无水硫酸铜粉末的棉花,可以检验反应过程中是否有水生成,C正确;
D.碳酸钠很稳定,不易分解,没有二氧化碳气体生成,A烧杯中的澄清石灰水不变浑浊,D正确;
故选B。
[典例2](23-24高一上·广东惠州·期中)下列有关说法正确的是
A.为了除去Na2CO3溶液中的NaHCO3,可滴加适量的稀盐酸
B.为了除去NaHCO3固体中的Na2CO3,可通过加热除去
C.热稳定性:
D.将某溶液与稀盐酸反应产生的气体通入澄清石灰水中,石灰水变浑浊,说明该溶液中含有CO
【答案】C
【详解】A.稀盐酸与NaHCO3与Na2CO3都会发生反应,且Na2CO3与HCl反应时还会反应产生NaCl杂质,不能达到实验目的,A错误;
B.加热碳酸氢钠会分解为碳酸钠、二氧化碳和水,达不到除去NaHCO3固体中的Na2CO3的目的,B错误;
C.碳酸氢钠加热能分解为碳酸钠、二氧化碳和水,碳酸钠加热不分解,故热稳定性:NaHCO3
本题选C。
[典例3](23-24高一上·河南周口·月考)小苏打和苏打分别和等浓度的盐酸反应,下列说法正确的是
A.苏打与盐酸的反应比较剧烈
B.等物质的量的小苏打和苏打分别与盐酸完全反应,产生的CO2质量相等
C.实验室制取CO2通常用苏打和盐酸反应
D.等物质的量的小苏打和苏打分别与盐酸完全反应,消耗的盐酸一样多
【答案】B
【分析】小苏打为NaHCO3,苏打为Na2CO3。
【详解】A.Na2CO3和盐酸反应先生成NaHCO3,NaHCO3再和盐酸反应生成二氧化碳,因此NaHCO3与盐酸的反应更剧烈,故A错误;
B.NaHCO3与盐酸反应:, Na2CO3与盐酸反应:,即等物质的量的NaHCO3和Na2CO3分别与盐酸完全反应,产生的CO2质量相等,故B正确;
C.实验室制取CO2通常用大理石或石灰石和盐酸反应,故C错误;
D.NaHCO3与盐酸反应:, Na2CO3与盐酸反应:,即等物质的量的NaHCO3和Na2CO3分别与盐酸完全反应,消耗盐酸的物质的量为1:2,故D错误;
故选B。
考点二: 碳酸钠和碳酸氢钠的鉴别
[典例4](23-24高一上·河南安阳·期中)有两个试管分别装有等浓度的和溶液,下列操作或判断正确的是
A.AB.BC.CD.D
【答案】C
【详解】A.Na2CO3、NaHCO3溶液与澄清石灰水反应的化学方程式为Na2CO3+Ca(OH)2=CaCO3↓+2NaOH、2NaHCO3+Ca(OH)2=CaCO3↓+2H2O+Na2CO3,即都能产生碳酸钙沉淀,现象相同,故A错误;
B.等浓度的Na2CO3、NaHCO3溶液分别加入等浓度的稀盐酸,NaHCO3溶液与盐酸反应更为剧烈,故B错误;
C.等浓度的Na2CO3、NaHCO3溶液分别加入CaCl2溶液,只有Na2CO3溶液能够产生碳酸钙沉淀,NaHCO3溶液与CaCl2溶液不反应,故C正确;
D.等浓度的Na2CO3、NaHCO3溶液逐滴加入等浓度的盐酸,Na2CO3溶液与盐酸的反应开始无明显现象,后来有气泡产生,而碳酸氢钠溶液与盐酸反应立即产生气泡,故D错误;
故答案为:C。
[典例5]为了鉴别和两种白色固体,设计了如下几种实验方法。下列说法不正确的是
A.装置Ⅰ中的和均能与盐酸反应,产生气体速率快的是
B.当稀盐酸足量时,装置Ⅰ中气球鼓起体积较小的是
C.加热装置Ⅱ,澄清石灰水变浑浊一侧的白色固体是
D.使用装置Ⅲ,在相同条件下分别配制和溶液并立刻测量溶液温度,也能鉴别这两种白色固体
【答案】B
【详解】A.碳酸钠和碳酸氢钠均能与盐酸反应生成二氧化碳气体,盛放碳酸氢钠的气球鼓起的更快说明碳酸氢钠产生气体速率快于碳酸钠,故A正确;
B.由碳原子个数守恒可知,等质量的碳酸钠和碳酸氢钠与足量盐酸反应时,碳酸氢钠产生的二氧化碳量多,所以装置Ⅰ中气球鼓起体积较大的是碳酸氢钠,故B错误;
C.碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,反应生成的二氧化碳能使澄清石灰水变浑浊,而碳酸钠受热不分解,所以加热装置Ⅱ,澄清石灰水变浑浊一侧的白色固体是碳酸氢钠,故C正确;
D.碳酸钠固体溶于水的过程为放热过程,碳酸氢钠溶于水的过程为吸热过程,所以使用装置Ⅲ,在相同条件下分别配制碳酸钠和碳酸氢钠溶液并立刻测量溶液温度,也能鉴别碳酸钠固体和碳酸氢钠固体,故D正确;
故选B。
[典例6]下列可用于判断碳酸氢钠粉末中混有碳酸钠的实验方法及现象的是
A.加热时无气体放出
B.滴加盐酸时有气泡放出
C.溶于水后滴加BaCl2稀溶液有白色沉淀生成
D.溶于水后滴加澄清石灰水有白色沉淀生成
【答案】C
【详解】A.碳酸氢钠固体加热分解生成二氧化碳气体,不管有无碳酸钠混入,加热时均会有气体放出,A错误;
B.碳酸氢钠能与盐酸反应生成二氧化碳气体,不管有无碳酸钠混入,滴加盐酸时都有气泡放出,B错误;
C.碳酸氢钠与氯化钡不反应,碳酸钠能与氯化钡反应生成碳酸钡白色沉淀,将粉末溶于水滴加氯化钡溶液,有白色沉淀生成,说明含有碳酸钠,C正确;
D.碳酸氢钠能与氢氧化钙反应生成碳酸钙沉淀,将粉末溶于水滴加澄清石灰水,无论是否有碳酸钠,都会生成白色沉淀,D错误;
故答案选C。
考点三:侯氏制碱法
[典例7](23-24高一上·山东青岛·期中)侯德榜将氨碱法和合成氨工艺联合起来,发明了侯氏制碱法,原料为饱和食盐水、氨气、二氧化碳,制备纯碱。下列装置能达到相应实验目的的是
A.AB.BC.CD.D
【答案】C
【详解】A.由于CO2能与Na2CO3溶液反应,故除去CO2中的HCl应该用饱和NaHCO3溶液,而不能用饱和Na2CO3溶液,A不合题意;
B.由于CO2在水中的溶解度比NH3在水中的溶解度小得多,而CO2在氨水中的溶解度大得多,故制备NaHCO3应该将CO2通入到溶有饱和NH3的饱和食盐水中,且通入NH3需要有防止倒吸装置,B不合题意;
C.由题干信息可知,侯氏制碱法制得的NaHCO3为晶体析出,分离固体和液体的方法为过滤,C符合题意;
D.加热固体时,试管口应该向下倾斜,D不合题意;
故答案为:C。
[典例8](23-24高一上·吉林延边·期末)侯氏制碱法又称联合制碱法,其部分工艺流程如图,下列说法不正确的是
A.该工艺利用了不同物质溶解度的差异
B.流程图中可循环使用的物质是
C.饱和食盐水中先通入的气体为,再通入的气体为
D.操作①的方法是蒸发结晶
【答案】D
【分析】向饱和食盐水依次通入氨气、二氧化碳,发生反应生成碳酸氢钠晶体和氯化铵,过滤得到含氯化铵的溶液和碳酸氢钠晶体,碳酸氢钠加热分解生成碳酸钠,含氯化铵的溶液经过操作②得氯化铵和母液。
【详解】A.碳酸氢钠溶解度小于氯化铵和氯化钠,首先析出碳酸氢钠晶体,所以该工艺利用了不同物质溶解度的差异,故A正确;
B.据图示可知,可循环使用的物质有二氧化碳,故B正确;
C.二氧化碳微溶于水,氨气极易溶于水,饱和食盐水中先通入的气体为氨气,通氨气后再通二氧化碳,可增大二氧化碳的溶解度,故C正确;
D.操作①获得一份晶体和一份溶液,故该操作为过滤,故D错误;
故答案为:D。
[典例9](23-24高一上·江苏无锡·期末)我国化学工程专家侯德榜于1943年创立的侯氏制碱法,他以饱和食盐水、氨气和二氧化碳为原料同时生产纯碱和氯化铵两种产品。下列说法不正确的是
A.的水溶液能导电,但属于非电解质
B.侯氏制碱法制得的纯碱是指碳酸钠
C.可按如上图装置通入气体,制得固体
D.鉴别和溶液可用澄清石灰水
【答案】D
【详解】A.的水溶液能导电,是由于其溶于水形成的一水合氨为电解质,但属于非电解质,A正确;
B.纯碱是指碳酸钠,B正确;
C.向氨气与食盐的饱和溶液中通入二氧化碳生成碳酸氢钠与氯化铵,C正确;
D.和溶液都可与澄清石灰水反应生成碳酸钙白色沉淀,无法鉴别,D错误;
故选D。
考点四:焰色试验
[典例10]下列物质在焰色试验中,火焰呈黄色的是
A.B.KOHC.D.
【答案】C
【详解】焰色试验是某些金属或它们的化合物在无色火焰中灼烧时使火焰呈现特殊颜色的反应,含有钠元素的物质,焰色试验中火焰呈黄色,可知C符合题意。
[典例11]下列有关焰色反应的叙述,正确的是
①钾的焰色反应,火焰的颜色要透过蓝色钴玻璃观察
②先把铂丝洗净,然后在外焰上灼烧至与原来火焰颜色相同,再蘸取被检验的物质
③每次实验后,要用稀硫酸把铂丝洗净
④实验时最好选择本身颜色较微弱的火焰
⑤没有铂丝也可用光洁无锈的铁丝代替
⑥焰色反应是化学变化
仅②③不正确B.仅③⑥不正确
C.仅⑥不正确 D.全对
【答案】C
【详解】①钠元素的黄光会干扰钾的紫色,观察钾元素紫色火焰时,要透过蓝色钴玻璃,①正确;
②铂丝不能粘有杂质,实验前必须做空白灼烧试验,②正确;
③更换检验对象时,需要用盐酸清洗铂丝表面残留物,将其转化为可挥发的氯化物,③正确;
④本身颜色越微弱的火焰,实验干扰越小,被检验物质的火焰颜色越明显,④正确;
⑤焰色反应除用铂丝外,还可以用光洁无锈的铁丝、镍丝、铬丝等,⑤正确;
⑥焰色反应是物理变化,⑥错误;
故选C。
[典例12](23-24高一上·山西大同·期中)研究表明,焰火颜色的产生与烟花中含有钠、钾、钙、钡、铜、锶等金属元素有关。下列有关说法不正确的是
A.五彩缤纷的焰火的形成是因为上述金属元素产生了不同的焰色
B.KCl与KNO3灼烧时火焰的颜色不相同
C.金属钠灼烧的的火焰颜色为黄色
D.观察钾及其化合物的焰色需要透过蓝色钴玻璃
【答案】B
【详解】A.不同金属元素的焰色不同,焰火的形成与焰色反应有关,故A正确;
B.KCl与KNO3都含钾元素,烧时火焰的颜色相同,故B错误;
C.钠的焰色为黄色,金属钠灼烧的的火焰颜色为黄色,故C正确;
D.观察钾及其化合物的焰色需要透过蓝色钴玻璃滤去黄光,故D正确;
选B。
[基础过关练]
1.下列有关和性质比较中,正确的是
A.热稳定性:
B.常温时,水溶液中的溶解度:
C.相同条件下,与稀盐酸反应快慢:
D.用澄清石灰水能鉴别溶液和溶液
【答案】A
【详解】A.碳酸钠加热不分解,碳酸氢钠加热分解,则热稳定性:Na2CO3>NaHCO3,故A正确;
B.常温时,碳酸氢钠的溶解度比碳酸钠的溶解度小,故B错误;
C.碳酸钠和盐酸反应先生成碳酸氢钠,碳酸氢钠再和盐酸反应生成二氧化碳,所以和盐酸反应的快慢:Na2CO3<NaHCO3,故C错误;
D.碳酸钠和碳酸氢钠都能和澄清石灰水反应生成碳酸钙沉淀,故澄清石灰水不能鉴别Na2CO3和NaHCO3,故D错误。
答案选A。
2.(23-24高一上·福建福州·期中)鉴别下列各组物质,只能采用焰色试验的是
A.和KClB.NaCl和KCl
C.NaCl和D.KCl和
【答案】B
【详解】A.可用氯化钡鉴别,出现白色沉淀的为,无现象的为NaCl,故A错误;
B.阴离子相同,Na、K的焰色反应分别为黄色、紫色,只能采用焰色试验鉴别,故B正确;
C.可用氯化钡鉴别,出现白色沉淀的为,故C错误;
D.KCl易溶于水,难溶于水,可用水检验,故D错误;
故选:B。
3.(23-24高一上·江苏盐城·期末)下列有关Na2CO3、NaHCO3的性质和应用说法正确的是
A.与同浓度盐酸反应的剧烈程度:NaHCO3
C.鉴别Na2CO3和NaHCO3溶液可滴加Ba(OH)2溶液,生成白色沉淀的是Na2CO3
D.NaHCO3固体中混有少量Na2CO3:加热固体至质量恒定
【答案】B
【详解】A.碳酸钠和盐酸反应先生成碳酸氢钠,碳酸氢钠再和盐酸反应生成二氧化碳,与同浓度盐酸反应的剧烈程度:NaHCO3>Na2CO3,A错误;
B.Na2CO3比NaHCO3易溶于水,在饱和Na2CO3溶液中通入过量二氧化碳气体可得到NaHCO3沉淀,B正确;
C.碳酸钠和碳酸氢钠都能和Ba(OH)2溶液反应生成碳酸钡沉淀,不能区分,C错误;
D.NaHCO3不稳定,加热易分解,碳酸钠稳定,故不能加热固体除去碳酸钠,D错误;
故选B。
4.(23-24高一上·河南安阳·期中)下列关于碳酸氢钠(NaHCO3)的叙述中,不正确的是
A.可溶于水B.能与澄清石灰水反应
C.受热不分解D.能与盐酸反应
【答案】C
【详解】A.碳酸氢钠是可溶性钠盐,能够溶于水,A正确;
B.碳酸氢钠能与澄清石灰水反应,产生碳酸钙、碳酸钠、水,B正确;
C.碳酸氢钠不稳定,受热易分解,反应产生碳酸钠、水、二氧化碳,C错误;
D.由于酸性:HCl>H2CO3,所以碳酸氢钠能与盐酸反应,产生氯化钠、水、二氧化碳,D正确;
故合理选项是C。
5.(23-24高一上·安徽蚌埠·期末)向饱和食盐水中先通入过量的,再通入过量的有晶体析出,该晶体是
A.B.C.D.
【答案】A
【详解】向饱和食盐水中先通入过量的,再通入过量的发生反应,析出的晶体为,
故答案为:A。
6.(23-24高一上·湖南郴州·期中)下列钠的化合物与其性质或用途不相符的是
A.——淡黄色固体B.——白色固体
C.——碱性弱,可用于制作胃药D.——受热易分解
【答案】C
【详解】A.是淡黄色固体,与其性质相符,A不符合题意;
B.是白色固体,与其性质相符,B不符合题意;
C.的碱性较强,不可用于制作胃药,与其用途不相符,C符合题意;
D.受热易分解为、水、二氧化碳,与其性质相符,D不符合题意;
故选C。
7.(23-24高一上·内蒙古鄂尔多斯·期中)下列关于金属元素焰色试验的说法中错误的是
A.只有金属元素的单质可以进行焰色试验
B.部分金属单质在灼烧时可以产生特定的焰色
C.实验室无铂丝时可以用洁净的铁丝代替
D.钾元素的焰色试验中需要用到蓝色钴玻璃
【答案】A
【详解】A.焰色试验是一种金属元素的性质,而不是单质或化合物的性质,所以并不是只有金属单质才有焰色反应,化合物也可以,故A错误;
B.部分金属单质在灼烧时可以产生特定的焰色,如钠单质灼烧时的焰色为黄色,故B正确;
C.铂丝、铁丝是在火焰上灼烧时都为无色,可以作为焰色试验的物质的载体,故C正确;
D.观察钾元素的焰色时,透过蓝色钴玻璃可滤去黄色的光,消除钠元素产生的干扰,故D正确;
故答案为:A。
8.(23-24高一上·天津·期中)下列有关和性质比较中,正确的是
A.澄清石灰水可以鉴别溶液和溶液
B.常温时在水溶液中的溶解度:
C.等质量的和分别与稀盐酸反应,后者生成气体多
D.碱性:
【答案】C
【详解】A.澄清石灰水与Na2CO3和NaHCO3溶液都能生成白色沉淀,不能鉴别二者,故A错误;
B.常温下相同的溶剂时,Na2CO3较NaHCO3易溶,则常温时水溶性Na2CO3>NaHCO3,故B错误;
C.等质量的Na2CO3和NaHCO3,碳酸钠的摩尔质量大,其物质的量少,则等质量的固体与足量盐酸反应放出CO2的质量NaHCO3>Na2CO3,故C正确;
D.Na2CO3为正盐,NaHCO3为酸式盐,等浓度的两种溶液,Na2CO3溶液的碱性较强,故D错误;
故选:C。
9.(23-24高一上·湖北孝感·期中)已知两支试管中分别装有等浓度的和溶液,下列操作或判断错误的是
A.AB.BC.CD.D
【答案】A
【详解】A.加入澄清石灰水,和溶液均产生沉淀,A错误;
B.分别加入等浓度的稀盐酸,溶液反应更剧烈,B正确;
C.相同浓度,溶液碱性更强,滴加几滴酚酞,红色更深,C正确;
D.溶液加入盐酸立即产生气泡,溶液加入盐酸先转化为,刚开始没有气泡,D正确;
故选A。
10.以不同类别物质间的转化为线索认识钠及其化合物。
下列分析不正确的是
A.反应③表明CO2具有酸性氧化物的性质
B.反应④说明NaHCO3的稳定性强于Na2CO3
C.反应⑤、⑥,Na2O2中氧元素的化合价为-1
D.上述转化中发生的反应有分解反应、化合反应、置换反应
【答案】B
【详解】A.反应③是氢氧化钠和二氧化碳反应生成碳酸钠和水,是碱和酸性氧化物反应生成盐和水,则表明CO2具有酸性氧化物的性质,故A正确;
B.反应④是碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,说明NaHCO3的稳定性弱于Na2CO3,故B错误;
C.反应⑤、⑥,Na2O2中钠元素的化合价为+1价,则氧元素的化合价为−1价,故C正确;
D.上述转化中发生的反应有分解反应,比如碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,有化合反应,比如钠和氧气加热反应生成过氧化钠,有置换反应,比如钠和水反应生成氢氧化钠和氢气,故D正确。
综上所述,答案为B。
[能力提升练]
1.(23-24高一上·四川南充·期中)利用焰色试验,人们在烟花中有意识地加入特定金属元素,使焰火更加绚丽多彩。下列说法中正确的是
A.焰色试验是化学变化B.可用焰色试验区分NaOH与NaCl
C.焰色试验均应透过蓝色钴玻璃观察D.焰色试验中需用盐酸洗净铂丝
【答案】D
【详解】A.焰色试验是在灼烧时金属元素原子核外电子跃迁时的能量变化,在该过程中没有新物质产生,因此发生的是物理变化,而不是化学变化,A错误;
B.NaOH与NaCl都是钠元素的化合物,焰色试验都显黄色,因此用焰色试验无法区分NaOH与NaCl,B错误;
C.只有钾元素的焰色试验应透过蓝色钴玻璃观察,其它金属元素金属焰色试验时不需要透过蓝色钴玻璃观察,C错误;
D.焰色试验中,当检测完一种物质的溶液,再检测另外一种物质时,需用盐酸洗净铂丝,使前边金属元素的化合物转化为熔沸点低的氯化物,通过灼烧变为气体分离除去,避免对检测物质的检验造成感染,D正确;
故合理选项是D。
2.小苏打和苏打分别和等浓度的盐酸反应,下列说法正确的是
A.苏打与盐酸的反应比较剧烈
B.等物质的量的小苏打和苏打分别与盐酸完全反应,产生的CO2质量相等
C.实验室制取CO2通常用苏打和盐酸反应
D.等物质的量的小苏打和苏打分别与盐酸完全反应,消耗的盐酸一样多
【答案】B
【分析】小苏打为NaHCO3,苏打为Na2CO3。
【详解】A.Na2CO3和盐酸反应先生成NaHCO3,NaHCO3再和盐酸反应生成二氧化碳,因此NaHCO3与盐酸的反应更剧烈,故A错误;
B.NaHCO3与盐酸反应:, Na2CO3与盐酸反应:,即等物质的量的NaHCO3和Na2CO3分别与盐酸完全反应,产生的CO2质量相等,故B正确;
C.实验室制取CO2通常用大理石或石灰石和盐酸反应,故C错误;
D.NaHCO3与盐酸反应:, Na2CO3与盐酸反应:,即等物质的量的NaHCO3和Na2CO3分别与盐酸完全反应,消耗盐酸的物质的量为1:2,故D错误;
故选B。
3.侯德榜是我国著名的化学家,侯氏制碱法主要原理如下:
①
②再将碳酸氢钠固体加热使其分解:
下列说法正确的是
A.常温下,NaHCO3溶解度大于碳酸钠B.Na2CO3的热稳定性比NaHCO3要强
C.侯氏制碱法所制备的“碱”属于碱类D.用澄清石灰水可以鉴别Na2CO3和NaHCO3
【答案】B
【详解】A.由NaCl+NH3+H2O+CO2═NaHCO3↓+NH4Cl可知,析出碳酸氢钠固体,则常温下,NaHCO3溶解度小于碳酸钠,故A错误;
B.NaHCO3加热使其分解,Na2CO3的热稳定性比NaHCO3要强,故B正确;
C.侯氏制碱法所制备的“碱”为碳酸钠,属于盐类物质,故C错误;
D.Na2CO3和NaHCO3均与石灰水反应生成白色沉淀,现象相同,不能鉴别,故D错误;
故选:B。
4.(23-24高一上·山东滨州·期中)制作馒头时,一般用酵头发面,然后加入调节酸性。可以单独用作蒸馒头的膨松剂,为了使蒸的馒头更好吃,使用的同时常加入一定量的食醋。下列说法正确的是
A.碳酸钠可以作食品膨松剂
B.可用澄清石灰水鉴别和
C.在水溶液中的电离方程式为:
D.等质量和酸反应时产生的的量与其受热分解时产生的的量不相等
【答案】D
【详解】A.碳酸氢钠受热分解产生CO2,可用作食品膨松剂,故A错误;
B.Na2CO3和NaHCO3两种溶液与石灰水反应均生成碳酸钙白色沉淀,不能鉴别,应选氯化钙,故B错误;
C.在水溶液中的电离产生钠离子和碳酸氢根离子,电离方程式为:,故C错误;
D.NaHCO3和酸反应方程式为NaHCO3+HCl=NaCl+H2O+CO2↑,NaHCO3不稳定,加热易分解:2NaHCO3Na2CO3+CO2↑+H2O,生成相同质量二氧化碳时所需碳酸氢钠质量不同,因此等质量NaHCO3产生两种二氧化碳质量不相等,故D正确;
答案选D。
5.(23-24高一上·北京·期中)除去Na2CO3固体中少量NaHCO3的最佳方法是
A.加入适量盐酸B.加入NaOH溶液
C.加热D.配成溶液后通入CO2
【答案】C
【详解】A.Na2CO3和NaHCO3均与盐酸反应,不能除去Na2CO3固体中混有少量NaHCO3,A项错误;
B.加入NaOH溶液,NaOH与NaHCO3反应生成Na2CO3,但还需蒸发结晶得到Na2CO3固体,方法较麻烦,不是最佳方法,B项错误;
C.置于坩埚中加热,NaHCO3直接分解成Na2CO3,方法简单,是最佳方法,C项正确;
D.CO2与Na2CO3反应,不与NaHCO3反应,不能除去Na2CO3固体中混有少量NaHCO3,D项错误;
故选C。
6.(23-24高一上·浙江台州·期中)如图是比较碳酸钠和碳酸氢钠热稳定性实验,棉花球沾有无水硫酸铜,下列说法不正确的是
A.小试管内盛装碳酸氢钠
B.棉花球现象是变蓝色,说明碳酸氢钠受热不稳定
C.烧杯A澄清石灰水不变浑浊,烧杯B澄清石灰水变浑浊
D.两个烧杯中导管口均出现气泡,说明碳酸氢钠和碳酸钠受热都易分解
【答案】D
【详解】A.碳酸氢钠在小试管,碳酸钠在大使管,大试管直接加热,温度较高,如温度较高的不分解,而加热温度较低的物质分解,可判断稳定强弱,故大试管内盛装碳酸钠、小试管内盛装碳酸氢钠, A正确;
B.白色的无水硫酸铜遇到水变蓝色。若证明碳酸氢钠不稳定受热分解生成水,可在小试管内塞上沾有无水硫酸铜粉末的棉花球,若变蓝则说明有水生成, B正确;
C.碳酸钠较稳定,加热过程中不会分解,则连接A烧杯的试管不会产生二氧化碳,所以A烧杯的澄清石灰水不变浑浊。碳酸氢钠不稳定,加热过程中分解产生二氧化碳,连接B烧杯的试管澄清石灰水变浑浊, C正确;
D.碳酸钠比较稳定,加热过程中不会生成二氧化碳,则烧杯A中导管出现的气泡是装置中的空气,烧杯A中澄清石灰水不会变浑浊,说明碳酸钠受热不易分解, D错误;
故选D。
7.(23-24高一上·重庆永川·期中)下列关于Na2CO3和NaHCO3性质的说法,正确的是
A.在水中的溶解度:NaHCO3>Na2CO3
B.可以用澄清的石灰水鉴别
C.热稳定性:NaHCO3<Na2CO3
D.Na2CO3不能转化成NaHCO3,而NaHCO3能转化成Na2CO3
【答案】C
【详解】A.在水中的溶解度:NaHCO3
C.碳酸氢钠受热分解为碳酸钠,热稳定性:NaHCO3<Na2CO3,C正确;
D.Na2CO3和水、二氧化碳反应转化成NaHCO3,NaHCO3受热分解转化成Na2CO3,D错误;
故选C。
8.(23-24高一上·四川成都·期中)用如图实验装置测定碳酸钠和碳酸氢钠混合物样品的组成,下列说法中不正确的是
A.滴入盐酸前,应先通空气将装置中含有CO2的空气排尽
B.若将Ba(OH)2溶液替换为Ca(OH)2溶液,可减小实验误差
C.可根据②中样品质量与③中生成的沉淀质量确定原混合物的组成
D.反应结束时,应继续通入空气将装置②中的CO2转移到装置③中
【答案】B
【分析】该实验是根据碳酸钠、碳酸氢钠与盐酸反应生成CO2,然后测定氢氧化钡溶液与CO2反应产生的沉淀质量,可以求出CO2的质量,结合样品质量,就可以计算出纯碱及碳酸氢钠的质量。由于装置中的空气中含有CO2,会引起实验误差,故开始反应之前先从左侧通入空气,经过洗气瓶①后除去空气中的CO2,然后用不含CO2的空气排空装置②中的CO2,再通过分液漏斗滴入稀盐酸,开始反应,然后通过装置③中产生沉淀的质量来计算CO2的质量。
【详解】A.滴入盐酸前,将装置中含有CO2的空气排尽,否则测定结果偏高,A正确;
B.由于Ca(OH)2的溶解度非常小,很容易导致CO2吸收不完全或者将生成的CaCO3转化为Ca(HCO3)2而溶解,引起实验误差,B错误;
C.②中样品与盐酸反应生成二氧化碳,根据③中生成的碳酸钡沉淀质量可确定二氧化碳的质量,根据碳元素守恒、样品质量可计算样品中碳酸钠和碳酸氢钠的组成,C正确;
D.反应结束后,继续通入空气使生成的二氧化碳被③中溶液完全吸收,保证测定结果更准确,D正确;
故合理选项是B。
9.小组同学探究和的性质及相互转化,实验如图(夹持装置已略去,气密性已检验)。下列说法不正确的是
A.实验Ⅰ,A中澄清石灰水无明显变化,B中澄清石灰水变浑浊
B.实验Ⅱ,C中发生反应的离子方程式为:
C.实验Ⅱ中,一段时间之后,可观察到中有细小晶体析出
D.等物质的量的、分别与足量盐酸反应,生成的更多
【答案】D
【详解】A.实验Ⅰ,Na2CO3受热不分解,A中澄清石灰水无明显变化,NaHCO3受热分解生成的CO2使B中澄清石灰水变浑浊,A项正确;
B.实验Ⅱ,C中NaHCO3与盐酸反应生成NaCl、H2O和CO2,反应的离子方程式为+H+=H2O+CO2↑,B项正确;
C.实验Ⅱ中,D中饱和NaHCO3溶液用于除去CO2中的HCl,CO2通入E的饱和Na2CO3溶液中发生反应CO2+Na2CO3+H2O=2NaHCO3,由于相同温度下Na2CO3的溶解度大于NaHCO3、且该反应中消耗H2O,故一段时间后可观察到E中有细小晶体析出,该细小晶体为NaHCO3,C项正确;
D.等物质的量的Na2CO3、NaHCO3中碳原子物质的量相等,分别与足量盐酸反应,生成的CO2相等,D项错误;
答案选D。
10.(23-24高一上·湖南常德·期末)下列关于碳酸钠和碳酸氢钠的叙述正确的是
A.相同条件下,在水中的溶解性:碳酸钠<碳酸氢钠
B.相同条件下,溶液的碱性:碳酸钠>碳酸氢钠
C.相同条件下,与酸反应产生二氧化碳气体的速率:碳酸钠>碳酸氢钠
D.碳酸钠溶液和碳酸氢钠溶液可以用澄清石灰水来区别
【答案】B
【详解】A.碳酸钠和碳酸氢钠都易溶于水,但在相同条件下,在水中的溶解性:碳酸钠>碳酸氢钠,A不正确;
B.相同温度下,相同浓度的碳酸钠的碱性更强,所以溶液的碱性:碳酸钠>碳酸氢钠,B正确;
C.相同条件下,碳酸钠与酸反应时,先生成碳酸氢钠,再与酸反应才生成二氧化碳气体,所以与酸反应产生二氧化碳气体的速率:碳酸钠<碳酸氢钠,C不正确;
D.碳酸钠溶液和碳酸氢钠溶液都能与澄清石灰水反应,从而生成碳酸钙沉淀,所以不能用澄清石灰水区分碳酸钠与碳酸氢钠,D不正确;
故选B。
11.(23-24高一上·北京·期中)某小组同学进行Na2CO3和NaHCO3性质的探究,实验如图(夹持装置已略去,气密性已检验)。
(1)实验I,能够证明Na2CO3的热稳定性强于NaHCO3的证据是 ,NaHCO3加热分解的化学方程式为 。
(2)实验II,方框内装置中饱和NaHCO3的作用是 。
(3)实验II圆底烧瓶中发生反应的离子方程式为: ,持续一段时间后,观察到饱和Na2CO3溶液中有细小晶体析出,用化学方程式表示产生细小晶体的原因: 。
【答案】(1) 相同条件下,试管A中无明显现象,试管B中产生白色沉淀 2NaHCO3 Na2CO3 + CO2 ↑ + H2O
(2)除去混合气体中的HCl
(3) HCO+H+=H2O+CO2 ↑ Na2CO3 + H2O+CO2 = 2 NaHCO3↓
【详解】(1)实验I中同时对Na2CO3和NaHCO3固体进行加热,试管A中无明显现象,试管B中澄清石灰水变浑浊,说明NaHCO3固体不稳定,受热发生分解反应,该反应的化学方程式为:2NaHCO3 Na2CO3 + CO2 ↑ + H2O。
(2)实验II,方框内装置的目的是除去CO2中的HCl气体,因此用饱和NaHCO3溶液。
(3)实验II 中NaHCO3和盐酸反应生成氯化钠、二氧化碳和水,该反应的离子方程式为:HCO+H+=H2O+CO2 ↑;CO2与饱和Na2CO3溶液发生反应Na2CO3 + H2O+CO2 = 2 NaHCO3↓,由于NaHCO3固体的溶解度小于Na2CO3,且饱和溶液中溶剂的量减少,生成了更多的NaHCO3,因此会析出晶体。
12.(23-24高一上·内蒙古呼和浩特·期中)某食品膨松剂中发挥作用的物质为,某兴趣小组研究加热情况下该膨松剂放出气体的量,设计实验的装置图如下。
已知:碱石灰是固体氢氧化钠和氧化钙的混合物:
回答下列问题:
(1)A装置中NaOH溶液的作用是除去空气中的 ,C装置内所盛试剂是 ,E装置的作用是 ,若没有E装置,测定的结果 (填“偏高”、“偏低”或“无影响”)。
(2)充分加热后,测得D的质量增加6.6g,若装置B换为装置F进行实验(膨松剂质量相同)。不考虑导致误差因素,则测得D的质量增加 。
(3)分解产物是重要化工原料,研究其性质:分别取少量溶液,
①与碱反应:滴加澄清石灰水,现象为 。
②与盐反应:滴加X溶液,产生白色沉淀,则X可能为 (写其中一种的名称)。
③与酸反应:滴加盐酸,开始没有气泡,反应产生两种盐,推测两种盐的化学式 。
【答案】(1) 浓硫酸 吸收空气中的、,防止对实验结果造成干扰 偏高
(2)13.2g
(3) 溶液变浑浊 氯化钙或氯化钡等 、NaCl
【分析】该实验通过称量D反应前后的质量测定生成二氧化碳的质量,从而计算碳酸氢钠的质量;A除空气中的二氧化碳,B加热碳酸氢钠发生反应,C干燥生成的二氧化碳,D吸收反应生成得二氧化碳,E吸收空气中的、,防止对实验结果造成干扰。
【详解】(1)氢氧化钠能吸收二氧化碳,A装置中NaOH溶液的作用是除去空气中的;该实验通过称量D反应前后的质量计算二氧化碳的质量,所以只能让D吸收碳酸氢钠分解生成得二氧化碳,所以需要除去二氧化碳中的水蒸气,所以C装置内所盛试剂是浓硫酸;E装置的作用是吸收空气中的、,防止对实验结果造成干扰;若没有E装置,D吸收空气中的、,使质量差偏大,测定的结果偏高。
(2)充分加热后,测得D的质量增加6.6g,说明反应放出二氧化碳的质量为6.6g,则碳酸氢钠的质量为25.2g,若装置B换为装置F进行实验,发生反应2NaHCO3+H2SO4=Na2SO4+2CO2↑+2H2O,25.2g碳酸氢钠放出13.2g二氧化碳,则测得D的质量增加13.2g。
(3)①取少量溶液滴加澄清石灰水生成碳酸钙沉淀和氢氧化钠,现象为溶液变浑浊。
②能与氯化钙、氯化钡等反应生成碳酸钙、碳酸钡沉淀,所以滴加X溶液,产生白色沉淀,则X可能为氯化钙或氯化钡等。
③取少量溶液滴加盐酸,开始没有气泡,反应产生两种盐,则两种盐的化学式、NaCl。
[模块导航]
模块一 知识网络构建
模块二 基础知识梳理
模块三 核心考点剖析(9个典例)
模块四 基础过关练(10题)
模块五 能力提升练(12题)
[学习目标]
1.通过实验探究,结合盐的通性认识碳酸钠和碳酸氢钠的化学性质。
2.掌握碳酸钠和碳酸氢钠鉴别与转化的途径。
3.了解碳酸钠与碳酸氢钠在生产、生活中的应用及与性质的关系。
4.能解释焰色试验的现象和原理。
实验操作
Na2CO3
NaHCO3
(1)观察外观并进行描述
白色粉末
细小的白色晶体
(2)向以上两支试管中分别滴入几滴水,振荡,观察现象;将温度计分别插入其中,温度计的示数有何变化
粉末结块变成晶体;放热,温度计的示数明显升高
晶体部分溶解;吸热,温度计的示数降低
(3)继续向(2)的试管中分别加入5 mL水,用力振荡,有何现象
完全溶解
部分溶解
(4)分别向(3)所得的溶液中滴入1~2滴酚酞溶液,有何现象
溶液变红色
溶液变微红色
实验结论
碳酸钠、碳酸氢钠均易溶于水,水溶液均显碱性,但Na2CO3溶解度更大,碱性更强
实验操作
实验现象
实验结论
澄清石灰水不变浑浊
Na2CO3很 稳定 ,受热不易分解
澄清石灰水变浑浊
NaHCO3不稳定,受热 容易 分解;
化学方程式:
2NaHCO3Na2CO3+H2O+CO2↑
选项
操作
判断
A
分别加入澄清石灰水
产生沉淀者为
B
分别加入等浓度的稀盐酸
反应较剧烈者为
C
分别加入溶液
产生沉淀者为
D
逐滴加入等浓度的盐酸
立即产生气泡者为
A.除去中的HCl
B.制取
C.分离
D.制取
选项
操作
判断
A
分别加入澄清石灰水
产生沉淀者为溶液
B
分别加入等浓度的稀盐酸
反应较剧烈者为溶液
C
分别滴加几滴酚酞
溶液红色更深
D
逐滴加入等浓度的盐酸
立即产生气泡者为溶液
实验I
实验II
人教版 (2019)必修 第一册第一节 钠及其化合物巩固练习: 这是一份人教版 (2019)必修 第一册<a href="/hx/tb_c161979_t7/?tag_id=28" target="_blank">第一节 钠及其化合物巩固练习</a>,共4页。
高中化学第一节 钠及其化合物课时训练: 这是一份高中化学第一节 钠及其化合物课时训练,共11页。
人教版 (2019)必修 第一册实验活动3 同周期、同主族元素性质的递变当堂达标检测题: 这是一份人教版 (2019)必修 第一册实验活动3 同周期、同主族元素性质的递变当堂达标检测题,共5页。












