





2025届高考化学一轮总复习第11章化学综合实验第56讲性质原理探究型综合实验课件
展开1.能根据物质性质、反应原理选取实验装置、进行实验验证等。2.能根据实验现象进行分析和推理,得出合理的结论。
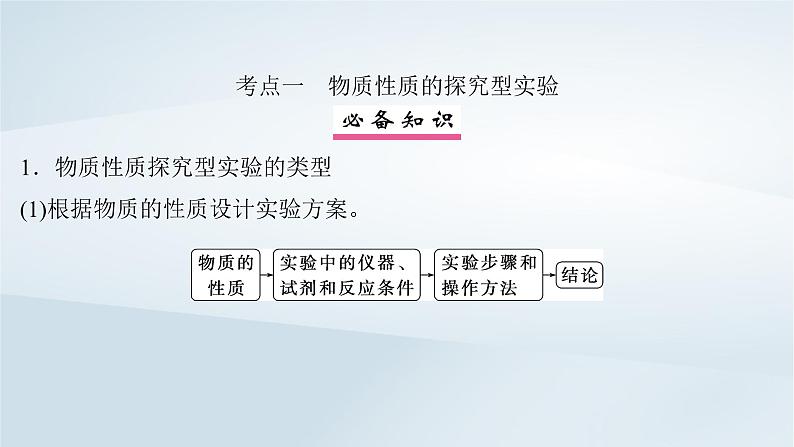
考点一 物质性质的探究型实验 1.物质性质探究型实验的类型(1)根据物质的性质设计实验方案。
(2)根据物质的结构(或官能团)设计实验方案。
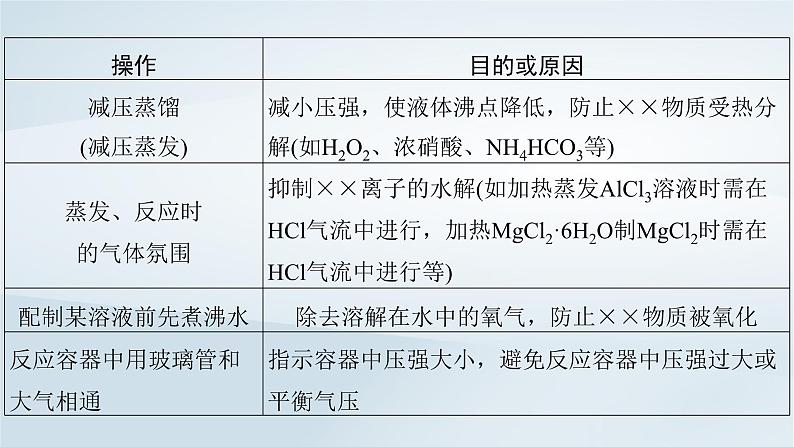
2.探究实验中常见操作及其目的或原因
1.FeCl3易潮解,加热易升华,常用于金属蚀刻、污水处理、印染工业。某化学研究性学习小组模拟工业生产制备氯化铁并对产物进行探究(部分夹持装置省略)的装置如下图所示。
(1)盛放MnO2的仪器名称为_________________________________。(2)装置A中制取氯气的离子方程式为_________________________。(3)若缺少装置E,对本实验造成的影响是____________________________。(4)将铁粉分散到石棉绒中的优点是____________________________。当硬质玻璃管中__________________________时,开始点燃D处酒精灯。
(5)实验结束并冷却后,将收集器中的固体物质转移至锥形瓶中,进行如下实验: 查阅资料可知:SCN-能被氧化剂氧化。该小组对红色褪去的原因进行如下探究。假设1:O2将SCN-氧化;假设2:H2O2将SCN-氧化。
通过设计如下实验得出假设2成立,请在下表空格中填写现象:
2.(2024·江门联考)NaHSO3是常见的亚硫酸盐,在潮湿的空气中易被氧化,在工业生产和实验室都有着广泛的应用。为探究NaHSO3溶液的性质,甲同学配制了100 mL 0.1 ml·L-1 NaHSO3溶液。(1)配制溶液需用到的玻璃仪器有玻璃棒、量筒、烧杯、__________、__________。解析:配制一定物质的量浓度的溶液,所需步骤有计算、称量、溶解(冷却)、转移、洗涤、定容、摇匀、装瓶贴签,配制100 mL 0.1 ml·L-1 NaHSO3溶液需用到的玻璃仪器有玻璃棒、量筒、烧杯、胶头滴管、100 mL容量瓶。
答案:胶头滴管 100 mL容量瓶
答案:①在白瓷板或玻璃片上放一小块pH试纸,用玻璃棒蘸取0.1 ml·L-1 NaHSO3溶液,点在pH试纸中部,待其变色后,与标准比色卡对照,读出pH ②>
(3)将0.1 ml·L-1 NaHSO3溶液与0.1 ml·L-1 Ba(OH)2溶液等体积混合,产生白色沉淀,写出等物质的量的NaHSO3与Ba(OH)2在溶液中发生反应的离子方程式:______________________________________________________。探究白色沉淀的成分:提出猜想:a.只有BaSO3;b.只有BaSO4;c.____________。验证猜想:乙同学认为猜想b不正确,原因为_________________________。将白色沉淀加入足量盐酸中,若有气泡生成,且沉淀全部溶解,则证明猜想a正确;若_________________________________,则证明猜想c正确。
(4)将0.1 ml·L-1 NaHSO3溶液和Na2S溶液混合,再滴入适量稀硫酸,有淡黄色浑浊物出现。写出该反应的离子方程式:_____________________。该现象说明NaHSO3溶液具有____________(填“氧化性”“还原性”或“氧化性和还原性”)。
考点二 反应产物、反应机理的探究型实验 1.确定产物问题的思路分析由性质确定反应产物是解此类题目的根本思路,而题目中所涉及的物质,一般分为两类,见下表:
2.探究反应机理实验的解题流程
3.文字表述题的各种答题规范(1)实验操作的原因、目的及作用的答题要素。
(2)实验现象的准确、全面描述。
(3)试剂作用的答题模板。
1.(2024·广州第65中学开学考试)某实验小组进行金属的电化学腐蚀实验探究。(1)回答下列问题。
①请解释铜丝区域溶液变红的原因是____________________(用电极反应式并结合文字解释)。②写出生成蓝色沉淀的离子方程式: ___________________________。
解析:铁与铜丝连接,在氯化钠溶液中形成原电池装置,其中铜为正极,电极反应为O2+2H2O+4e-===4OH-,反应生成OH-,使铜丝附近溶液显碱性,遇酚酞变红色;铁为负极,失电子生成Fe2+,Fe2+与K3[Fe(CN)6]反应生成KFe[Fe(CN)6] 蓝色沉淀。答案:①铜丝发生电极反应:O2+2H2O+4e-===4OH-,反应生成OH-,使铜丝附近溶液显碱性,遇酚酞变红色②Fe2++[Fe(CN)6]3-+K+===KFe[Fe(CN)6]↓
根据实验二的现象,推测K3[Fe(CN)6]可能具有___________(填“氧化性”或“还原性”)。
解析:加入0.1 ml·L-1 K3[Fe(CN)6]溶液后溶液变蓝,可知KI被氧化生成碘单质,故K3[Fe(CN)6]具有氧化性。答案:氧化性
(3)依据实验二的现象,甲同学认为实验一不一定能说明Fe发生了电化学腐蚀,设计如下实验证明其结论。
根据实验现象推出实验三的结论:在NaCl溶液中,________________________________________________________________________________________________________________________________。解析:由实验三现象可知,未加氯化钠时,没有明显现象,加入氯化钠后铁片与K3[Fe(CN)6]发生氧化还原反应生成Fe2+,Fe2+与K3[Fe(CN)6]反应生成KFe[Fe(CN)6]蓝色沉淀。答案:K3[Fe(CN)6]可将Fe氧化为Fe2+
(4)结合实验一~实验三,乙同学设计如下装置进行实验四,证明金属可以发生电化学腐蚀,当电极X为Fe时,实验四的两个实验方案均可以证明Fe发生电化学腐蚀。①补全实验方案ⅱ中的空格部分。
②思考:若电极X为Mg时,电流表读数为1.5I,推测电极X为Zn时电流表读数的范围是____________。解析:①验证产物是否有Fe2+,应取少量反应后烧杯中溶液于试管中,滴加0.1 ml·L-1K3[Fe(CN)6]溶液,观察是否生成KFe[Fe(CN)6]蓝色沉淀。②该装置中铁为负极时电流表读数为I,换成比铁活泼的镁时电流表读数增大到1.5I,故电流表读数随金属的活泼性增强而增大,Zn的活泼性介于Fe和Mg之间,故Zn为负极时电流表读数应介于I和1.5I之间。答案:①少量烧杯中溶液 0.1 ml·L-1 K3[Fe(CN)6]②I~1.5I
2.(2021·新高考北京卷)某小组探究卤素参与的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。(1)浓盐酸与MnO2混合加热生成氯气。氯气不再逸出时,固液混合物A中仍存在盐酸和MnO2。①反应的离子方程式是___________________________________________。②电极反应式:i.还原反应:MnO2+2e-+4H+===Mn2++2H2O;ii.氧化反应:_______________________________________________。
③根据电极反应式,分析A中仍存在盐酸和MnO2的原因。i.随c(H+)降低或c(Mn2+)升高,MnO2氧化性减弱。ii.随c(Cl-)降低,____________________________________________。④补充实验证实了③中的分析。 a是________,b是________。
(2)利用c(H+)对MnO2氧化性的影响,探究卤素离子的还原性。相同浓度的KCl、KBr和KI溶液,能与MnO2反应所需的最低c(H+)由大到小的顺序是______________,从原子结构角度说明理由:_________________________。(3)根据(1)中结论推测:酸性条件下,加入某种化合物可以提高溴的氧化性,将Mn2+氧化为MnO2。经实验证实了推测,该化合物是________。(4)Ag分别与1 ml·L-1的盐酸、氢溴酸和氢碘酸混合,Ag只与氢碘酸发生置换反应,试解释原因:_____________________________________。(5)总结:物质氧化性和还原性变化的一般规律是________________________________________________________________。
1.(2023·新高考湖南卷)金属Ni对H2有强吸附作用,被广泛用于硝基或羰基等不饱和基团的催化氢化反应。将块状Ni转化成多孔型雷尼Ni后,其催化活性显著提高。已知:①雷尼Ni暴露在空气中可以自燃,在制备和使用时,需用水或有机溶剂保持其表面“湿润”;②邻硝基苯胺在极性有机溶剂中更有利于反应的进行。某实验小组制备雷尼Ni并探究其催化氢化性能的实验如下:
步骤1:雷尼Ni的制备
步骤2:邻硝基苯胺的催化氢化反应反应的原理和实验装置图如下(夹持装置和搅拌装置略)。装置Ⅰ用于储存H2和监测反应过程。
回答下列问题:(1)操作(a)中,反应的离子方程式是_________________________________。解析:结合图示流程可知,操作(a)为用NaOH溶液处理Ni/Al合金,Al和NaOH溶液反应生成Na[Al(OH)4]和H2,离子方程式为2Al+2OH-+6H2O===2[Al(OH)4]-+3H2↑。答案:2Al+2OH-+6H2O===2[Al(OH)4]-+3H2↑
(2)操作(d)中,判断雷尼Ni被水洗净的方法是__________________________。解析:水洗的上一步是碱洗,若雷尼Ni被水洗净,则最后一次水洗液中不含碱,加入酚酞溶液不变红。答案:向最后一次水洗液中加入酚酞,溶液不变红
(3)操作(e)中,下列溶剂中最有利于步骤2中氢化反应的是________。A.丙酮 B.四氯化碳C.乙醇D.正己烷解析:根据题中信息可知,雷尼Ni被广泛用于硝基或羰基等不饱和基团的催化氢化反应,故不能选丙酮,否则会发生副反应,又因为邻硝基苯胺在极性有机溶剂中更有利于反应进行,而CCl4、正己烷均为非极性分子,乙醇为极性分子,所以应选乙醇。答案:C
(4)向集气管中充入H2时,三通阀的孔路位置如下图所示;发生氢化反应时,集气管向装置Ⅱ供气,此时孔路位置需调节为________。解析:根据向集气管中通入H2时三通阀的孔路位置,可确定集气管向装置Ⅱ中供气时,应保证下侧、右侧孔路通气,故B正确。答案:B
(5)仪器M的名称是________。解析:为了排除装置中空气产生的干扰,反应前应向装置Ⅱ中通入一段时间N2。答案:恒压滴液漏斗
(6)反应前应向装置Ⅱ中通入N2一段时间,目的是_________________________________________________________________________________________________________________________________。解析:三颈瓶N中为雷尼Ni的悬浮液,若将导气管插入液面以下,雷尼Ni会堵塞导管。答案:排除空气产生的干扰
(7)如果将三颈瓶N中的导气管口插入液面以下,可能导致的后果是_____________________________________________________________。解析:氢化反应完全时,装置Ⅱ中不再消耗H2,装置Ⅰ中水准瓶的液面不再发生变化。答案:雷尼Ni堵塞导管 (8)判断氢化反应完全的现象是__________________________________。答案:水准瓶中液面不再发生变化
2.(2023·新高考广东卷)化学反应常伴随热效应。某些反应(如中和反应)的热量变化,其数值Q可通过量热装置测量反应前后体系温度变化,用公式Q=CρV总·ΔT计算获得。(1)盐酸浓度的测定:移取20.00 mL待测液,加入指示剂,用0.500 0 ml·L-1 NaOH溶液滴定至终点,消耗NaOH溶液22.00 mL。①上述滴定操作用到的仪器有__________________________________。②该盐酸浓度为________ml·L-1。
答案:①AD ②0.550 0
(2)热量的测定:取上述NaOH溶液和盐酸各50 mL进行反应,测得反应前后体系的温度值(℃)分别为T0、T1,则该过程放出的热量为____________J(C和ρ分别取4.18 J·g-1·℃-1和1.0 g·mL-1,忽略水以外各物质吸收的热量,下同)。解析:由Q=CρV总·ΔT可知,题述过程放出的热量为4.18 J·g-1·℃-1×1.0 g·mL-1×(50 mL+50 mL)×(T1-T0) ℃=418(T1-T0) J。答案:418(T1-T0)
(3)借鉴(2)的方法,甲同学测量放热反应Fe(s)+CuSO4(aq)===FeSO4(aq)+Cu(s)的焓变ΔH(忽略温度对焓变的影响,下同)。实验结果见下表。
①温度:b________c(填“>”“<”或“=”)。②ΔH=______________(选择表中一组数据计算),结果表明,该方法可行。
答案:①> ②-20.9(b-a) kJ·ml-1[或-41.8(c-a) kJ·ml-1]
(4)乙同学也借鉴(2)的方法,测量反应A:Fe(s)+Fe2(SO4)3(aq)===3FeSO4(aq)的焓变。解析:Fe3+易水解,为抑制Fe3+水解,在配制Fe2(SO4)3溶液时需加入酸;用pH试纸测得Fe2(SO4)3溶液的pH不大于1,说明溶液呈强酸性,向少量Fe2(SO4)3溶液中加入Fe粉,溶液颜色变浅的同时有气泡产生,说明溶液中还存在Fe与酸的反应,离子方程式为Fe+2H+===Fe2++H2↑;乙同学根据相关原理,重新设计优化的实验方案的重点在于如何防止Fe与酸反应产生的影响,可以借助盖斯定律,设计分步反应来实现Fe2(SO4)3溶液与Fe的反应,故可将一定量的Cu粉加入一定浓度的Fe2(SO4)3溶液中反应,测量反应热,计算得到反应Cu(s)+Fe2(SO4)3(aq)===CuSO4(aq)+2FeSO4(aq)的焓变ΔH1;根据(3)中实验计算得到反应Fe(s)+CuSO4(aq)===Cu(s)+FeSO4(aq)的焓变ΔH2;根据盖斯定律计算得到反应Fe(s)+Fe2(SO4)3(aq)===3FeSO4(aq)的焓变为ΔH1+ΔH2。
答案:抑制Fe3+水解 Fe+2H+===Fe2++H2↑ 将一定量的Cu粉加入一定浓度的Fe2(SO4)3溶液中反应,测量反应热,计算得到反应Cu(s)+Fe2(SO4)3(aq)===CuSO4(aq)+2FeSO4(aq)的焓变ΔH1;根据(3)中实验计算得到反应Fe(s)+CuSO4(aq)===Cu(s)+FeSO4(aq)的焓变ΔH2;根据盖斯定律计算得到反应Fe(s)+Fe2(SO4)3(aq)===3FeSO4(aq)的焓变为ΔH1+ΔH2
[查阅资料] 配制Fe2(SO4)3溶液时需加入酸。加酸的目的是_______________________________________________________。[提出猜想] Fe粉与Fe2(SO4)3溶液混合,在反应A进行的过程中,可能存在Fe粉和酸的反应。[验证猜想] 用pH试纸测得Fe2(SO4)3溶液的pH不大于1;向少量Fe2(SO4)3溶液中加入Fe粉,溶液颜色变浅的同时有气泡冒出,说明存在反应A和____________________________(用离子方程式表示)。[实验小结] 猜想成立,不能直接测反应A的焓变。
新教材(广西专版)高考化学一轮复习第10章化学实验基础与综合实验探究第3讲高考化学综合实验题探究课件: 这是一份新教材(广西专版)高考化学一轮复习第10章化学实验基础与综合实验探究第3讲高考化学综合实验题探究课件,共60页。PPT课件主要包含了内容索引,强基础增分策略,增素能精准突破,研专项前沿命题,明考向真题演练,课程标准,气体的收集,④装置和试剂的作用,③注意事项,考向1气体的制备等内容,欢迎下载使用。
2025版高考化学一轮总复习第10章化学实验基础和综合探究第38讲物质的制备与性质综合实验探究课件: 这是一份2025版高考化学一轮总复习第10章化学实验基础和综合探究第38讲物质的制备与性质综合实验探究课件,共60页。PPT课件主要包含了先灭灯再停氢,冷凝回流,NH3,略低于,陶土网,碎瓷片或沸石,CO2,NO2,块状固体,插入液面以下等内容,欢迎下载使用。
备战2025届新高考化学一轮总复习第10章化学实验基础和综合探究第59讲物质含量测定和性质探究综合实验课件: 这是一份备战2025届新高考化学一轮总复习第10章化学实验基础和综合探究第59讲物质含量测定和性质探究综合实验课件,共60页。PPT课件主要包含了课标指引,目录索引,素养发展进阶,必备知识•梳理,关键能力•提升,分液漏斗,5×10-5,棕色细口瓶,溶液变蓝,溶液蓝色褪去等内容,欢迎下载使用。












