




新教材(广西专版)高考化学一轮复习第5章物质结构与性质 元素周期律第3讲化学键课件
展开1.认识构成物质的微粒之间存在相互作用,结合典型实例认识离子键和共价键的形成,建立化学键概念。认识化学键的断裂和形成是化学反应中物质变化的实质及能量变化的主要原因。2.认识离子键、共价键的本质。结合常见的离子化合物和共价分子的实例,认识物质的构成微粒、微粒间相互作用与物质性质的关系。3.知道配位键的特点,认识简单的配位化合物的成键特征,了解配位化合物的存在与应用。4.认识原子间通过原子轨道重叠形成共价键,了解共价键具有饱和性和方向性。5.知道根据原子轨道的重叠方式,共价键可分为σ键和π键等类型;知道共价键可分为极性共价键和非极性共价键。
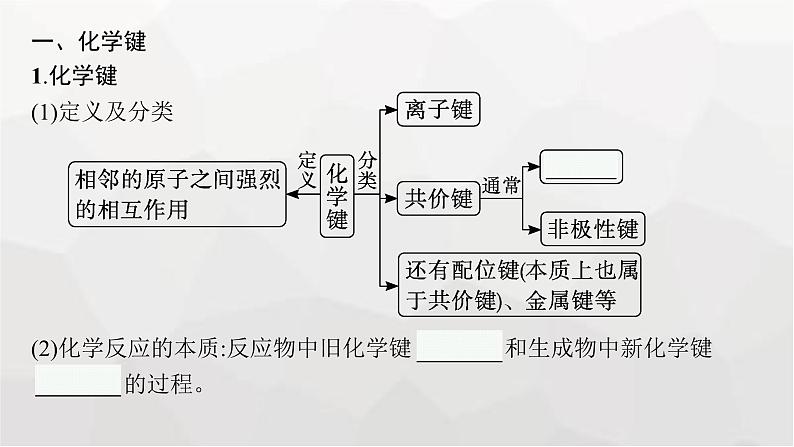
一、化学键1.化学键(1)定义及分类(2)化学反应的本质:反应物中旧化学键 断裂 和生成物中新化学键 形成 的过程。
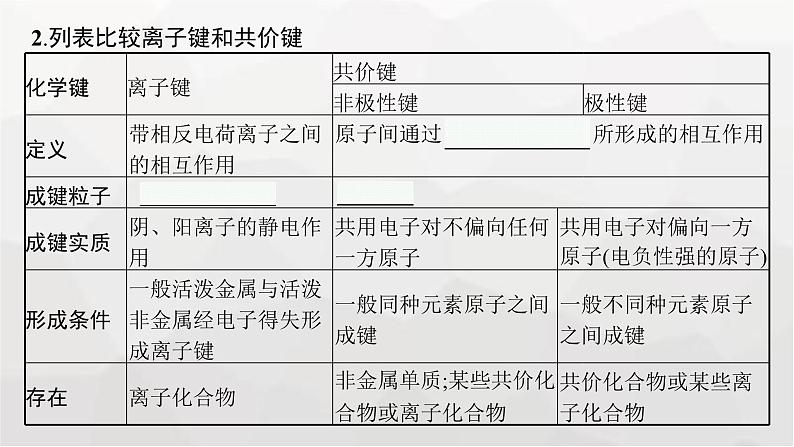
2.列表比较离子键和共价键
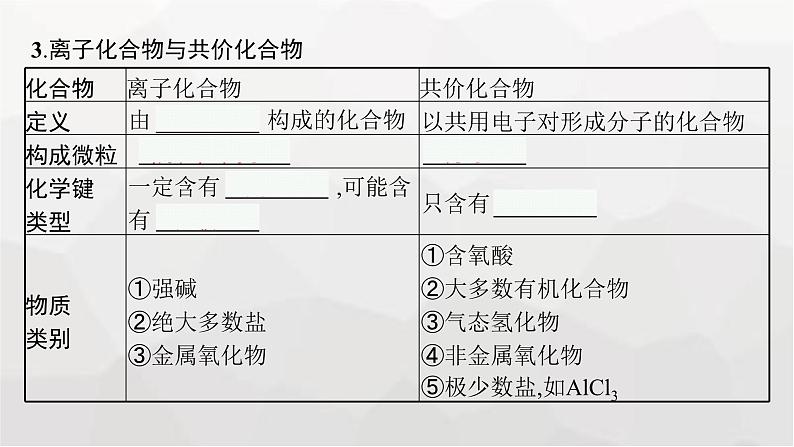
3.离子化合物与共价化合物
4.电子式及其书写(1)定义:在元素符号周围用“·”或“×”来表示原子的 最外层 电子(价层电子)的式子。
(3)用电子式表示化合物的形成过程
应用提升 离子键和共价键易错警示(1)由活泼金属与活泼非金属形成的化学键不一定都是离子键,如AlCl3中Al—Cl为共价键。(2)非金属元素的两个原子之间的化学键一般是共价键,但多个原子间也可能形成离子键,如NH4Cl等。(3)离子键和共价键之间没有明显的界线,一般可根据成键原子对应元素的电负性来判断。
易错辨析 判断正误:正确的画“√”,错误的画“×”。(1)Na与O元素形成的化合物中只含有离子键。( × )(2)氢元素与其他元素可形成共价化合物,也可形成离子化合物。( √ )(3)离子化合物中可能含共价键,共价化合物中可能含离子键。( × )
二、共价键和键参数1.共价键的本质和特征(1)共价键的本质是原子之间形成 共用电子对 (即原子轨道重叠后,高概率地出现在两个原子核之间的电子与两个原子核之间的电性作用)。 (2)共价键的一般特征是具有 饱和性 和方向性。 氢气中s-s σ键不具有方向性
深化拓展大π键及其判断(1)概念在一个具有平面结构的多原子分子中,如果彼此相邻的3个或多个原子中有垂直于分子平面的、对称性一致的、未参与杂化的原子轨道,那么这些轨道可以相互重叠,形成多中心π键。这种不局限在两个原子之间的π键称为离域π键,或共轭大π键,简称大π键。(2)形成条件这些原子多数处于同一平面上,且具有相互平行的p轨道,p轨道上的电子总数小于p轨道数的2倍。
(3)表示符号 ,m表示相互平行的p轨道的数目,n表示相互平行的p轨道上的电子数。理论计算证明n<2m时可形成大π键,解题时可作为验证大π键书写正误的方法。(4)大π键中电子数的计算①计算步骤确定分子中价电子总数→找出分子中的σ键以及不与大π键p轨道平行的孤电子对的轨道→用价电子总数减去这些σ键中的电子数和孤电子对中的电子数,剩余的就是填入大π键的电子数。
②实例SO2分子中的大π键:中心原子S的价层电子对数为 ,为sp2杂化,有1个孤电子对,硫原子有1个垂直于分子平面的p轨道;SO2的价电子总数为18,每个氧原子有2个容纳孤电子对的轨道不与形成大π键的p轨道平行,则大π键中电子数为18-2×2-2-2×2×2=4,故SO2分子中的大π键表示为 。CO2分子中的大π键:CO2为直线形分子,中心原子C为sp杂化,无孤电子对,另外2个未参与杂化的p轨道与sp杂化轨道相互垂直,因而CO2分子有两套相互平行的p轨道;CO2的价电子总数为16,每个氧原子有1个容纳孤电子对的轨道不与形成大π键的p轨道平行,则大π键中电子数为16-2×2-2×2=8,则每套平行p轨道里有4个电子,故CO2分子中的大π键表示为 。
3.键参数—键能、键长与键角(1)定义
(2)键参数对分子结构和性质的影响
微点拨一般情况下,构成共价键的原子半径越小,键长越短,共价键的键能越大,分子越稳定。
易错辨析 判断正误:正确的画“√”,错误的画“×”。(1)s轨道只能形成σ键,p轨道可形成σ键或π键。( √ )(2)两个原子的轨道重叠形成共价键时,可以只形成σ键或π键。( × )(3)氰化氢(H—C≡N)中σ键和π键的个数之比为1∶1。( √ )(4)硅原子间难形成双键而碳原子间可以,是因为Si的原子半径大于C的,硅原子间难形成p-pπ键。( √ )
三、配位键和配位化合物 超分子1.配位键(1)定义:成键原子一方提供 孤电子对 ,另一方提供空轨道形成共价键,这类“电子对给予—接受”键称为配位键。 (2)表示:配位键也是一种共价键,例如, 可表示为 ,在 中,有1个N—H形成过程与其他3个N—H形成过程不同,但是一旦形成之后,4个共价键就完全相同。
2.配位化合物(1)定义:通常把金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体或配位体)以配位键结合形成的化合物称为配位化合物,简称配合物。
3.超分子 广义的分子,包括离子(1)定义:超分子是由两种或两种以上的 分子 通过 分子间 相互作用形成的分子聚集体。 (2)重要特征:① 分子识别 ;②自组装。
易错辨析 判断正误:正确的画“√”,错误的画“×”。(1) 中的配位键是由N提供空轨道,H+提供孤电子对形成。( × )(2)配合物中都含配位键,含有配位键的化合物都是配合物。( × )(3)配合物[TiCl(H2O)5]Cl2·H2O中配体是Cl-和H2O,Ti3+的配位数为6。( √ )(4)CuSO4溶液加入足量氨水生成[Cu(NH3)4](OH)2,溶液变成深蓝色,说明Cu2+与NH3形成的配位键更稳定。( √ )
考向1.共价键和离子键、极性键和非极性键的判断
典例突破下列关于化学键的说法错误的是( )A.CO和O生成具有极性共价键的CO2B. 既含极性键,又含非极性键C.只含H、N、O三种元素的化合物,可能形成含有共价键的离子化合物,也可能形成共价化合物D.含有离子键的物质不可能是单质
答案 B解析 CO2中C与O形成极性共价键; 中只含有极性键;H、N、O可以形成NH4NO3,为离子化合物,也可以形成HNO3,为共价化合物;离子键的形成必须有阴、阳离子。
针对训练1.一种由短周期主族元素组成的化合物(如图所示),具有良好的储氢性能,其中元素W、X、Y、Z的原子序数依次增大,且总和为24。下列有关叙述错误的是( )A.该化合物中,W、X、Y之间均为共价键B.Z的单质既能与水反应,也可与甲醇反应C.Y的最高化合价氧化物的水化物为强酸D.X的氟化物XF3中原子均为8电子稳定结构
答案 D解析 根据题意可知Z的原子序数是W、X、Y、Z四种元素中最大的,Z能形成+1价离子,可初步判断Z为钠元素;W的原子序数是W、X、Y、Z四种元素中最小的,W与X、Y均以一个单键结合,可初步判断W为氢元素;根据W、X、Y、Z的原子序数之和为24,可知X、Y的原子序数之和为12,结合成键特点,可判断X、Y分别是硼、氮元素。H、B、N形成的阴离子中,各原子均以共价键结合,A正确;Na单质能与H2O、CH3OH反应,B正确;N元素最高价氧化物的水化物HNO3为强酸,C正确;BF3中硼原子最外层有6个电子,D错误。
2.(2022海南卷)短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y同周期并相邻,Y是组成水的元素之一,Z在同周期主族元素中金属性最强,W原子在同周期主族元素中原子半径最小。下列判断正确的是( )A.XW3是非极性分子B.简单氢化物沸点:X>YC.Y与Z形成的化合物是离子化合物D.X、Y、Z三种元素组成的化合物水溶液呈酸性
答案 C解析 X、Y、Z、W为原子序数依次增大的短周期主族元素,X、Y同周期并相邻,且Y是组成水的元素之一,则Y为O,X为N;Z在同周期主族元素中金属性最强,则Z为Na;W原子在同周期主族元素中原子半径最小,则W为Cl。NCl3分子的空间结构为三角锥形,其正、负电荷的中心不重合,属于极性分子,A项错误;H2O和NH3均含有氢键,但H2O分子形成的氢键更多,故沸点H2O>NH3,B项错误;Y为O,Z为Na,两者形成的化合物有Na2O、Na2O2,均为离子化合物,C项正确;N、O、Na三种元素组成的化合物水溶液NaNO3呈中性、NaNO2呈碱性,D项错误。
归纳总结从物质类别角度判断化学键类型
考向2.σ键、π键和大π键的判断典例突破(1) CO2分子中存在 个σ键和 个π键。 (2) SiCl4与N-甲基咪唑( )反应可以得到M2+,其结构如图所示:H、C、N的电负性由大到小的顺序为 ,1个M2+中含有 个σ键。
答案 (1)2 2 (2)N>C>H 54解析 (1)CO2分子的结构式为O=C=O,则1个CO2分子中含2个σ键和2个π键。(2)1个 分子中含有5个C—N σ键、1个C—C σ键、6个C—H σ键,1个M2+中含有4个N-甲基咪唑结构、6个配位键,因此1个M2+中含有(5+1+6)×4+6=54个σ键。
针对训练1.(1)柠檬酸的结构简式如图所示。1 ml柠檬酸分子中碳原子与氧原子形成的σ键为 ml。 (2)NH4H2PO4中,P的 杂化轨道与O的2p轨道形成 键。
(3)(2022全国乙卷,节选)一氯乙烯(C2H3Cl)分子中,C的一个 杂化轨道与Cl的3px轨道形成C—Cl 键,并且Cl的3pz轨道与C的2pz轨道形成3中心4电子的大π键 。
(4)(2022湖南卷,节选)富马酸亚铁(FeC4H2O4)是一种补铁剂。富马酸分子的结构模型如图所示:
①富马酸分子中σ键与π键的数目比为 ; ②富马酸亚铁中各元素的电负性由大到小的顺序为 。
答案 (1)7 (2)sp3 σ (3)sp2 σ (4)①11∶3 ②O>C>H>Fe解析 (1)—COOH中C原子与其中一个O原子形成双键,并与另一个O原子形成单键,1 ml —COOH中含有2 ml C—O σ键,另外C与羟基相连的键为σ键,所以1 ml柠檬酸分子中碳原子与氧原子之间形成的σ键为7 ml。
(2)磷酸分子中P的价层电子对数为4+ (5-3×1-1×2)=4,则NH4H2PO4中的磷原子的杂化类型为sp3杂化,磷原子与氧原子形成的是单键(或σ键)。
(4)①由结构模型可知,富马酸的结构简式为HOOCCH=CHCOOH, 则分子中σ键和π键的数目比为11∶3;②金属元素的电负性小于非金属元素的电负性,则铁元素的电负性最小,非金属元素的非金属性越强,电负性越大,H、C、O的非金属性依次增强,电负性依次增大,所以富马酸亚铁中四种元素的电负性由大到小的顺序为O>C>H>Fe。
2.Na3[C(NO2)6]常用作检验K+的试剂,配体 的中心原子的杂化方式为 ,离子的空间结构为 。 大π键可用符号 表示,其中m代表参与形成大π键的原子数,n为相互平行的p轨道上的电子数,则 中大π键应表示为 。
归纳总结判断σ键和π键数目的方法(1)一般情况,单键都是σ键,双键中含1个σ键和1个π键,三键中含1个σ键和2个π键。(2)σ键的数目=单键数+双键数+三键数+配位键数(配位键为σ键)。(3)π键的数目=双键数+三键数×2。
典例突破(1) 已知有关氮、磷的单键和三键的键能(kJ·ml-1)如表:
从能量角度看,氮气以N2而白磷以P4(结构式可表示为 )形式存在的原因是 。
(2)化合物Ⅰ是一种汞解毒剂。化合物Ⅱ是一种强酸。下列说法正确的有 (填字母)。 A.在Ⅰ中C—C—C键角是180°B.在Ⅰ中存在离子键与共价键C.在Ⅱ中硫氧键的键能均相等
(3)(2023山东卷,节选)卤素可形成许多结构和性质特殊的化合物。回答下列问题。ClO2中心原子为Cl,Cl2O中心原子为O,二者均为V形结构,但ClO2中存在大π键( )。ClO2中Cl原子的轨道杂化方式为 ;O—Cl—O键角____ (填“>”“<”或“=”)Cl—O—Cl键角。比较ClO2与Cl2O中Cl—O的键长并说明原因 。
答案 (1)在原子数目相同的条件下,N2比N4具有更低的能量,而P4比P2具有更低的能量,能量越低越稳定 (2)B(3)sp2 > Cl—O键长:ClO2
针对训练1.(2023广西桂林模拟)工业上制备粗硅的反应为2C+SiO2 Si+2CO↑,若C过量,还会生成SiC,下列叙述错误的是( )A.1个CO分子内只含有1个σ键和2个π键B.键能:C—H>Si—H,因此甲硅烷没有甲烷稳定C.键长:C—Si
2.硅是重要的半导体材料,构成了现代电子工业的基础。碳和硅的有关化学键键能如表所示,简要分析和解释下列有关事实。
(1)硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是 。 (2)SiH4的稳定性小于CH4,更易生成氧化物,原因是 。
答案 (1)C—C和C—H的键能较大,所形成的烷烃稳定。而硅烷中Si—Si和Si—H的键能较小,易断裂,导致长链硅烷难以生成(2)C—H的键能大于C—O的键能,C—H比C—O稳定,而Si—H的键能却小于Si—O的键能,所以Si—H不稳定而倾向于形成稳定性更强的Si—O
归纳总结1.定性判断键长的方法(1)根据原子半径进行判断。在其他条件相同时,一般成键原子的半径越小,键长越短。(2)根据共用电子对数判断。就相同的两原子形成的共价键而言,当两个原子形成双键或者三键时,由于原子轨道的重叠程度增大,原子之间的核间距减小,键长变短,故单键键长>双键键长>三键键长。
2.共价键稳定性强弱的判断方法(1)根据原子半径和共用电子对数目判断:一般成键原子的原子半径越小,共用电子对数越多,共价键越牢固,含有该共价键的分子越稳定。(2)根据键能判断:一般共价键的键能越大,共价键越牢固,破坏共价键消耗的能量越多。(3)根据键长判断:一般共价键的键长越短,共价键越牢固,破坏共价键所消耗的能量越多。
配位键的形成及配合物的组成与性质
例题.(1)(2021全国乙卷,35节选)三价铬离子能形成多种配位化合物。[Cr(NH3)3(H2O)2Cl]2+中提供孤电子对形成配位键的原子或离子是 ,中心离子的配位数为 。 (2)NH3BH3分子中,N—B化学键称为 键,孤电子对由 提供。
(3) 含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如图所示,1 ml该配合物中通过螯合作用形成的配位键有 ml。
解析 (1)[Cr(NH3)3(H2O)2Cl]2+中心离子是Cr3+,配位体为NH3、H2O和Cl-,故中心离子的配位数为3+2+1=6;提供孤电子对形成配位键的原子或离子是N、O、Cl。(2)NH3BH3分子中,N原子提供孤电子对,B原子提供空轨道,形成配位键。(3)Cd2+配合物中, 提供2个N原子,左侧 提供2个O原子,均与Cd2+通过螯合作用形成配位键,故1 ml该配合物形成的配位键有6 ml。答案 (1)N、O、Cl 6 (2)配位 N(或氮原子) (3)6
突破方法判断配位数及配位键的稳定性(1)判断配位数:配位数就是配位体中与中心原子(或离子)成键的配位原子的总数。若是由单齿配体(1个配体提供1个配位原子)形成的配合物,中心原子(或离子)的配位数=配位体的数目。若是由双齿配体(1个配体提供2个配位原子)形成的配合物,中心原子(或离子)的配位数=配位体的数目×2。(2)判断配位键的稳定性:一般情况下,与同种金属原子(或离子)形成配位键时,配位原子的电负性越小,形成的配位键就越稳定。例如,电负性:N
针对训练1.(2023全国甲卷,节选)酞菁和钴酞菁的分子结构如图所示。
酞菁分子中所有原子共平面,其中p轨道能提供一对电子的N原子是______ (填酞菁中N原子的标号)。钴酞菁分子中,钴离子的化合价为 价,氮原子提供孤电子对与钴离子形成 键。
答案 ③ +2 配位解析 已知酞菁分子中所有原子共平面,则其分子中所有的C原子和所有的N原子均为sp2杂化,且分子中存在大π键,其中标号为①和②的N原子均有一对电子占据了一个sp2杂化轨道,其p轨道只能提供1个电子参与形成大π键,标号为③的N原子的p轨道能提供一对电子参与形成大π键;钴酞菁分子中,失去了2个H+的酞菁离子与钴离子通过配位键结合成分子,因此钴离子的化合价为+2价,氮原子提供孤电子对与钴离子形成配位键。
2.多酚氧化酶与植物的抗病性有关。螯合物[Mn(EDTB)](NO3)2·DMF是多酚氧化酶的模型配合物。其中EDTB和DMF的结构简式如图,则Mn的化合价为 ,配位原子是 。
答案 +2价 N解析 由配合物的化学式和化合价代数和为0可知,配合物中锰元素的化合价为+2价,具有空轨道的锰与EDTB中具有孤电子对的氮原子形成配位键。
3.X、Y、Z、W为原子序数依次增大的前四周期元素,基态原子中,X为元素周期表中半径最小的原子,Z原子最外层电子数为次外层电子数的三倍,W原子的价层电子排布为3d104s1,X、Y、Z、W形成的阳离子如图所示,下列说法正确的是( )A.原子半径:Z>Y>XB.气态氢化物的稳定性:Y>ZC.加热时该离子首先失去的组分是X2ZD.两种配体中的键角:X2Z>YX3
答案 C解析 X为元素周期表中半径最小的原子,则X是H;Z原子最外层电子数为次外层电子数的三倍,则Z是O元素;基态原子W的价层电子排布为3d104s1,则W是Cu元素;阳离子图示中 代表H2O分子, 代表NH3分子,因为Y的原子序数介于X(H)和Z(O)之间,且能形成3个单键,则Y是N元素。原子半径:N>O>H,A错误;元素的非金属性:N
2.(2022山东济南高三检测,节选)多酚氧化酶与植物的抗病性有关。螯合物[Mn(EDTB)](NO3)2·DMF是多酚氧化酶的模型配合物。其中EDTB和DMF的结构简式如下图,则Mn的化合价为 ,配位原子是 。
1.(2022北京卷)由键能数据大小,不能解释下列事实的是( )
A.稳定性:CH4>SiH4B.键长:C=O
答案 C解析 一般键长越短,键能越大,分子越稳定,CO2是分子晶体,熔点由分子间作用力决定,与化学键无关;金刚石、晶体硅都是共价晶体,共价晶体中键能越大,晶体的硬度越大。
2.(2022海南卷,改编)已知CH3COOH+Cl2 ClCH2COOH+HCl, ClCH2COOH的酸性比CH3COOH强。下列有关说法正确的是( )A.HCl的电子式为B.Cl—Cl键的键长比I—I键短C.CH3COOH分子中只有σ键D.ClCH2COOH的酸性比ICH2COOH弱
答案 B解析 HCl为共价化合物,其电子式为 ,A错误;原子半径:Cl
3.(2022全国甲卷,节选)2008年北京奥运会的“水立方”在2022年冬奥会上华丽转身为“冰立方”,实现了奥运场馆的再利用,其美丽的透光气囊材料由乙烯(CH2=CH2)与四氟乙烯(CF2=CF2)的共聚物(ETFE)制成。聚四氟乙烯的化学稳定性高于聚乙烯,从化学键的角度解释原因: 。
答案 C—F的键能比C—H的键能大,使得聚四氟乙烯的化学稳定性比聚乙烯的强
新教材(广西专版)高考化学一轮复习第5章物质结构与性质 元素周期律第2讲元素周期表元素周期律课件: 这是一份新教材(广西专版)高考化学一轮复习第5章物质结构与性质 元素周期律第2讲元素周期表元素周期律课件,共60页。PPT课件主要包含了内容索引,强基础增分策略,增素能精准突破,研专项前沿命题,明考向真题演练,课程标准,原子半径,电负性,答案C,归纳总结等内容,欢迎下载使用。
新教材(广西专版)高考化学一轮复习第5章物质结构与性质 元素周期律第1讲原子结构原子核外电子排布课件: 这是一份新教材(广西专版)高考化学一轮复习第5章物质结构与性质 元素周期律第1讲原子结构原子核外电子排布课件,共60页。PPT课件主要包含了内容索引,强基础增分策略,增素能精准突破,研专项前沿命题,明考向真题演练,本章体系构建,课程标准,典例突破,答案B,思路指导等内容,欢迎下载使用。
2025版高考化学一轮总复习第5章物质结构与性质元素周期律第18讲化学键分子结构与性质课件: 这是一份2025版高考化学一轮总复习第5章物质结构与性质元素周期律第18讲化学键分子结构与性质课件,共60页。PPT课件主要包含了阳离子,不同种,最外层,⑤⑥⑦⑧⑨,①②③④⑩,⑤⑥⑦⑨,②④⑩,2分类,头碰头,肩并肩等内容,欢迎下载使用。












