



新教材(广西专版)高考化学一轮复习第1章物质及其变化第4讲氧化还原反应的概念及规律课件
展开1.认识有化合价变化的反应是氧化还原反应,了解氧化还原反应的本质是电子的转移。2.知道常见的氧化剂和还原剂。3.认识元素在物质中可以具有不同价态,可通过氧化还原反应实现物质的相互转化。
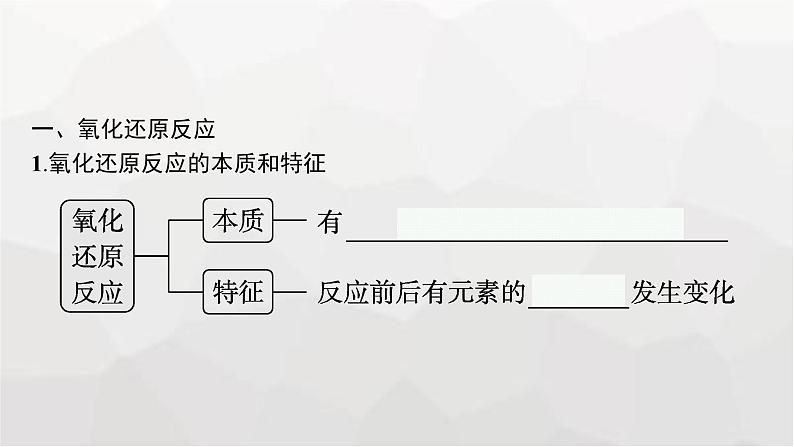
一、氧化还原反应1.氧化还原反应的本质和特征
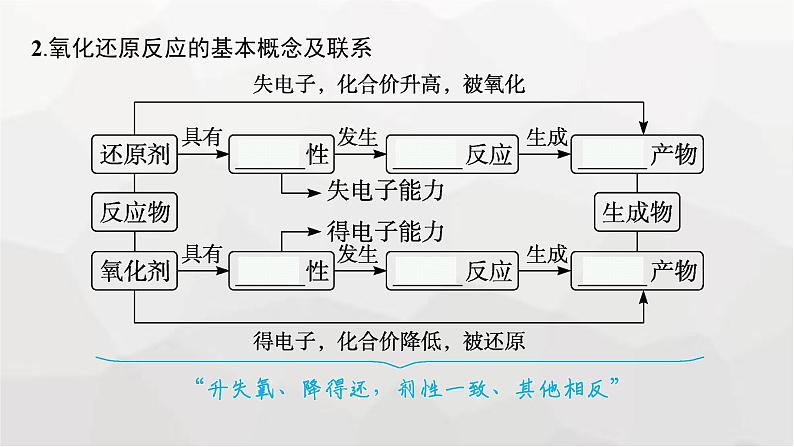
2.氧化还原反应的基本概念及联系
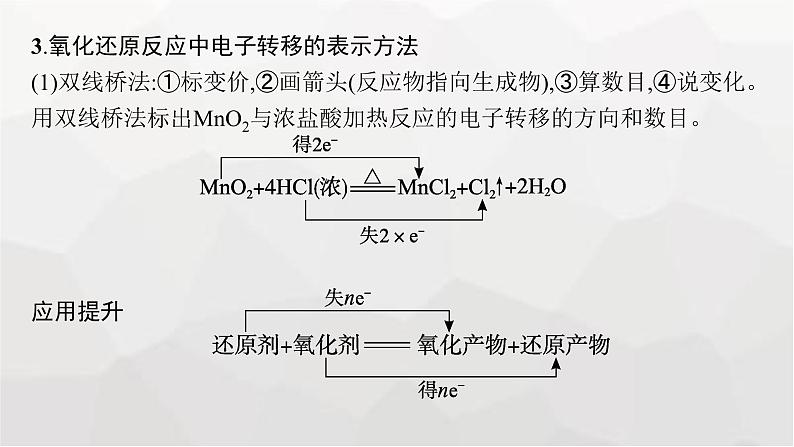
3.氧化还原反应中电子转移的表示方法(1)双线桥法:①标变价,②画箭头(反应物指向生成物),③算数目,④说变化。用双线桥法标出MnO2与浓盐酸加热反应的电子转移的方向和数目。
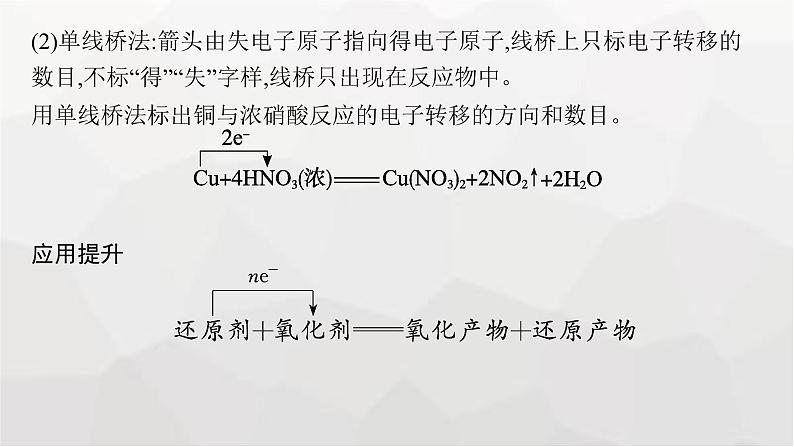
(2)单线桥法:箭头由失电子原子指向得电子原子,线桥上只标电子转移的数目,不标“得”“失”字样,线桥只出现在反应物中。用单线桥法标出铜与浓硝酸反应的电子转移的方向和数目。
4.四种基本反应类型与氧化还原反应的关系
应用提升 四种基本反应类型与氧化还原反应关系的解读(1)所有的置换反应都是氧化还原反应;所有的复分解反应都是非氧化还原反应。(2)有单质参与的化合反应是氧化还原反应;有单质生成的分解反应是氧化还原反应。(3)有单质参与或生成的反应不一定是氧化还原反应,如3O2 2O3等。
易错辨析 判断正误:正确的画“√”,错误的画“×”。(1)在氧化还原反应中,被氧化和被还原的物质不能是同种物质。( × )(2)合成氨反应中,N2作氧化剂,发生还原反应,故NH3只是还原产物。( × )(3)在Na2O2与CO2的反应中,生成1 ml O2时转移4 ml电子。( × )(4)反应SO2+H2O2 === H2SO4是氧化还原反应,也是化合反应。( √ )
二、氧化剂和还原剂1.氧化剂和还原剂(1)常见的氧化剂常见氧化剂包括某些非金属单质、含有高价态元素的化合物、过氧化物等。例如:
(2)常见的还原剂常见还原剂包括活泼的金属单质、非金属离子及低价态化合物、低价金属阳离子、非金属单质及其氢化物等。例如:
2.氧化性和还原性 (1)氧化性 氧化剂得到电子的能力(或性质)氧化剂在反应中表现出来的性质。例如,在反应Fe+H2SO4 === FeSO4+H2↑中, H2SO4 作氧化剂,表现出氧化性。 (2)还原性 还原剂失去电子的能力(或性质) 还原剂在反应中表现出来的性质。例如,在反应3Cu+8HNO3(稀) === 3Cu(NO3)2+2NO↑+4H2O中, Cu 作还原剂,表现出还原性。
(3)性质与元素价态的关系元素化合价处于中间价态的物质既有氧化性,又有还原性:
应用提升 性质与元素价态的关系解读(1)物质所含元素处于最高价,只具有氧化性;物质所含元素处于最低价,只具有还原性。(2)物质所含元素的化合价处于中间价态,既有氧化性又有还原性,但以其中一种性质为主。例如,Fe2+、 主要表现还原性,H2O2主要表现氧化性。
易错辨析 判断正误:正确的画“√”,错误的画“×”。(1)实现“Br2→Br-”的转化过程,必须加入较强的还原剂。( × )(2)反应Cl2+2NaOH === NaCl+NaClO+H2O中,Cl2既是氧化剂又是还原剂。( √ )(3)向H2O2溶液中滴加FeCl3溶液,产生大量气泡,说明Fe3+具有氧化性。( × )(4)向3 mL KI溶液中滴加几滴溴水,振荡,再滴加1 mL淀粉溶液,溶液显蓝色,则Br2的氧化性比I2的强。( √ )
典例突破实验室中利用固体KMnO4进行如图实验,下列说法错误的是( )A.G与H均为氧化产物B.实验中KMnO4只作氧化剂C.锰元素至少参与了3个氧化还原反应D.G与H的物质的量之和小于0.25 ml
解析 加热KMnO4固体的反应中,氧元素化合价由-2价升高至0价被氧化,加热K2MnO4、MnO2与浓盐酸的反应中,氯元素化合价由-1价升高至0价被氧化,因此O2和Cl2均为氧化产物,A正确;KMnO4固体受热分解过程中,锰元素化合价降低被还原,部分氧元素化合价升高被氧化,因此KMnO4既是氧化剂又是还原剂,B错误;在反应过程中含锰元素的物质及化合价的变化为 ,另外可能存在剩余的KMnO4与浓盐酸的反应,因此锰元素至少参与了3个氧化还原反应,C正确;每生成1 ml O2转移4 ml电子,每生成1 ml Cl2转移2 ml电子,若KMnO4转化为MnCl2的过程中得到的电子全部是Cl-生成Cl2所失去的电子,则气体的物质的量最大,由2KMnO4~5Cl2可知,生成气体的物质的量应为0.25 ml,但该气体中一定含有O2,因此最终所得气体的物质的量小于0.25 ml,D正确。
针对训练1.(2022浙江6月选考)关于反应Na2S2O3+H2SO4 ══ Na2SO4+S↓+SO2↑+H2O,下列说法正确的是( )A.H2SO4发生还原反应B.Na2S2O3既是氧化剂又是还原剂C.氧化产物与还原产物的物质的量之比为2∶1D.1 ml Na2S2O3发生反应,转移4 ml电子
答案 B解析 H2SO4转化为硫酸钠和水,其中所含元素的化合价均未发生变化,故没有发生还原反应,A项错误;Na2S2O3中的S的化合价为+2价,其发生歧化反应生成S(0价)和SO2(+4价),故其既是氧化剂又是还原剂,B项正确;该反应的氧化产物是SO2,还原产物为S,氧化产物与还原产物的物质的量之比为1∶1,C项错误;根据其中S元素的化合价变化情况可知,1 ml Na2S2O3发生反应,要转移2 ml电子,D项错误。
2.(2023上海崇明二模)一种新型人工固氮的原理如图所示,设NA为阿伏加德罗常数的值,下列叙述不正确的是( )A.反应①中每生成1 ml Li3N转移电子数为3NAB.反应①②③均为氧化还原反应C.反应③中O2为氧化产物D.整个过程的总反应可表示为2N2+6H2O 4NH3+3O2
答案 B解析 反应①为氮气与锂反应生成氮化锂,每生成1 ml氮化锂,转移电子数为3NA,A正确;反应②为氮化锂与水反应生成氨和氢氧化锂,属于非氧化还原反应,B错误;反应③为电解氢氧化锂生成锂、氧气和水,反应中氧元素的化合价升高被氧化,氧气是氧化产物,C正确;整个过程的总反应为氮气与水反应生成氨和氧气,反应的方程式为2N2+6H2O 4NH3+3O2,D正确。
归纳总结基于元素价态变化,理解氧化还原反应的概念及联系
典例突破(2023福建福州模拟)为探究物质的氧化性,某实验小组设计如图实验。下列说法错误的是( )
A.圆底烧瓶中发生的反应为Ca(ClO)2+4HCl(浓) === CaCl2+2Cl2↑+2H2OB.浸有NaOH溶液的棉花起吸收尾气的作用C.CCl4可用淀粉溶液替换D.试管下层出现紫红色,可证明氧化性:Cl2>Fe3+>I2
答案 D解析 漂白粉的有效成分为Ca(ClO)2,与浓盐酸反应生成氯气,化学方程式为Ca(ClO)2+4HCl(浓) === CaCl2+2Cl2↑+2H2O,A正确;浸有NaOH溶液的棉花可吸收多余氯气,起吸收尾气的作用,B正确;下层四氯化碳出现碘单质时显紫红色,淀粉溶液遇碘单质显蓝色,可用淀粉溶液替换CCl4检测碘单质,C正确;氯气溶于水生成的次氯酸也有氧化性,无法确定是什么物质氧化KI,D错误。
思路点拨实验中先制备氯气,然后利用氯气与不同物质的反应,分析氧化性的强弱。注意分析实验中试剂的作用,并注意尾气处理问题。
针对训练1.(2023湖南邵阳三模)关于下列物质的应用或分析错误的是( )A.常温下,用铁槽车运输浓硝酸利用了浓硝酸的强氧化性B.神舟十三号返回舱烧蚀材料中含有石棉,说明石棉易燃烧C.用维生素C做NaNO2中毒的急救药,利用了维生素C的强还原性D.《神农本草经》记载“石硫黄(S)能化银、铜、铁”,这句话体现了石硫黄(S)的氧化性
答案 B解析 常温下,铁在浓硝酸中钝化,用铁槽车运输浓硝酸利用了浓硝酸的强氧化性,A正确;神舟十三号返回舱烧蚀材料中含有石棉,说明石棉不易燃烧,具有阻燃性,B错误;用维生素C做NaNO2中毒的急救药,维生素C被NaNO2氧化,利用了维生素C的强还原性,C正确;《神农本草经》记载“石硫黄(S)能化银、铜、铁”,硫与金属单质生成金属硫化物,体现了石硫黄(S)的氧化性,D正确。
2.有下列四个反应:①Cl2+FeI2 === FeCl2+I2②2Fe2++Br2 === 2Fe3++2Br-③2KMnO4+16HCl(浓) === 2KCl+2MnCl2+5Cl2↑+8H2O④Cl2+2Br- === 2Cl-+Br2下列说法正确的是( )A.反应①②③④中的氧化产物依次是I2、Fe3+、MnCl2、Br2B.氧化性:KMnO4>Cl2>Br2>Fe3+>I2C.根据反应①一定可以推理得到Cl2+FeBr2 === FeCl2+Br2D.在反应③中,当有1 ml KMnO4参加反应时,有8 ml HCl被氧化
答案 B解析 反应③中锰元素由+7价降低到+2价,MnCl2是还原产物,A错误。氧化还原反应中,氧化性:氧化剂>氧化产物;根据反应①~④分别可得氧化性: Cl2>I2、Fe3+>I2、Br2>Fe3+、KMnO4>Cl2、Cl2>Br2,综合可得氧化性: KMnO4>Cl2>Br2>Fe3+>I2,B正确。根据①可得氧化性:Cl2>I2,根据②得Fe2+的还原性强于Br-,无法推理得到Cl2+FeBr2 === FeCl2+Br2,C错误。反应③中,有1 ml KMnO4参与反应,同时消耗8 ml HCl,其中只有5 ml HCl被氧化,D错误。
归纳总结基于“性质强弱规律”,巧解物质的氧化性和还原性比较的题目(1)熟记物质的性质强弱规律:①氧化性:氧化剂>氧化产物;②还原性:还原剂>还原产物。(2)巧用反应先后的两个规律:①同一还原剂与多种氧化剂反应时,氧化性强的物质优先发生反应,常见氧化剂的氧化性:KMnO4(H+)>Cl2>Br2>Fe3+>H+。②同一氧化剂与多种还原剂反应时,还原性强的物质优先发生反应,常见还原剂的还原性:S2-> >I->Fe2+>Br-。(3)利用“假设法”判断氧化还原反应能否发生。假设某反应能够发生,依据该反应判断氧化性(或还原性)的强弱,再与题干中给出的物质的氧化性(或还原性)对照,若其强弱顺序一致,则此反应能够发生,否则,不能发生。
氧化还原反应的基本规律及应用
考向1“价态转化”规律及应用例1. 关于反应K2H3IO6+9HI === 2KI+4I2+6H2O,下列说法正确的是( )A.K2H3IO6发生氧化反应B.KI是还原产物C.生成12.7 g I2时,转移0.1 ml电子D.还原剂与氧化剂的物质的量之比为7∶1
突破方法“价态转化”规律及分析(1)“价态归中”规律含有不同价态的同种元素物质间发生氧化还原反应时,该元素的价态变化一定遵循“高价+低价→中间价”,即“价态相邻能共存,价态相间能归中,归中价态不交叉,价升价降只靠拢”。例如:
(2)“价态歧化”规律同一元素发生氧化还原反应生成不同价态的物质时,该元素的价态变化一定遵循“中间价态→高价态+低价态”,不会出现“一边倒”的现象,即生成物中该元素的价态不能都比反应物中该元素价态高,或都比反应物中该元素价态低。具有多种价态的元素(如氯、硫、氮和磷元素等)均可发生“歧化反应”,例如,
针对训练1. KIO3常用作食盐中的补碘剂,可用“氯酸钾氧化法”制备,该方法的第一步反应为6I2+11KClO3+3H2O 6KH(IO3)2+5KCl+3Cl2↑。下列说法错误的是( )A.产生22.4 L(标准状况)Cl2时,反应中转移10 ml电子 B.反应中氧化剂和还原剂的物质的量之比为11∶6C.可用石灰乳吸收反应产生的Cl2制备漂白粉D.可用酸化的淀粉碘化钾溶液检验食盐中 的存在
答案 A解析 本题考查了氧化还原反应原理的分析与物质的检验、用途等知识。反应中的电子转移情况为: 。据此可知,生成1 ml Cl2时,反应中转移20 ml电子,A项错误;根据电子转移情况,可判断反应中碘单质作还原剂,氯酸钾作氧化剂,故氧化剂与还原剂的物质的量之比是11∶6,B项正确;工业上常将氯气通入石灰乳中制得漂白粉,C项正确;酸化的碘化钾溶液可与食盐中的碘酸根发生归中反应生成碘单质( +5I-+6H+ === 3I2+3H2O),淀粉遇碘单质变蓝,D项正确。
2.关于反应4O2F2+H2S === SF6+2HF+4O2,下列说法正确的是( )A.O2F2在该反应中同时发生氧化反应和还原反应B.O2是氧化产物C.氧化剂与还原剂的物质的量之比为4∶1D.若2.24 L H2S被氧化,则转移0.8 ml电子
答案 C解析 O2F2中氧元素:+1价→0价,氟元素未变价,则O2F2在该反应中只发生还原反应,A错误;氧元素化合价降低,发生还原反应,则O2是还原产物,B错误;硫元素化合价由-2价升高到+6价,H2S是还原剂,故氧化剂与还原剂的物质的量之比为4∶1,C正确;1 ml H2S被氧化,转移8 ml电子,题目未指明2.24 L H2S是否处于标准状况,不能确定转移电子的物质的量,D错误。
考向2“反应先后”规律及应用例2. 已知氧化性:Cl2>Br2>Fe3+>I2。向FeBr2、FeI2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示。下列有关说法不正确的是( )
A.曲线d代表溶液中Br-变化情况B.原溶液中FeI2的物质的量为2 mlC.原溶液中n(Fe2+)∶n(Br-)=2∶3D.当通入2 ml Cl2时,溶液中离子反应为2I-+2Fe2++2Cl2 === I2+2Fe3++4Cl-
突破方法“反应先后”规律及应用当一种氧化剂与多种还原剂(或一种还原剂与多种氧化剂)反应时,要考虑还原剂的还原性(或氧化剂的氧化性)强弱,判断物质发生反应的先后顺序。(1)一种还原剂与多种氧化剂的反应在浓度相差不大的溶液中,若同时含有多种氧化剂,加入还原剂时,将按照物质的氧化性由强到弱的顺序依次发生反应。例如,向CuCl2、FeCl3的混合溶液中加入铁粉,由于氧化性:Fe3+>Cu2+,Fe先与Fe3+反应生成Fe2+,剩余铁粉再与Cu2+发生置换反应。
(2)一种氧化剂与多种还原剂的反应在浓度相差不大的溶液中,若同时含有多种还原剂,加入氧化剂时,将按照物质的还原性由强到弱的顺序依次发生反应。例如,在FeBr2和FeI2混合液中通入Cl2时,由于还原性:I->Fe2+>Br-,故被Cl2氧化的先后顺序为I-、Fe2+、Br-。
针对训练3.在硫酸铁溶液中,加入少量铜粉至完全溶解后,又加入一定量铁粉,充分反应后有残余固体,则下列判断正确的是( )A.最后得到的溶液中只含Cu2+B.残余固体一定全部是铜C.残余固体可能为铁、铜的混合物D.最后得到的溶液中含有Fe3+
答案 C解析 根据题意分析可知,发生的反应有:Cu+2Fe3+ === Cu2++2Fe2+,Fe+2Fe3+ === 3Fe2+,Fe+Cu2+ === Fe2++Cu。由于氧化性:Fe3+>Cu2+,铁粉先与Fe3+反应,再与Cu2+反应,经分析存在几种情况:①加入铁粉过量,剩余固体为铁、铜,溶液为FeSO4溶液;②加入铁粉少量,剩余固体为铜,溶液为FeSO4和CuSO4的混合溶液;③加入铁粉恰好与溶液中的Fe3+与Cu2+反应,剩余固体为铜,溶液为FeSO4溶液。
4.写出下列反应的离子方程式。(1)向FeBr2溶液通入少量Cl2: 。 (2)向FeBr2溶液通入过量Cl2: 。 (3)向FeBr2溶液通入等物质的量的Cl2: 。(4)向FeI2溶液通入少量Cl2: 。
Cl2+2Fe2+ === 2Fe3++2Cl-
2Fe2++4Br-+3Cl2 === 2Fe3++2Br2+6Cl-
2Fe2++2Br-+2Cl2 === 2Fe3++Br2+4Cl-
1.(2023全国乙卷)下列应用中涉及氧化还原反应的是( )A.使用明矾对水进行净化B.雪天道路上撒盐融雪C.暖贴中的铁粉遇空气放热D.荧光指示牌被照发光
答案 C解析 明矾净水是由于Al3+水解产生的Al(OH)3胶体具有吸附性,与氧化还原反应无关,A错误;雪天道路撒盐可降低雪的熔点,促进雪融化,与氧化还原反应无关,B错误;暖贴利用了原电池原理,涉及氧化还原反应,C正确;荧光指示牌利用了光的反射原理,与氧化还原反应无关,D错误。
2.(2023浙江卷)化学烫发巧妙利用了头发中蛋白质发生化学反应实现对头发的“定型”,其变化过程示意图如下。下列说法不正确的是( )
A.药剂A具有还原性B.①→②过程若有2 ml S—S断裂,则转移4 ml电子C.②→③过程若药剂B是H2O2,其还原产物为O2D.化学烫发通过改变头发中某些蛋白质中S—S位置来实现头发的定型
答案 C解析 在药剂A的作用下,①→②过程S—S断裂,S—H形成,①中增加了氢原子变为②,①是氧化剂,具有氧化性,药剂A是还原剂,具有还原性,A正确;①→②过程S的化合价由-1价变为-2价,若有2 ml S—S断裂,则转移4 ml电子,B正确;②→③过程S—H断裂,S—S形成,②中S的化合价由-2价变为-1价,②是还原剂,若药剂B是H2O2,则B是氧化剂,氧元素的化合价应降低,其还原产物为H2O,C错误;通过①→②过程和②→③过程,某些蛋白质中S—S位置发生了改变,因此化学烫发可通过改变头发中某些蛋白质中S—S位置来实现头发的定型,D正确。
新教材(广西专版)高考化学一轮复习第1章物质及其变化第2讲离子反应离子方程式课件: 这是一份新教材(广西专版)高考化学一轮复习第1章物质及其变化第2讲离子反应离子方程式课件,共60页。PPT课件主要包含了内容索引,强基础增分策略,增素能精准突破,研专项前沿命题,明考向真题演练,课程标准,3发生条件,针对训练,答案A,思路指导等内容,欢迎下载使用。
新教材(广西专版)高考化学一轮复习第1章物质及其变化第1讲物质的分类及转化课件: 这是一份新教材(广西专版)高考化学一轮复习第1章物质及其变化第1讲物质的分类及转化课件,共60页。PPT课件主要包含了内容索引,强基础增分策略,增素能精准突破,研专项前沿命题,明考向真题演练,本章体系构建,课程标准,针对训练,化学与传统文化,思路指导等内容,欢迎下载使用。
2025版高考化学一轮总复习第1章化学物质及其变化第4讲氧化还原反应的概念和规律课件: 这是一份2025版高考化学一轮总复习第1章化学物质及其变化第4讲氧化还原反应的概念和规律课件,共60页。PPT课件主要包含了MnO2,HCl,Cl2,mol,还原性,失电子,得电子,O2F2,H2S,SF6等内容,欢迎下载使用。












