



还剩16页未读,
继续阅读
成套系列资料,整套一键下载
【同步课件】4.1.3 原子结构与元素的性质高一化学同步备课(人教版2019必修第一册)
展开
这是一份第四章第一节 第三课时 原子结构与元素的性质(同步课件)-2024-2025学年高一化学同步备课(人教版2019必修第一册),共24页。
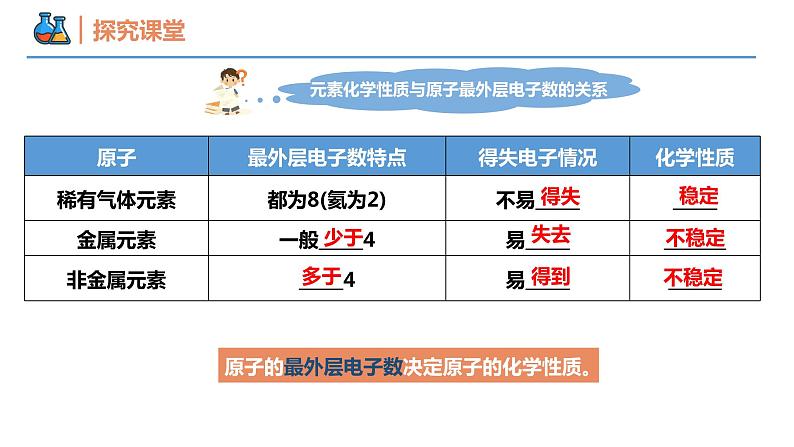
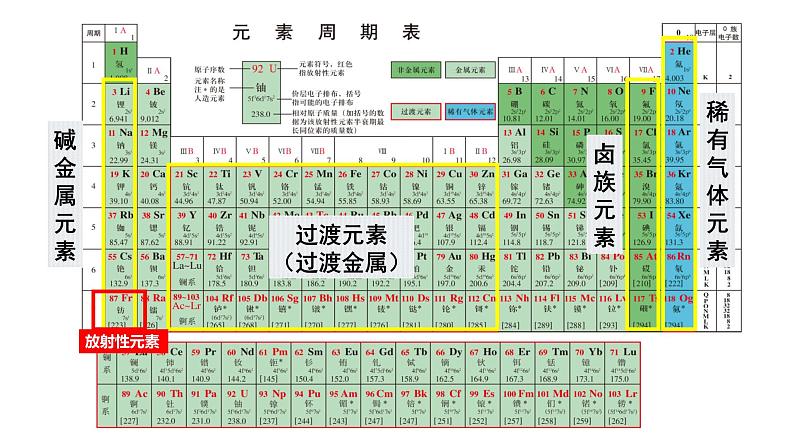
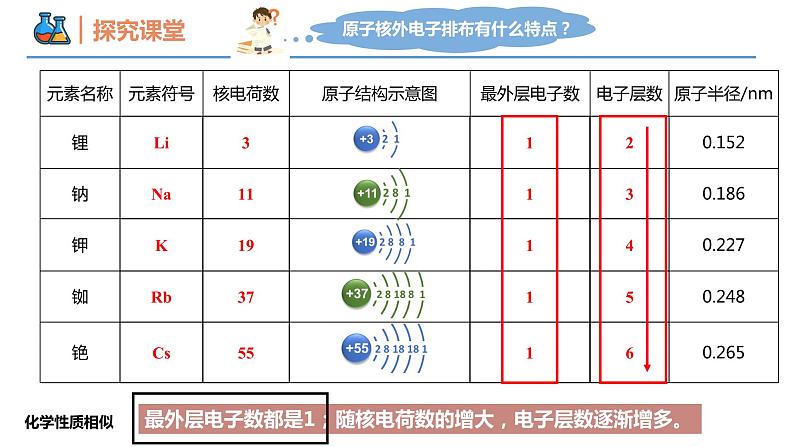
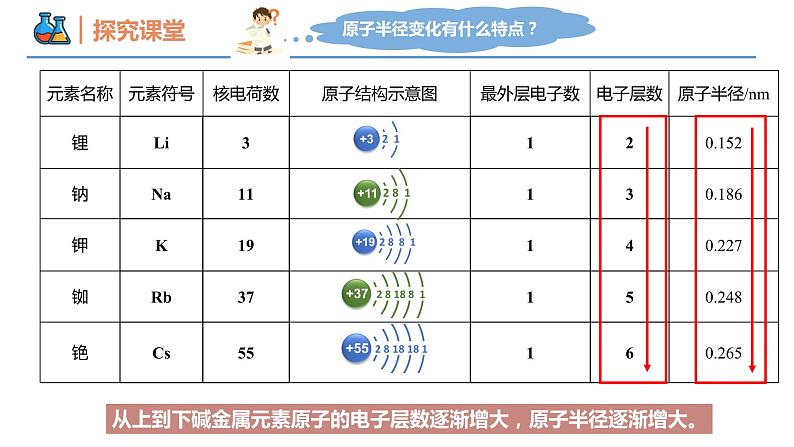
第四章 物质结构 元素周期律 第一节 原子结构与元素周期表 课时3 原子结构与元素的性质 壹贰叁典型的金属元素族——碱金属典型的非金属元素族——卤族经过不断的研究,科学家们最终制定出了元素周期表,那么,其是如何揭示元素之间的关联?元素化学性质与原子最外层电子数的关系得失稳定少于失去不稳定多于得到不稳定原子的最外层电子数决定原子的化学性质。元素化学性质与原子最外层电子数的关系过渡元素(过渡金属)碱金属元素卤族元素稀有气体元素放射性元素最外层电子数都是1;随核电荷数的增大,电子层数逐渐增多。化学性质相似从上到下碱金属元素原子的电子层数逐渐增大,原子半径逐渐增大。(1)回忆第二章学过的知识,钠有哪些化学性质?(用化学方程式表示),体现了什么性质?(2)结合锂、钠和钾的原子结构特点,预测锂、钾可能具有哪些相似化学性质?②2Na+2H2O=2NaOH+H2↑③2Na+2HCl=2NaCl+H2↑4Na+O2 = 2Na2O锂、钠和钾最外层都只有1个电子,都容易失去最外层电子,表现出比较强的还原性。锂、钾和钠相似,都能与氧气、水发生化学反应。还原性碱金属元素化学性质的相似性碱金属元素化学性质的递变性【观察并思考】Na与K分别与水、O2反应现象有何不同?试从原子结构角度解释。碱金属元素化学性质的递变性钾和钠都可以与水和氧气发生反应钾的反应更为剧烈原子最外层电子相同原子半径较大 强还原性(失电子)失电子能力更强还原性更强碱金属元素化学性质的递变性碱金属元素原子最外层只有一个电子原子结构的相似性元素性质的相似性决定在化合物中化合价+1易失电子,表现金属性(还原性)随核电荷数增加电子层数逐渐增大原子结构的递变性元素性质的递变性决定原子半径逐渐增大 金属性(还原性)逐渐增强原子失电子能力逐渐增强锂(Li) 钠(Na) 钾(K) 铷(Rb) 铯(Cs)随着核电荷数增加,碱金属的性质逐渐增强与水反应越来越剧烈,生成氢气速率越来越快;通式: 2M+2H2O=2MOH+H2↑碱性:LiOH < NaOH < KOH < RbOH < CsOH元素金属性逐渐增强,单质还原性逐渐增强请预测碱金属元素的性质碱金属元素的物理性质递增注意:锂是最轻的金属,保存在石蜡里;其他保存在煤油中。递增递减递减钠钾反常【例1】下列关于Li、Na、K、Rb、Cs的叙述均正确的一组是( )① 金属性最强的是锂② 形成的离子中,氧化性最强的是锂离子③ 在自然界中均以化合态形式存在④ Na在空气中久置后,成分为Na2CO3⑤ 均可与水反应,产物均为MOH和H2⑥ 它们在氧气中燃烧的产物都有M2O和M2O2两种形式⑦ 粒子半径:Rb+>K+>Na+,Cs>Cs+A. ①②③④⑤ B. ③④⑤⑥⑦C. ①②④⑥⑦ D. ②③④⑤⑦D卤族元素卤素单质的物理性质密度增大颜色加深熔点升高沸点升高FClBrI根据卤素原子结构,推测氟、氯、溴、碘在化学性质上所表现的相似性和递变性?卤族元素性质的理论分析卤族元素原子最外层有7个电子原子结构的相似性元素性质的相似性决定在化合物中常见化合价-1易得电子,表现非金属性(氧化性)卤族元素原子电子层数逐渐增大原子结构的递变性元素性质的递变性决定原子半径逐渐增大非金属性(氧化性)逐渐减弱原子得电子能力逐渐减弱卤素单质的化学性质①卤素与氢气反应 H2+X2=2HX( X=F、Cl、Br、I ) ① 与氢气反应的难易程度: ;② 生成氢化物的稳定性: ;③ 卤素非金属性的强弱: ;由易到难由强到弱由强到弱溶液变为橙黄色溶液变为棕黄色溶液变为棕黄色2KBr + Cl2 = 2KCl +Br22KI + Cl2 = 2KCl +I22KI + Br2 = 2KBr +I22Br-+Cl2=2Cl-+Br2 2I-+Cl2 = 2Cl-+I2 2I-+Br2 = 2Br-+I2 卤素单质的化学性质② 卤素单质间的置换反应2Br-+Cl2 = 2Cl- + Br2 2I-+Cl2 = 2Cl- + I2 2I-+ Br2 = 2Br- + I2 氧化性还原性Cl2>Br2Cl-
I2Cl-I2Br -Br2>I2卤素离子还原性:卤素单质氧化性:从氯到碘,单质的氧化性逐渐减弱。从氯到碘,离子的还原性逐渐增强。卤素单质的化学性质【例2】在甲、乙、丙三种溶液中各含一种卤素离子,往甲中加淀粉和氯水,则溶液变蓝色,再往丙中加淀粉和氯水,无明显现象。则甲、乙、丙依次含有( )A. Br-、I-、Cl- B. I-、Cl-、Br-C. I-、Br-、Cl- D. Br-、Cl-、I-C淀粉遇碘单质变蓝金 属 性 逐 渐 增 强非 金 属 性 逐 渐 减 弱 同一主族,从上到下:、 电子层数逐渐 , 原子半径逐渐 , 失电子能力逐渐 ,得电子能力逐渐 ,金属性逐渐 , 非金属性逐渐 ; 增大增强减弱增强减弱增多谢谢观看THANKS
第四章 物质结构 元素周期律 第一节 原子结构与元素周期表 课时3 原子结构与元素的性质 壹贰叁典型的金属元素族——碱金属典型的非金属元素族——卤族经过不断的研究,科学家们最终制定出了元素周期表,那么,其是如何揭示元素之间的关联?元素化学性质与原子最外层电子数的关系得失稳定少于失去不稳定多于得到不稳定原子的最外层电子数决定原子的化学性质。元素化学性质与原子最外层电子数的关系过渡元素(过渡金属)碱金属元素卤族元素稀有气体元素放射性元素最外层电子数都是1;随核电荷数的增大,电子层数逐渐增多。化学性质相似从上到下碱金属元素原子的电子层数逐渐增大,原子半径逐渐增大。(1)回忆第二章学过的知识,钠有哪些化学性质?(用化学方程式表示),体现了什么性质?(2)结合锂、钠和钾的原子结构特点,预测锂、钾可能具有哪些相似化学性质?②2Na+2H2O=2NaOH+H2↑③2Na+2HCl=2NaCl+H2↑4Na+O2 = 2Na2O锂、钠和钾最外层都只有1个电子,都容易失去最外层电子,表现出比较强的还原性。锂、钾和钠相似,都能与氧气、水发生化学反应。还原性碱金属元素化学性质的相似性碱金属元素化学性质的递变性【观察并思考】Na与K分别与水、O2反应现象有何不同?试从原子结构角度解释。碱金属元素化学性质的递变性钾和钠都可以与水和氧气发生反应钾的反应更为剧烈原子最外层电子相同原子半径较大 强还原性(失电子)失电子能力更强还原性更强碱金属元素化学性质的递变性碱金属元素原子最外层只有一个电子原子结构的相似性元素性质的相似性决定在化合物中化合价+1易失电子,表现金属性(还原性)随核电荷数增加电子层数逐渐增大原子结构的递变性元素性质的递变性决定原子半径逐渐增大 金属性(还原性)逐渐增强原子失电子能力逐渐增强锂(Li) 钠(Na) 钾(K) 铷(Rb) 铯(Cs)随着核电荷数增加,碱金属的性质逐渐增强与水反应越来越剧烈,生成氢气速率越来越快;通式: 2M+2H2O=2MOH+H2↑碱性:LiOH < NaOH < KOH < RbOH < CsOH元素金属性逐渐增强,单质还原性逐渐增强请预测碱金属元素的性质碱金属元素的物理性质递增注意:锂是最轻的金属,保存在石蜡里;其他保存在煤油中。递增递减递减钠钾反常【例1】下列关于Li、Na、K、Rb、Cs的叙述均正确的一组是( )① 金属性最强的是锂② 形成的离子中,氧化性最强的是锂离子③ 在自然界中均以化合态形式存在④ Na在空气中久置后,成分为Na2CO3⑤ 均可与水反应,产物均为MOH和H2⑥ 它们在氧气中燃烧的产物都有M2O和M2O2两种形式⑦ 粒子半径:Rb+>K+>Na+,Cs>Cs+A. ①②③④⑤ B. ③④⑤⑥⑦C. ①②④⑥⑦ D. ②③④⑤⑦D卤族元素卤素单质的物理性质密度增大颜色加深熔点升高沸点升高FClBrI根据卤素原子结构,推测氟、氯、溴、碘在化学性质上所表现的相似性和递变性?卤族元素性质的理论分析卤族元素原子最外层有7个电子原子结构的相似性元素性质的相似性决定在化合物中常见化合价-1易得电子,表现非金属性(氧化性)卤族元素原子电子层数逐渐增大原子结构的递变性元素性质的递变性决定原子半径逐渐增大非金属性(氧化性)逐渐减弱原子得电子能力逐渐减弱卤素单质的化学性质①卤素与氢气反应 H2+X2=2HX( X=F、Cl、Br、I ) ① 与氢气反应的难易程度: ;② 生成氢化物的稳定性: ;③ 卤素非金属性的强弱: ;由易到难由强到弱由强到弱溶液变为橙黄色溶液变为棕黄色溶液变为棕黄色2KBr + Cl2 = 2KCl +Br22KI + Cl2 = 2KCl +I22KI + Br2 = 2KBr +I22Br-+Cl2=2Cl-+Br2 2I-+Cl2 = 2Cl-+I2 2I-+Br2 = 2Br-+I2 卤素单质的化学性质② 卤素单质间的置换反应2Br-+Cl2 = 2Cl- + Br2 2I-+Cl2 = 2Cl- + I2 2I-+ Br2 = 2Br- + I2 氧化性还原性Cl2>Br2Cl-
I2Cl-
相关资料
更多










