

人教版新教材高三化学一轮复习8 课时作业(八)
展开A.碳酸氢钠常用于治疗胃酸过多症
B.Na2O2用作呼吸面具的供氧剂
C.发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔
D.金属钠着火时,使用泡沫灭火器来灭火
D [D项,Na燃烧生成的Na2O2能与CO2反应生成O2,因此金属钠着火时不能用泡沫灭火器灭火,应用沙土掩埋法灭火。]
2.下列物质投入水中发生化学反应,水作氧化剂的是( )
A.钠 B.氧化钠
C.碳酸钠 D.过氧化钠
A [A项,金属钠与水反应生成氢氧化钠和氢气,水中氢元素的化合价降低,水作氧化剂,钠作还原剂;B项,氧化钠与水反应生成氢氧化钠,不是氧化还原反应;C项,碳酸钠投入水中没有发生化学反应;D项,过氧化钠与水反应生成氢氧化钠和氧气,水中氢、氧元素的化合价没有发生变化,水既不是氧化剂也不是还原剂。]
3.取一小块金属钠,放在燃烧匙里加热,下列现象描述正确的是( )
①金属先熔化 ②在空气中燃烧,放出黄色火花 ③燃烧后得白色固体 ④燃烧时火焰为黄色 ⑤燃烧后生成淡黄色固体物质
A.②⑤ B.①②③
C.①④⑤ D.④⑤
C [钠的熔点低,加热时先熔化,然后燃烧,产生黄色火焰,生成Na2O2淡黄色固体物质。]
4.蒸发皿中放一小块钠,加热至熔化时,用玻璃棒蘸取少量无水CuSO4与熔化的钠接触,瞬间产生耀眼的火花,同时有红色物质生成。下列说法中不正确的是( )
A.上述反应是置换反应
B.上述反应是放热反应
C.上述反应中无水CuSO4表现了还原性
D.加热且无水条件下,Na可以与CuSO4反应并生成Cu
C [反应中CuSO4被还原为Cu,无水CuSO4表现的是氧化性。]
5.下列各组物质混合后,只能生成一种含钠化合物的是( )
A.Na2CO3溶液、盐酸
B.NaOH溶液、CO2
C.NaHCO3溶液、石灰水
D.Na2O2、CO2
D [A项中可生成NaCl、NaHCO3;B项中可生成Na2CO3、NaHCO3;C项中可生成Na2CO3、NaOH;D项中只生成Na2CO3。]
6.下列关于元素Li、Na、K、Rb、Cs的叙述均正确的一组是( )
①金属性最强的是锂 ②形成的离子中,氧化性最强的是锂离子 ③在自然界都以化合态形式存在 ④Li的密度最小 ⑤单质均可与水反应,产物均为碱和H2 ⑥单质在O2中燃烧的产物都有M2O和M2O2两种形式 ⑦粒子半径:Rb+>K+>Na+,Cs>Cs+
A.①②③④⑤ B.③④⑤⑥⑦
C.①②④⑥⑦ D.②③④⑤⑦
D [在元素周期表中,从上到下,碱金属的金属性逐渐增强,五种元素中金属性最强的是Cs,①错误;根据单质的还原性越强,形成离子的氧化性越弱,可知形成的离子中,氧化性最强的是Li+,②正确;五种元素都是活泼金属元素,在自然界都以化合态形式存在,③正确;Li的密度最小,④正确;单质都能与水反应得到碱和氢气,⑤正确;Li、Na、K在氧气中燃烧分别得到Li2O、Na2O2、K2O2或KO2,⑥错误;碱金属元素对应的阳离子半径从上到下,依次增大,即Rb+>K+>Na+,同一元素的原子半径大于阳离子半径,即Cs>Cs+,⑦正确。综上所述,D项正确。]
7.下列叙述正确的是( )
A.用焰色试验可以鉴别钠的化合物跟钾的化合物
B.钾、钠等碱金属着火时,立即用水或泡沫灭火器灭火
C.过氧化钠与水反应生成氢氧化钠,则过氧化钠是碱性氧化物
D.钠是一种还原性很强的金属,能把铜从硫酸铜溶液中置换出来
A [钠元素的焰色试验为黄色,透过蓝色钴玻璃观察钾元素的焰色试验为紫色,则可用焰色试验鉴别钠的化合物与钾的化合物,A正确;钾和钠都能够与水反应生成可燃性气体氢气,且二者的燃烧产物都能与二氧化碳反应生成助燃物氧气,所以钾、钠等碱金属着火时,不能用水或泡沫灭火器灭火,应该用沙子覆盖灭火,B错误;过氧化钠与水反应除了生成氢氧化钠外,还生成氧气,不符合碱性氧化物的定义,C错误;钠与硫酸铜溶液反应时,先与水反应,然后生成的氢氧化钠与硫酸铜反应生成氢氧化铜沉淀和硫酸钠,不会生成铜,D错误。]
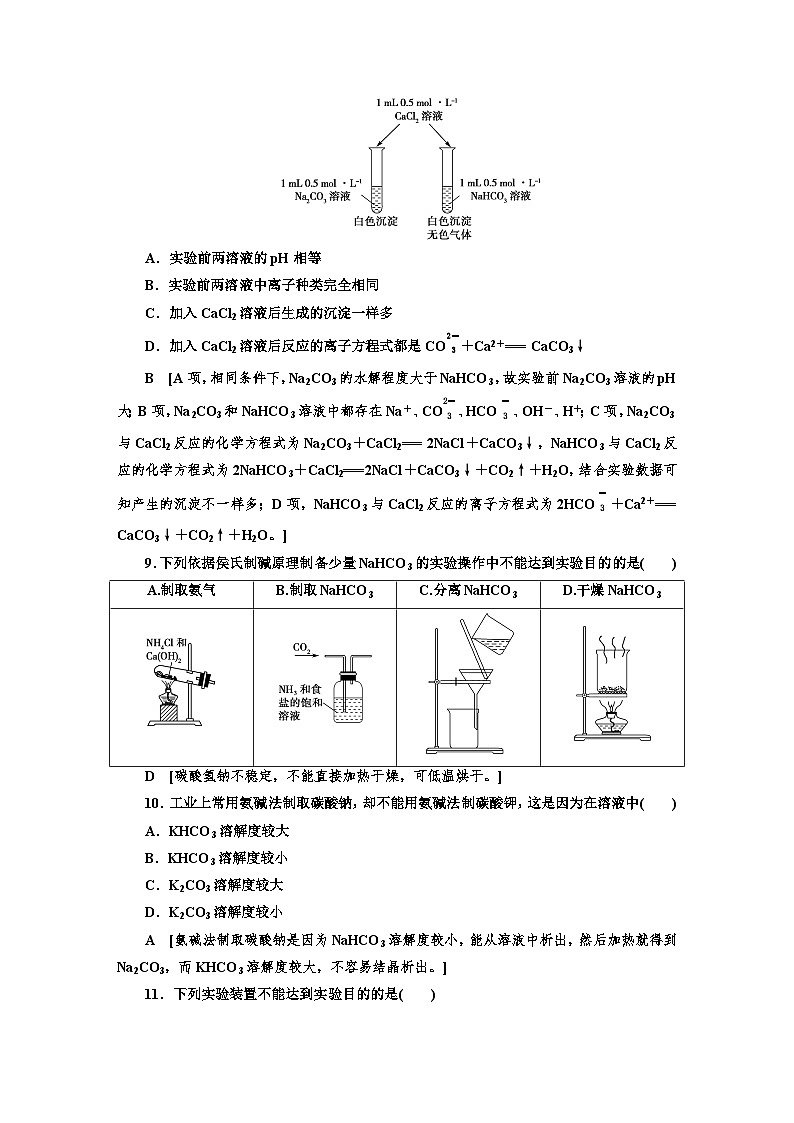
8.某同学用Na2CO3和NaHCO3溶液进行下图所示的实验。下列说法中,正确的是( )
A.实验前两溶液的pH相等
B.实验前两溶液中离子种类完全相同
C.加入CaCl2溶液后生成的沉淀一样多
D.加入CaCl2溶液后反应的离子方程式都是CO eq \\al(\s\up1(2-),\s\d1(3)) +Ca2+=== CaCO3↓
B [A项,相同条件下,Na2CO3的水解程度大于NaHCO3,故实验前Na2CO3溶液的pH大;B项,Na2CO3和NaHCO3溶液中都存在Na+、CO eq \\al(\s\up1(2-),\s\d1(3)) 、HCO eq \\al(\s\up1(-),\s\d1(3)) 、OH-、H+;C项,Na2CO3与CaCl2反应的化学方程式为Na2CO3+CaCl2=== 2NaCl+CaCO3↓,NaHCO3与CaCl2反应的化学方程式为2NaHCO3+CaCl2===2NaCl+CaCO3↓+CO2↑+H2O,结合实验数据可知产生的沉淀不一样多;D项,NaHCO3与CaCl2反应的离子方程式为2HCO eq \\al(\s\up1(-),\s\d1(3)) +Ca2+=== CaCO3↓+CO2↑+H2O。]
9.下列依据侯氏制碱原理制备少量NaHCO3的实验操作中不能达到实验目的的是( )
D [碳酸氢钠不稳定,不能直接加热干燥,可低温烘干。]
10.工业上常用氨碱法制取碳酸钠,却不能用氨碱法制碳酸钾,这是因为在溶液中( )
A.KHCO3溶解度较大
B.KHCO3溶解度较小
C.K2CO3溶解度较大
D.K2CO3溶解度较小
A [氨碱法制取碳酸钠是因为NaHCO3溶解度较小,能从溶液中析出,然后加热就得到Na2CO3,而KHCO3溶解度较大,不容易结晶析出。]
11.下列实验装置不能达到实验目的的是( )
答案: D
12.下列实验操作正确的是( )
B [钠与水的反应剧烈,试管管口太小,产生的氢气不能及时排出,有可能引起爆炸,反应不能在试管中进行,故A错误;可燃物燃烧的条件之一是温度达到着火点,Na2O2用棉花包裹,放入充满CO2的集气瓶中,棉花燃烧,说明过氧化钠和二氧化碳反应放出热量,导致棉花的温度达到着火点,故B正确;NaHCO3和Na2CO3都能与 Ca(OH)2反应生成碳酸钙沉淀,现象相同,所以不能用澄清石灰水鉴别,故C错误;观察钾元素的焰色试验要透过蓝色钴玻璃,故D错误。]
13.钠及其化合物在自然界广泛存在,并有重要用途。
(1)过氧化钠是钠的氧化物,写出过氧化钠中阴离子的电子式:__________。
(2)把一定量过氧化钠和未知量碳酸氢钠混合物放置在密闭体系中,充分加热后,排出气体,固体残留物中一定含有的物质是__________(写化学式)。
(3)工业上可采取金属钠氧化法制取过氧化钠,其流程如下:
Na eq \(―――――――――→,\s\up7(180~200 ℃熔化),\s\d5(通入无CO2的空气)) Na2O eq \(――――――――――→,\s\up7(300~400 ℃熔化),\s\d5(通入无CO2的空气)) Na2O2
如果把一定质量的过氧化钠按下列流程处理:
78 g Na2O2 eq \(――――――――――→,\s\up7(20 ℃),\s\d5(通入稍大于226 Pa的水蒸气)) 222 g A(固体)
写出A物质的化学式:____________。
(4)熔融态的过氧化钠是非常好的氧化剂,可用于工业上氧化FeSO4制高铁酸钠(Na2FeO4)(称为干法制备),干法制备中每1 ml FeSO4参加反应转移4 ml电子,产物中还有氧气生成。写出干法制取高铁酸钠的化学方程式:_________________________________。
解析: (2)NaHCO3无论量多少,分解生成的CO2优先与Na2O2反应,肯定有Na2CO3生成。(3)Na2O2与水蒸气反应只生成A,应为Na2O2的结晶水合物,所以结晶水的物质的量= eq \f(222 g-78 g,18 g/ml) =8 ml,所以A的化学式为Na2O2·8H2O。
答案: (1)
(2)Na2CO3
(3)Na2O2·8H2O
(4)FeSO4+4Na2O2 eq \(=====,\s\up7(高温)) Na2FeO4+2Na2O+Na2SO4+O2↑
14.某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图所示。
(1)只根据图Ⅰ所示实验,不能够达到实验目的的原因是____________________________
________________________________________________________________________。
(2)图Ⅱ、Ⅲ所示实验均能鉴别这两种物质,其反应的化学方程式为___________________
________________________________________________________________________。
(3)若用实验Ⅱ验证碳酸钠和碳酸氢钠的热稳定性,则试管B中装入的固体最好是(填化学式)____________。
解析: (1)NaHCO3、Na2CO3都与盐酸反应放出CO2,不能达到目的。
(2)Ⅱ、Ⅲ都是利用NaHCO3的不稳定性进行鉴别。
(3)试管B中装入碳酸氢钠,试管A中装入碳酸钠,这样直接加热的碳酸钠温度高,不分解,不能使澄清石灰水变浑浊,而间接加热的碳酸氢钠分解,使澄清石灰水变浑浊,表明了碳酸氢钠很不稳定。
答案: (1)无论是Na2CO3还是NaHCO3均可以与盐酸反应产生CO2,两者的反应现象相同,故达不到鉴别目的
(2)2NaHCO3 eq \(=====,\s\up7(△)) Na2CO3+H2O+CO2↑,CO2+Ca(OH)2===CaCO3↓+H2O
(3)NaHCO3
15.实验小组两名同学共同设计如下装置探究过氧化钠与二氧化硫的反应。通入SO2一段时间后,将带余烬的木条插入试管C的液面上方,木条复燃。
(1)甲同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是________
________________________________________________________________________。
检验反应后B中的白色固体含有Na2SO3的方法是________________________________
________________________________________________________________________。
(2)乙同学认为反应后B中有Na2SO3还会有Na2SO4。乙同学猜想的理由是
________________________________________________________________________
________________________________________________________________________。
为检验产物中Na2SO4的存在,乙同学设计并实施了如下实验方案:
甲同学认为该实验方案的现象不能证明有Na2SO4生成,其理由为________________________________________________________________________。
(3)测定B中反应完全后的固体中Na2SO4含量的实验方案:称取样品a g,加水溶解,________,烘干,称量得BaSO4 b g,则Na2SO4的质量分数为______________(列出计算式即可)。
解析: (1)Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式为2Na2O2+2SO2===2Na2SO3+O2。要证明反应后B中的白色固体中含有Na2SO3,只需证明含有SO eq \\al(\s\up1(2-),\s\d1(3)) 即可,取反应后B中的白色固体少许,滴入稀硫酸,若生成的无色气体能使品红溶液褪色,则说明含有Na2SO3。(2)Na2O2具有强氧化性,SO2有较强的还原性,两者发生氧化还原反应生成Na2SO4。由实验方案可知,稀硝酸具有强氧化性,它会将BaSO3氧化为BaSO4,故该实验不能说明反应后B中有Na2SO4。(3)因为亚硫酸钡易溶于盐酸,硫酸钡不溶,所以测定B中反应完全后固体中Na2SO4含量的实验方案为称取样品a g,加水溶解,加盐酸酸化的氯化钡溶液,过滤,洗涤,烘干,称量得BaSO4 b g。b g BaSO4的物质的量为 eq \f(b,233) ml,则样品中含Na2SO4的质量为 eq \f(b,233) ml×142 g·ml-1= eq \f(142b,233) g,所以Na2SO4的质量分数为 eq \f(142b,233a) ×100%。
答案: (1)2Na2O2+2SO2===2Na2SO3+O2 取反应后B中的白色固体少许,滴入稀硫酸,若生成无色能使品红溶液褪色的气体,则说明含Na2SO3
(2)过氧化钠具有强氧化性,二氧化硫有较强的还原性 稀硝酸能将亚硫酸钡氧化为硫酸钡
(3)加盐酸酸化的氯化钡溶液,过滤,洗涤 eq \f(142b,233a) ×100%A.制取氨气
B.制取NaHCO3
C.分离NaHCO3
D.干燥NaHCO3
选项
实验
操作
A
观察Na与H2O反应的现象
用镊子从煤油中取出金属钠,用滤纸吸去表面煤油,切下绿豆大小的钠,小心放入装有水的试管中
B
证明Na2O2与CO2反应是放热反应
Na2O2用棉花包裹,放入充满CO2的集气瓶中,棉花燃烧说明是放热反应
C
检验NaHCO3与Na2CO3溶液
用小试管分别取少量溶液,然后滴加澄清石灰水
D
检验Na2CO3与K2CO3溶液
用铂丝分别蘸取溶液,在酒精灯外焰上灼烧,直接观察火焰的颜色
人教版新教材高三化学一轮复习7 课时作业(七): 这是一份人教版新教材高三化学一轮复习7 课时作业(七),共7页。试卷主要包含了下列操作中正确的是等内容,欢迎下载使用。
人教版新教材高三化学一轮复习9 课时作业(九): 这是一份人教版新教材高三化学一轮复习9 课时作业(九),共7页。试卷主要包含了下列有关说法正确的是,探究补铁剂[主要成分等内容,欢迎下载使用。
人教版新教材高三化学一轮复习11 课时作业(十一): 这是一份人教版新教材高三化学一轮复习11 课时作业(十一),共6页。












