

人教版新教材高三化学一轮复习12 课时作业(十二)
展开A.硫在自然界中既有游离态又有化合态
B.过程⑤宜在土壤的富氧区实现
C.硫元素的循环过程中既有硫的还原,又有硫的氧化
D.若生物体有机硫的成键方式为,则过程④中S未发生氧化还原反应
B [A.从硫元素在自然界中的循环示意图可以看出,硫在自然界中既有游离态又有化合态,A正确;B.过程⑤由SO eq \\al(\s\up1(2-),\s\d1(4)) 生成H2S,S元素的价态降低,作氧化剂,则宜在土壤的贫氧区实现,B不正确;C.硫元素的循环过程中,既有硫的价态降低,被还原,又有硫的价态升高,被氧化,C正确;D.若生物体有机硫的成键方式为,则此时S元素显-2价,与H2S中S元素的价态相同,所以过程④中S未发生氧化还原反应,D正确。]
2.以下关于硫及其化合物说法错误的是( )
A.硫元素在自然界中既有游离态,又有化合态
B.检查病人胃病所用的“钡餐”,既可以用BaSO4,也可以用BaCO3
C.浓硫酸不可用来干燥H2S气体,因其具有强氧化性
D.SO2、SO3都为酸性氧化物,都可与水反应生成相应的酸
B [检查病人胃病所用的钡餐只能用硫酸钡,硫酸钡难溶于水和酸,碳酸钡溶于胃酸中的盐酸生成Ba2+,Ba2+是重金属离子,会使人中毒,故不可以用BaCO3,B项错误;浓硫酸具有强氧化性,硫化氢具有强还原性,易被浓硫酸氧化,C项正确;SO2与水反应生成亚硫酸,SO3与水反应生成硫酸,D项正确。]
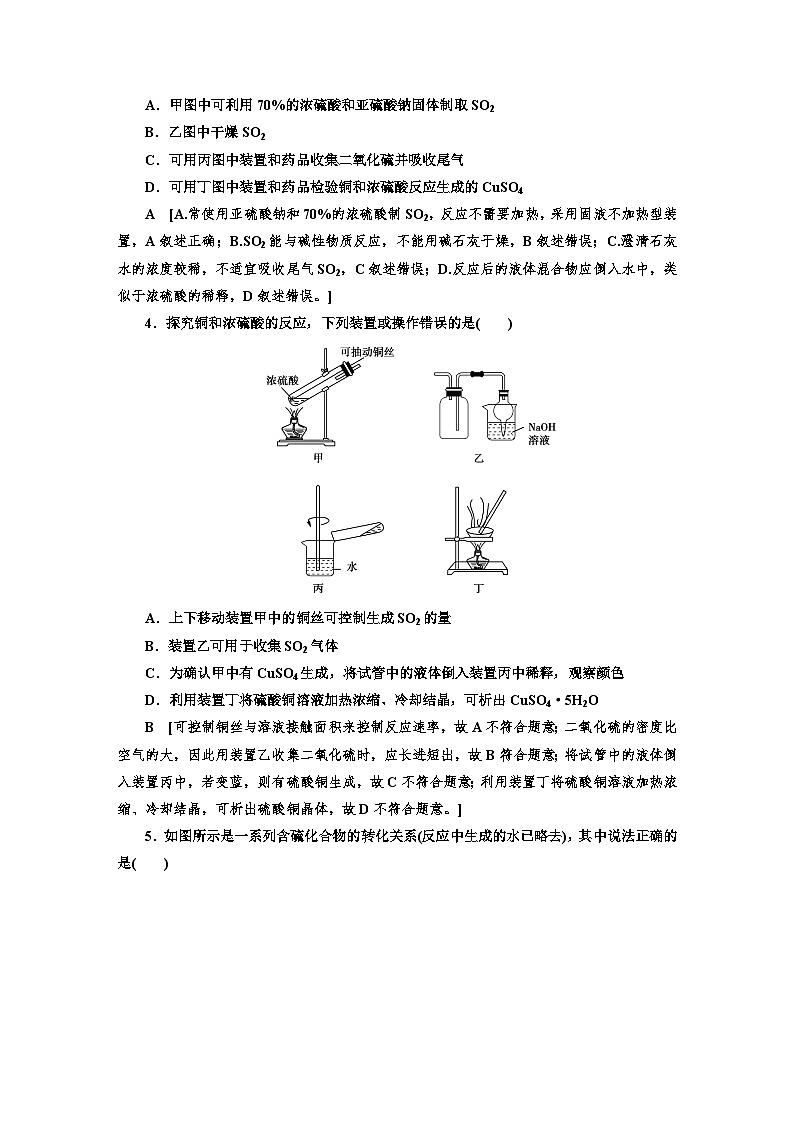
3.下列关于实验室制取SO2的实验,其中叙述正确的是( )
A.甲图中可利用70%的浓硫酸和亚硫酸钠固体制取SO2
B.乙图中干燥SO2
C.可用丙图中装置和药品收集二氧化硫并吸收尾气
D.可用丁图中装置和药品检验铜和浓硫酸反应生成的CuSO4
A [A.常使用亚硫酸钠和70%的浓硫酸制SO2,反应不需要加热,采用固液不加热型装置,A叙述正确;B.SO2能与碱性物质反应,不能用碱石灰干燥,B叙述错误;C.澄清石灰水的浓度较稀,不适宜吸收尾气SO2,C叙述错误;D.反应后的液体混合物应倒入水中,类似于浓硫酸的稀释,D叙述错误。]
4.探究铜和浓硫酸的反应,下列装置或操作错误的是( )
A.上下移动装置甲中的铜丝可控制生成SO2的量
B.装置乙可用于收集SO2气体
C.为确认甲中有CuSO4生成,将试管中的液体倒入装置丙中稀释,观察颜色
D.利用装置丁将硫酸铜溶液加热浓缩、冷却结晶,可析出CuSO4·5H2O
B [可控制铜丝与溶液接触面积来控制反应速率,故A不符合题意;二氧化硫的密度比空气的大,因此用装置乙收集二氧化硫时,应长进短出,故B符合题意;将试管中的液体倒入装置丙中,若变蓝,则有硫酸铜生成,故C不符合题意;利用装置丁将硫酸铜溶液加热浓缩、冷却结晶,可析出硫酸铜晶体,故D不符合题意。]
5.如图所示是一系列含硫化合物的转化关系(反应中生成的水已略去),其中说法正确的是( )
A.反应①说明SO2具有氧化性,反应②说明SO2具有酸性
B.反应②中生成物n(Na2SO3)∶n(NaHSO3)=1∶1时,反应物n(SO2)∶n(NaOH)=1∶2
C.反应③④⑤均属于氧化还原反应
D.工业上可利用反应②和反应④回收SO2
D [A项,反应①中先变蓝后褪色,说明KIO3先转化为I2后转化为I-,SO2体现还原性,错误;B项,根据元素守恒,当n(Na2SO3)∶n(NaHSO3)=1∶1时,n(SO2)∶n(NaOH)=2∶3,错误;C项,反应④不是氧化还原反应,错误;D项,利用反应②④,可以吸收SO2并回收利用,正确。]
6.100%硫酸吸收SO3可生成焦硫酸(分子式为H2S2O7或H2SO4·SO3)。下列说法不正确的是( )
A.焦硫酸具有强氧化性
B.Na2S2O7可与碱性氧化物反应生成新盐
C.Na2S2O7水溶液呈中性
D.硫酸吸收SO3生成焦硫酸的变化是化学变化
C [A.焦硫酸可以看作由浓硫酸和三氧化硫通过化合反应生成的,浓硫酸具有强氧化性,由此可以推断焦硫酸具有强氧化性,A项正确;B.焦硫酸钠可以看作由硫酸钠和SO3化合而成,SO3是酸性氧化物,可以与碱性氧化物反应得到盐,B项正确;C.焦硫酸钠可写成Na2SO4·SO3,其水溶液呈酸性,C项错误;D.焦硫酸和硫酸不是同一种物质,因此生成焦硫酸的过程属于化学变化,D项正确。]
7.如图是某元素的价类二维图。其中A是一种酸式盐,E的相对分子质量比D的相对分子质量大16,当x为一种强酸时,有如图转化关系。下列说法不正确的是( )
A.物质A、B、C、D、E、F中均含有硫元素
B.物质D可以使石蕊溶液先变红后褪色
C.物质C可在纯氧中燃烧,火焰呈蓝紫色
D.物质F的浓溶液可以用铁制容器盛放
B [由题给条件可推出A、B、C、D、E、F分别是NaHS(或KHS等)、H2S、S、SO2、SO3、H2SO4,都含有硫元素,A项正确;SO2只能使石蕊溶液变红不能使石蕊溶液褪色,B项错误;S在纯氧中燃烧火焰呈蓝紫色,C项正确;铁制容器遇浓硫酸,表面会生成一层致密的氧化膜,阻止反应的进一步发生,故可用铁制容器盛放浓硫酸,D项正确。]
8.如图所示是一种综合处理SO2废气的工艺流程,若每步都完全反应。下列说法正确的是( )
A.溶液B中发生的反应为2SO2+O2===2SO3
B.可用酸性高锰酸钾溶液检验溶液C中是否含有Fe3+
C.由以上流程可推知氧化性:Fe3+>O2>SO eq \\al(\s\up1(2-),\s\d1(4))
D.此工艺的优点之一是物质能循环利用
D [酸性Fe2(SO4)3溶液能吸收SO2,反应的离子方程式为2Fe3++SO2+2H2O===2Fe2++SO eq \\al(\s\up1(2-),\s\d1(4)) +4H+。溶液B中通入空气发生反应:4Fe2++O2+4H+===4Fe3++2H2O。其氧化性:O2>Fe3+,A、C两项错误;溶液C中含有Fe2(SO4)3,可用KSCN溶液检验Fe3+,B项错误;Fe2(SO4)3可循环利用,D项正确。]
9.T.F菌在酸性溶液中可实现天然气的催化脱硫,有助于除去天然气中的H2S杂质,其原理如图所示。下列说法正确的是( )
A.该脱硫过程需要及时补充Fe2(SO4)3溶液
B.步骤i发生反应的离子方程式为SO eq \\al(\s\up1(2-),\s\d1(4)) +3H2S+2H+===4S↓+4H2O
C.脱硫过程O2间接氧化H2S
D.改变温度对上述循环反应过程没有影响
C [A.T.F菌在酸性溶液中可实现天然气的催化脱硫,Fe2(SO4)3氧化硫化氢,自身被还原成硫酸亚铁,硫酸亚铁被氧气氧化成硫酸铁,Fe2(SO4)3为催化剂,该脱硫过程不需要添加Fe2(SO4)3溶液,故A错误; B.反应i中Fe2(SO4)3和H2S发生氧化还原反应生成硫酸亚铁、硫单质,离子方程式为2Fe3++H2S===2Fe2++S↓+2H+ ,故B错误;C.脱硫过程:Fe2(SO4)3氧化硫化氢,自身被还原成硫酸亚铁,硫酸亚铁被氧气氧化成硫酸铁,脱硫过程O2间接氧化H2S,故C正确;D.T.F菌属于蛋白质,高温条件下蛋白质变性,所以改变温度可能对上述循环反应过程有影响,故D错误。]
10.亚硫酸盐是一种常见的食品添加剂,用如图实验可检验某食品中亚硫酸盐含量(含量通常以1 kg样品中含SO2的质量计;所加试剂均足量)。下列说法不正确的是( )
eq \x(样品) eq \(―――――――→,\s\up7(稀H2SO4边通N2边煮沸),\s\d5(①)) eq \x(气体A) eq \(――→,\s\up7(H2O2溶液),\s\d5(②)) eq \x(含H2SO4的溶液) eq \(――→,\s\up7(NaOH溶液),\s\d5(③)) eq \x(中和液)
A.葡萄酒酿造时通入SO2起到了杀菌和增酸的作用
B.反应①中若不通入N2,则测得的SO2含量偏低
C.反应①中煮沸的目的是加快亚硫酸的分解,降低SO2的溶解度
D.若仅将②中的氧化剂“H2O2溶液”替换为“溴水”,对测定结果无影响
D [葡萄酒酿造时通入SO2起到了杀菌和增酸的作用,A项正确;反应①中通入N2的目的是将产生的SO2气体完全吹出后用吸收液吸收,从而提高实验的准确率,若不通入N2,则测得的SO2含量偏低,B项正确;反应①中煮沸的目的是加快亚硫酸的分解,降低SO2的溶解度,C项正确;若将H2O2溶液替换为溴水,如果溴过量,溴会与氢氧化钠反应,所以无法根据氢氧化钠的物质的量确定生成的硫酸的物质的量,D项错误。]
11.下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。化合物B在常温常压下为气体,B和C的相对分子质量之比为4∶5,化合物D是重要的工业原料。
(1)写出A在加热条件下与H2反应的化学方程式: ___________________________;
(2)写出E与A的氢化物反应生成A的化学方程式: _________________________;
(3)写出一个由D生成B的化学方程式: ____________________________________
________________________________________________________________________;
(4)写出由E生成D的化学方程式: ________________________________________
________________________________________________________________________。
答案: (1)S+H2 eq \(=====,\s\up7(△)) H2S
(2)H2SO3+2H2S===3S↓+3H2O
(3)Cu+2H2SO4(浓) eq \(=====,\s\up7(△)) CuSO4+SO2↑+2H2O
(4)2H2SO3+O2===2H2SO4
12.直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应: __________________________。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是_______________________________________________。
(3)吸收液吸收SO2的过程中,pH随n(SO eq \\al(\s\up1(2-),\s\d1(3)) )∶n(HSO eq \\al(\s\up1(-),\s\d1(3)) )变化关系如下表:
由上表判断,NaHSO3溶液显________性,用化学平衡原理解释: _____________
________________________________________________________________________。
解析: (1)SO2和H2O发生反应生成H2SO3,H2SO3被O2氧化为H2SO4。(2)书写离子方程式时,氧化物应写成化学式形式,SO2与NaOH溶液反应生成Na2SO3的离子方程式为2OH-+SO2===H2O+SO eq \\al(\s\up1(2-),\s\d1(3)) 。(3)由于HSO eq \\al(\s\up1(-),\s\d1(3)) 在溶液中既能电离又能发生水解,而HSO eq \\al(\s\up1(-),\s\d1(3)) 的电离程度大于HSO eq \\al(\s\up1(-),\s\d1(3)) 的水解程度,故NaHSO3溶液显酸性。
答案: (1)SO2+H2OH2SO3、2H2SO3+O2===2H2SO4
(2)2OH-+SO2===H2O+SO eq \\al(\s\up1(2-),\s\d1(3))
(3)酸 HSO eq \\al(\s\up1(-),\s\d1(3)) 存在:HSO eq \\al(\s\up1(-),\s\d1(3)) H++SO eq \\al(\s\up1(2-),\s\d1(3)) 和HSO eq \\al(\s\up1(-),\s\d1(3)) +H2OH2SO3+OH-,HSO eq \\al(\s\up1(-),\s\d1(3)) 的电离程度强于水解程度
13.兴趣小组同学利用如图所示装置(夹持装置已略去)探究SO2的性质,并制取一种常用食品抗氧化剂焦亚硫酸钠(Na2S2O5)。请回答下列问题。(实验前已除去装置中的空气)
(1)打开分液漏斗活塞,发现其中的液体不能流下,应采取的操作是_____________。
(2)关闭K2、K3,打开K1,装置B中发生反应的离子方程式为_________________,
观察到装置C中发生的现象是___________________________________________。
(3)装置D和F的作用是__________________________________________________。
(4)关闭K1、K3,打开K2。一段时间后E中有Na2S2O5晶体析出,装置E中发生反应的化学方程式为________________________________________________________________。
(5)设计实验验证Na2S2O5晶体在空气中已被氧化: ___________________________。
解析: (1)使用分液漏斗时应取下分液漏斗上口的玻璃塞,使分液漏斗内的压强等于大气压强,保证液体顺利流下。(2)装置A中生成SO2,装置B中FeCl3溶液与SO2发生反应,Fe3+被还原为Fe2+,SO2被氧化为SO eq \\al(\s\up1(2-),\s\d1(4)) ,根据得失电子守恒、原子守恒和电荷守恒配平离子方程式。装置C中发生反应:H2O+SO2+Na2S===H2S+Na2SO3、SO2+2H2S===3S↓+2H2O,现象是有淡黄色沉淀生成。(3)装置D和F的作用是吸收SO2,防止污染空气。(4)装置E中Na2SO3与SO2反应生成Na2S2O5。(5)若Na2S2O5晶体在空气中已被氧化,则生成Na2SO4,可以利用稀盐酸和BaCl2溶液检验SO eq \\al(\s\up1(2-),\s\d1(4)) 。
答案: (1)拔掉分液漏斗上口的玻璃塞(或使分液漏斗玻璃塞上的凹槽或小孔对准瓶颈处的小孔)
(2)2Fe3++SO2+2H2O===2Fe2++SO eq \\al(\s\up1(2-),\s\d1(4)) +4H+ 有淡黄色沉淀生成
(3)吸收SO2,防止污染空气
(4)SO2+Na2SO3===Na2S2O5
(5)取少量Na2S2O5晶体于试管中,加适量水溶解,再滴加足量盐酸,振荡,再滴入BaCl2溶液,有白色沉淀生成n(SO eq \\al(\s\up1(2-),\s\d1(3)) )∶n(HSO eq \\al(\s\up1(-),\s\d1(3)) )
91∶9
1∶1
9∶91
pH
8.2
7.2
6.2
人教版新教材高三化学一轮复习7 课时作业(七): 这是一份人教版新教材高三化学一轮复习7 课时作业(七),共7页。试卷主要包含了下列操作中正确的是等内容,欢迎下载使用。
人教版新教材高三化学一轮复习8 课时作业(八): 这是一份人教版新教材高三化学一轮复习8 课时作业(八),共7页。试卷主要包含了下列叙述正确的是等内容,欢迎下载使用。
人教版新教材高三化学一轮复习9 课时作业(九): 这是一份人教版新教材高三化学一轮复习9 课时作业(九),共7页。试卷主要包含了下列有关说法正确的是,探究补铁剂[主要成分等内容,欢迎下载使用。












