





- 6.1.2 化学反应的限度(同步课件)-2023-2024学年高一化学同步精品课件+分层练习(苏教版必修第二册) 课件 0 次下载
- 6.2化学反应中的热(分层练习)-2023-2024学年高一化学同步精品课件+分层练习(苏教版必修第二册) 课件 0 次下载
- 6.3.1化学能转化为电能(分层练习)-2023-2024学年高一化学同步精品课件+分层练习(苏教版必修第二册) 课件 0 次下载
- 6.3.1化学能转化为电能(同步课件)-2023-2024学年高一化学同步精品课件+分层练习(苏教版必修第二册) 课件 0 次下载
- 6.3.2化学电源(分层练习)-2023-2024学年高一化学同步精品课件+分层练习(苏教版必修第二册) 课件 0 次下载
苏教版 (2019)必修 第二册第二单元 化学反应中的热一等奖课件ppt
展开1.通过反应前后物质总能量的相对大小判断化学反应是吸热反应还是放热反应。2.通过化学键的断裂和形成认识化学反应中能量变化的主要原因,认识化学反应中的能量变化和物质具有的能量之间的关系。3.能举例说明化学在解决能源危机中的重要作用。4.能分析能源的利用对自然环境和社会发展的影响,发展科学态度和社会责任素养。
不仅仅是食物,每种物质的内部都蕴含着化学能。
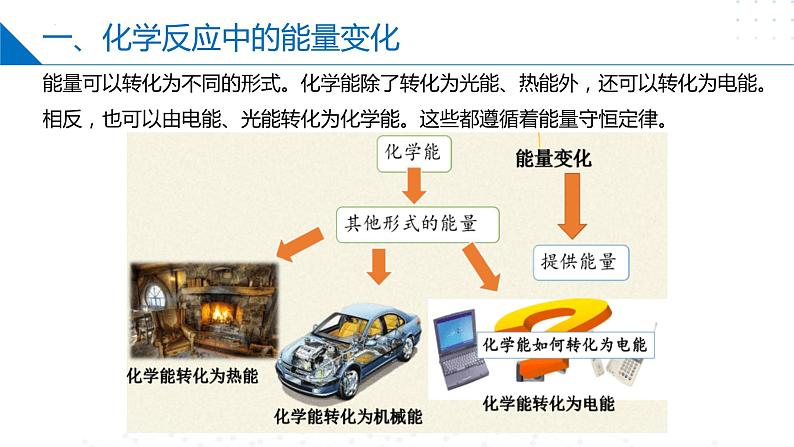
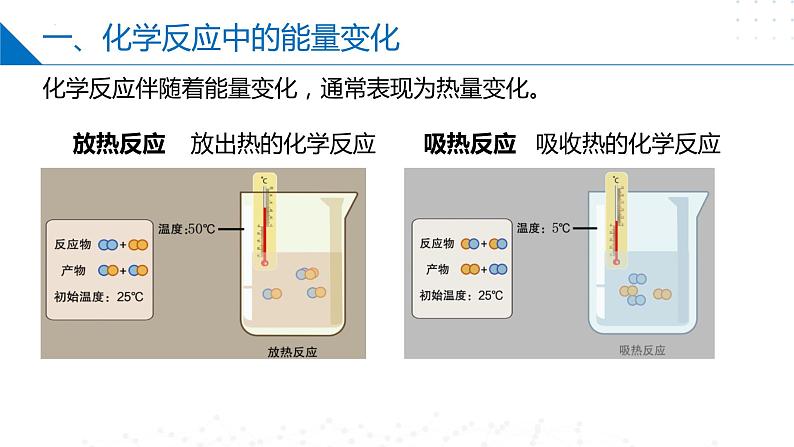
一、化学反应中的能量变化
物质的燃烧也释放出能量。
能量可以转化为不同的形式。化学能除了转化为光能、热能外,还可以转化为电能。相反,也可以由电能、光能转化为化学能。这些都遵循着能量守恒定律。
化学反应伴随着能量变化,通常表现为热量变化。
NaOH+HCl= NaCl+ H2O
2Na+ 2H2O = 2NaOH + H2 ↑
酸碱中和反应放热;钠与水反应放热。
Ba(OH)2·8H2O + 2NH4Cl=2NH3↑ + BaCl2 + 10H2O
当能量变化以热能的形式表现时,化学反应可以分为:
①所有燃烧反应②酸碱中和反应③大多数化合反应④活泼金属跟水或酸的反应⑤物质的缓慢氧化
①大多数分解反应②铵盐与碱的反应,如Ba(OH)2·8H2O或Ca(OH)2与NH4Cl反应③C与H2O(g)反应,C与CO2反应④NaHCO3与盐酸的反应
例1.下列变化中属于吸热反应的是( )①铝片与稀盐酸的反应 ②将胆矾加热变为白色粉末 ③干冰汽化 ④氯酸钾分解制氧气 ⑤甲烷在氧气中的燃烧反应A.①④ B.②③ C.①④⑤ D.②④
二、化学反应中能量变化原因
1.反应物、生成物总能量的相对大小
∑E(反应物)
∑E(反应物) > ∑E(生成物)
∑E(反应物) + 吸收的能量=
∑E(反应物) < ∑E(生成物)
2.反应物、生成物总能量的相对大小
化学反应中的能量变化,可以用反应物与生成物的总能量的变化来说明,微观上怎么解释?
提示:化学反应是旧化学键断裂和新化学键形成的过程。
旧化学键断裂和新化学键形成有无能量变化?
分开小磁球需要能量(需施外力)
小磁球相互吸引会释放能量(球体因撞击而发热)
化学键如同小磁球之间的作用力,旧化学键断裂需要吸收能量,新化学键形成会放出能量。
共价键的键能:断开气态物质中1ml某种共价键生成气态原子需要吸收的能量。
1、共价键的键能越大,该共价键越牢固。
2、断开1ml某化学键所需的能量与形成1ml该化学键放出的能量相等。
2、化学键角度(微观层面)
Cl2 + H2 = 2HCl
图中的x、y值分别为多少?
吸收 242.7kJ + 436.4kJ
放出 2 × 431.8kJ
Cl2 + H2 = 2HCl
吸收 242.7kJ + 436.4kJ
放出 2 × 431.8kJ
863.6kJ - 679.1kJ =184.5kJ
化学键的断裂和形成是物质在化学反应中发生能量变化的本质原因。
物质能量高低、化学键能大小、稳定性三者之间的的关系是怎样的?
物质的化学键越牢固,断裂时需要吸收的能量越多,形成时释放的能量越多,物质具有的能量越低,物质越稳定。
二、化学反应中的能量变化
对于可逆反应来说,若正反应是放热反应,则逆反应是吸热反应,反之亦然。
规律 吸热反应和放热反应的判断方法
(2)根据化学键断裂或形成时的能量变化判断——用于计算。若断裂反应物中的化学键所吸收的总能量小于形成生成物中化学键所放出的总能量,属于放热反应,反之是吸热反应。
(1)根据反应物和生成物的总能量的相对大小判断——决定因素。若反应物的总能量大于生成物的总能量,属于放热反应,反之是吸热反应。
(3)根据反应物和生成物的相对稳定性判断。由不稳定的物质(能量高)生成稳定的物质(能量低)的反应为放热反应,反之为吸热反应。
(4)根据反应条件判断。凡是持续加热才能进行的反应一般是吸热反应。
例2.化学反应可视为旧键断裂和新键形成的过程。共价键的键能是两种原子间形成1 ml共价键(或其可逆过程)时释放(或吸收)的能量。已知H—H键的键能为436 kJ·ml-1、Cl—Cl 键的键能为243 kJ·ml-1、H—Cl键的键能为x,若1 ml H2(g)与1 ml Cl2(g)反应生成2 ml HCl(g)放出183 kJ的热量,则x为( )A.496 kJ·ml-1 B.431 kJ·ml-1C.862 kJ·ml-1 D.248 kJ·ml-1
化学反应中的热量变化如何定量表示?
1、概念:能表示化学反应中放出或吸收的热量的化学方程式。
C(s)+O2(g)===CO2(g) ΔH=-393.6 kJ·ml-1
2、意义:①表明了化学反应中的物质变化②表明了化学反应中的热量变化
观察下列两个热化学方程式,与化学方程式相比,热化学方程式有哪些不同?
3、热化学方程式的书写注意事项:
②反应放出或吸收的热用ΔH表示,在化学方程式的右边用空格隔开,负值表示在该条件下反应放热,正值表示在该条件下反应吸热,单位为:kJ •ml-1;
①需要标明所有物质在反应条件下的状态(气态、液态、固态、溶液分别用g、l、s、aq表示);
④ΔH的数值与化学计量数成正比例关系。对于同一反应,正反应与逆反应的ΔH 数值相等,符号相反。
③化学计量数可以是整数,也可以是分数,只表示该物质的物质的量;
⑤不需要注明反应条件,不用标↑、↓ ;
CaCO3(s) = CaO(s) +CO2(g) △H= 178.2 kJ •ml-1
表示1 ml CaCO3固体完全分解生成1 ml CaO固体和1 ml CO2气体吸收178.2 kJ的热量。
该热化学方程式表示的含义是什么?
(1)2SO2+O2===2SO3 ΔH=-196.6 kJ·ml-1(2)2H2(g)+O2(g)===2H2O(l) ΔH=-517.6 kJ·ml-1(3)H2(g)+1/2O2(g)===H2O(l) ΔH=-285.8 kJ(4)C(s)+O2(g)===CO2(g) ΔH=393.5 kJ·ml-1(5)CaCO3(g)===CaO+CO2(g) ΔH=177.7 kJ(6)C(s)+H2O(g)===CO(g)+H2(g) ΔH=-131.3 kJ·ml-1
4、热化学方程式的书写步骤
“五看”法判断热化学方程式的正误一看方程式是否配平;二看各物质的聚集状态是否正确;三看ΔH的“+”“-”符号是否正确;四看反应热的单位是否为“kJ·ml-1”;五看反应热的数值与化学计量数是否对应。
例3.在常温常压下,1 g H2在足量Cl2中完全燃烧生成HCl气体,放出92.3 kJ 的热量。下列热化学方程式中正确的是( )A.H2(g)+Cl2(g)===2HCl(g) ΔH=-92.3 kJ·ml-1B.H2(g)+Cl2(g)===2HCl(g) ΔH=92.3 kJ·ml-1C.H2(g)+Cl2(g)===2HCl(g) ΔH=184.6 kJ·ml-1D.2HCl(g)===H2(g)+Cl2(g) ΔH=184.6 kJ·ml-1
四、燃料燃烧释放的能量
热值:在一定条件下 的可燃物完全燃烧所放出的 ,单位是 。
氢气>天然气>石油>煤炭
例4.液态储氢技术就是在常温常压下将氢气融入到一种化合物“储油”中,形成“氢油”,便于储存和运输。下列有关说法错误的是( )A.“氢油”不稳定B.氢能源属于可再生能源C.该技术实现了常温常压下储氢技术的新突破D.液态储氢项目有利于发展氢能源电动机,从而带来新能源汽车的升级
化学反应中能量变化原因
1.化学反应A2+B2==2AB的能量变化如图所示,则下列说法正确的是( )
A.1 ml A2和1 ml B2完全反应吸收(y-x) kJ热量B.断裂1 ml A—A键和1 ml B—B键放出x kJ的能量C.断裂2 ml A—B键需要吸收y kJ的能量D.2 ml AB的总能量高于1 ml A2和1 ml B2的总能量
2.根据所给信息完成下列热化学方程式:(1)已知1 ml C(s)与适量H2O(g)反应生成CO(g)和H2(g),吸收131.3 kJ热量,请写出该反应的热化学方程式:_________________________________。 (2)1.7 g NH3(g)发生催化氧化反应生成气态产物,放出22.67 kJ的热量,请写出该反应的热化学方程式_____________________________________。 (3)已知:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·ml-1,请写出1 ml NH3分解对应的热化学方程式:_____________________。
高中化学苏教版 (2019)必修 第二册第三单元 人工合成有机化合物完美版课件ppt: 这是一份高中化学苏教版 (2019)必修 第二册<a href="/hx/tb_c4002526_t3/?tag_id=26" target="_blank">第三单元 人工合成有机化合物完美版课件ppt</a>,文件包含83人工合成有机化合物分层练习原卷版docx、83人工合成有机化合物分层练习解析版docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
苏教版 (2019)必修 第二册第三单元 含氮化合物的合理使用优质课ppt课件: 这是一份苏教版 (2019)必修 第二册<a href="/hx/tb_c4002521_t3/?tag_id=26" target="_blank">第三单元 含氮化合物的合理使用优质课ppt课件</a>,文件包含73含氮化合物的合理使用分层练习原卷版docx、73含氮化合物的合理使用分层练习解析版docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
高中化学苏教版 (2019)必修 第二册第一单元 氮的固定优秀ppt课件: 这是一份高中化学苏教版 (2019)必修 第二册<a href="/hx/tb_c4002519_t3/?tag_id=26" target="_blank">第一单元 氮的固定优秀ppt课件</a>,文件包含71氮的固定同步课件pptx、一氧化氮与氧气反应实验mp4、二氧化氮与水反应实验mp4、工业合成氨实验mp4、淀粉碘化钾鉴别溴蒸汽和二氧化氮实验mp4、芯片产业观察-氮气视频mp4、鉴别溴蒸汽和二氧化氮实验mp4、镁与氮气反应实验mp4、食品保存和液氮视频mp4等9份课件配套教学资源,其中PPT共32页, 欢迎下载使用。













