






人教版 (2019)必修 第二册第二节 化学反应的速率与限度图文ppt课件
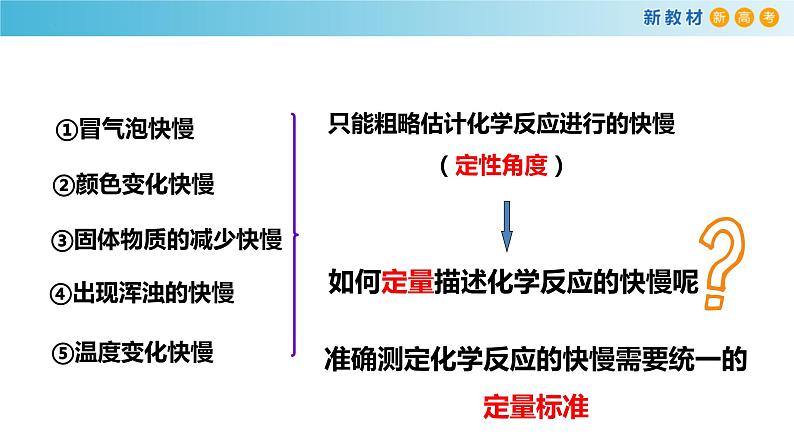
展开在化学实验和日常生活中,我们经常观察到有些反应进行得快,有些反应进行得慢。
这些反应有快有慢,快到什么程度?慢到什么程度?
在化学实验中,有哪些观察化学反应快慢的方法?
如何定量描述化学反应的快慢呢
只能粗略估计化学反应进行的快慢(定性角度)
准确测定化学反应的快慢需要统一的定量标准
第1课时 化学反应速率及影响因素
知道化学反应速率的概念和表示方法。学会进行化学反应速率的简单计算
了解影响化学反应速率的因素及规律
学习任务一 化学反应速率
ml/ ( L·min) 和 ml/ (L·s)
ml·L-1·min-1 和 ml·L-1·s-1
用来衡量化学反应快慢程度的物理量
单位时间物体运动的位移
[例1]在某一化学反应中,已知反应物A的浓度在10 s内从4 ml/L变成1 ml/L。则在这10 s内用A表示的化学反应速率为多少?
问:第10s的反应速率为多少?
注意:1、反应速率要指明具体物质并取正值; 2、表示气体或溶液反应速率,不能用于表示固体和纯液体; 3、指平均速率.
【例2】在1L的密闭容器中,加入8mlN2和20ml H2,发生N2 + 3H2 2NH3,在5min末时,测得容器中含有6ml的N2,求该反应的化学反应速率。
N2 + 3H2 2NH3
起始浓度(ml/L) 8 20 0
5min末浓度(ml/L)
v(N2)= 2/5=0.4ml/(L·min)
v(H2)= 6/5=1.2ml/(L·min)
v(NH3)= 4/5=0.8ml/(L·min)
△C (ml/L)
结论1:同一反应的反应速率可以用不同的物质表示,其数值可能不同,但所表示的意义是相同的。在表示反应速率时,应注明是由哪种物质表示的。
由以上可知∶ V(N2): V(H2 ): V(NH3)= 0.4 : 1.2 : 0.8 = 1 : 3 : 2
结论2: 同一反应中,各物质的反应速率之比等于其化学方程式中的化学计量数之比。即对于反应:aA+bB=cC+dD vA:vB:vC:vD = a : b : c : d
3A(g)+B(g)=2C(g)
[例3]对于反应3A(g)+B(g)=2C(g),在不同条件下,用A、B表示的反应速率分别为条件①v(A)=0.6 ml·L-1·min-1;条件②v(B)=0.45 ml·L-1·min-1;比较反应在条件①和条件②的速率快慢
v(A)=0.6 ml·L-1·min-1
v(B)=0.45 ml·L-1·min-1
v(B)=0.2 ml·L-1·min-1
提示:比较不同过程反应速率,转变成同一物质的速率进行比较
[例4]反应 A(g) + 3B(g) = 2C(g) + 2D (g) 在四种不同情况下的反应速率为:①v(A)=0.45ml·L-1·min-1 ②v(B)=0.6ml·L-1·s-1 ③v(C)=0.4ml·L-1·s-1 ④v(D)=0.45ml·L-1·s-1则该反应速率的快慢顺序为( )A.④>③=②>① B.④<③=②<①C.①>②=③>④ D.④>③>②>①
比较同一个化学反应的反应速率的相对大小时,应先转化为同一物质、同一单位,然后再比较其数值大小,数值越大表明反应越快。
1.某温度下,浓度都是1ml/L的两种气体X2和Y2,在密闭容器中反应生成气体Z,经过t min后,测得物质的量浓度分别为:c(X2)=0.4ml/L,c(Y2)=0.8ml/L ,c(Z)=0.4ml/L,则反应的化学方程式可表示为:
3X2 + Y2 = 2Z
3X2 + Y2 = 2X3Y
2.已知反应N2 +3H2 2NH3,根据下图判断
①A是______物质的量浓度变化情况②C是______物质的量浓度变化情况③2分钟内N2的平均速率是多少?
0.5ml/(L· min )
4. 反应A+3B==2C+2D在四种不同的情况下的反应速率分别为: ①ひ(A)=0.15ml/(L·S) ②ひ(B)= 0.6ml/(L·S) ③ひ(C)= 0.4ml/(L·S) ④ひ(D)= 0.45ml/(L·S) 该反应在四种情况下的快慢顺序为___________.
3. 已知 4NH3+5O2===4NO+6H2O,则下列关系式正确的是( )4/5v(NH3)=v(O2) B.4/5v(NH3)=v(H2O)C. 5/6v(O2)=v(H2O) D. 4/5v(O2)=v(NO)
反应的快慢程度与我们有什么关系?
氨、硫酸等化工产品的生产
调控化学反应速率常常是决定化学实验成败或化工生产成本的关键。
思考:有哪些因素能够影响化学反应速率呢?
学习任务二 影响化学反应速率的因素
变量控制探究影响化学反应速率因素的一般原则是“定多变一”,即要保持其他变量不变,改变其中一个变量的值进行实验,测定数据,通过系列实验,找出变量对反应速率的影响。其探究流程为
1、探究温度对化学反应速率的影响
浸在热水中试管产生气泡速率明显比浸在冷水中试管产生气泡速率快
实验结论:当其他条件相同时,升高温度,化学反应速率增大,反之减慢。
2、探究浓度对化学反应速率的影响
不加水的试管中产生气泡速率大
实验结论:当其他条件相同时,增大浓度,化学反应速率增大,反之减慢。
对于气体来说,在相同温度下,压强越大,一定质量气体的体积越小,单位体积内气体的分子数越多。请据此思考讨论以下问题:
已知在密闭容器中发生化学反应:N2(g)+O2(g) =2NO(g)。分析下列条件的改变对该反应的化学反应速率的影响。(1)缩小容器容积使体系压强增大,该反应的反应速率将如何变化?(2)体积不变,充入氩气,使体系压强增大,该反应的反应速率将如何变化?(3)压强不变,充入氩气,该反应的反应速率将如何变化?
据媒体报道:在美国威斯威科市的一个 面粉厂发生爆炸。在 这 次 爆 炸中, 共 炸 死 了36人,炸伤9人,有48个贮 粮 仓的大粮库被 夷 为平地,连附近 的 一座办公楼也彻 底 炸毁,经济损失约1亿美元。
为什么面粉也会发生如此剧烈的爆炸?
大理石碎块、大理石粉末与1 ml/L的盐酸反应谁快谁慢?为什么?
结论:当其它条件不变时,增大固体表面积可以加快反应速率(接触充分)。
MnO2能加快反应速率
FeCl3能加快反应速率
结论4:其他条件不变时,加入(正)催化剂可以加快反应速率。
(3)固体表面积的影响
(4)催化剂对反应速率的影响
下列调控反应速率的措施或实验中,分别利用或体现了哪些影响反应速率的因素?(1)向炉膛内鼓风,用煤粉代替煤块可以使炉火更旺。(2)把食物存放在冰箱里,在糕点包装内放置除氧剂可以延长食品保质期。(3)做化学实验时,为加速反应的进行,通常将块状或颗粒状的固体药品研细并混匀,或者将固体试剂溶于水配成溶液后再进行实验。(4)铁在空气中和在纯氧中反应的剧烈程度明显不同。(5)实验室用Zn和稀硫酸反应制取H2时,为了加快化学反应速率可滴入几滴硫酸铜溶液。(6)在通常情况下,Na与水的反应比Mg与水的反应剧烈 。
参加反应的物质自身的性质是决定化学反应速率的主要原因。
影响化学反应速率的因素
1.一定条件下,分别对反应C(s)+CO2(g)=2CO(g)进行如下操作:①升高反应体系的温度;②减小CO2的浓度;③缩小反应体系的体积;④减小压强。上述措施中一定能使反应速率显著变大的是( )A.①②③④ B.①③④ C.①② D.①③
2. CaCO3与100 mL稀盐酸反应生成CO2的量与反应时间的关系如图所示,下列结论不正确的是( )A.反应在2~4 min内平均反应速率最大B.反应在2~4 min内用盐酸表示的平均反应速率为v(HCl)=0.1 ml·L-1·min-1C.反应开始阶段,反应速率逐渐增大是由于温度比浓度对反应速率的影响大D.4 min后,反应速率减小的主要原因是c(H+)减小
3.在下列事实中,各是什么因素影响了化学反应速率。(1)集气瓶中H2和Cl2的混合气体,在瓶外点燃镁条时发生爆炸。(2)黄铁矿煅烧时要粉碎成矿粒。(3)熔化的KClO3放出气泡很慢,撒入少量MnO2则很快产生气体。(4)同浓度、同体积的盐酸放入同样大小的锌粒和镁粒,产生气体有快有慢。(5)同样大小的石灰石分别与0.1 ml·L-1盐酸和1 ml·L-1盐酸反应,速率不同。(6)夏天食品容易变质,而冬天不易发生该现象。
4.等质量的铁与过量的盐酸在不同的实验条件下进行反应, 测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法一定不正确的是( )
A.第④组实验的反应速率最小 B.第①组实验中盐酸的浓度大于2.5 ml·L-1C.第②组实验中盐酸的浓度等于2.5 ml·L-1 D.第③组实验的反应温度低于30 ℃
5.把镁条投入盛有盐酸的敞口容器中,产生氢气的速率变化曲线如图所示。下列因素中,影响该反应速率的是( )。①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度A.①④ B.③④C.①③ D.②③
解析:镁与盐酸反应的离子方程式为Mg+2H+==Mg2++H2↑,与H+有关,与Cl-无关。在镁与盐酸的反应中,刚开始时H+的浓度最大,反应速率应最大,但由于此反应为放热反应,温度升高,化学反应速率还会增大,随着化学反应的进行,H+浓度逐渐减小,化学反应速率又逐渐减小。
化学人教版 (2019)第七章 有机化合物第二节 乙烯与有机高分子材料授课课件ppt: 这是一份化学人教版 (2019)第七章 有机化合物第二节 乙烯与有机高分子材料授课课件ppt,共27页。PPT课件主要包含了学习目标,聚合反应,加成聚合反应等内容,欢迎下载使用。
必修 第二册第一节 化学反应与能量变化备课课件ppt: 这是一份必修 第二册第一节 化学反应与能量变化备课课件ppt,共27页。PPT课件主要包含了电池是谁发现的,无处不在的电池,学习目标,第4课时化学电源等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第二册第二节 氮及其化合物备课课件ppt: 这是一份高中化学人教版 (2019)必修 第二册第二节 氮及其化合物备课课件ppt,共23页。PPT课件主要包含了学习目标,第3课时氨气,现象产生大量白烟,NH3等内容,欢迎下载使用。













