



人教版 (2019)必修 第二册第二节 化学反应的速率与限度示范课课件ppt
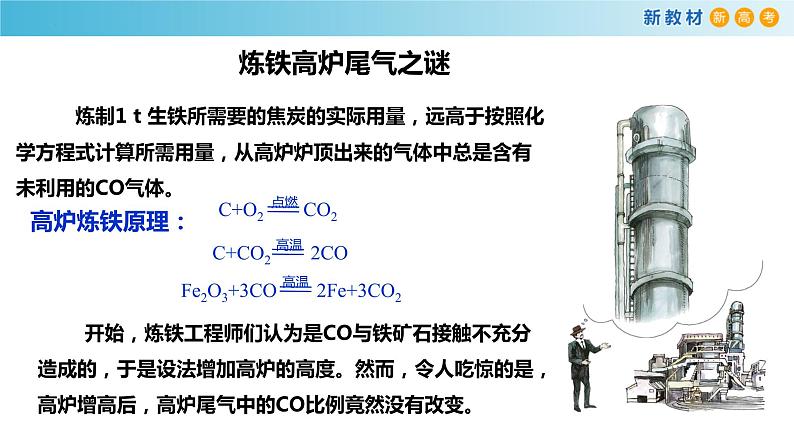
展开开始,炼铁工程师们认为是CO与铁矿石接触不充分造成的,于是设法增加高炉的高度。然而,令人吃惊的是,高炉增高后,高炉尾气中的CO比例竟然没有改变。
炼制1 t 生铁所需要的焦炭的实际用量,远高于按照化学方程式计算所需用量,从高炉炉顶出来的气体中总是含有未利用的CO气体。
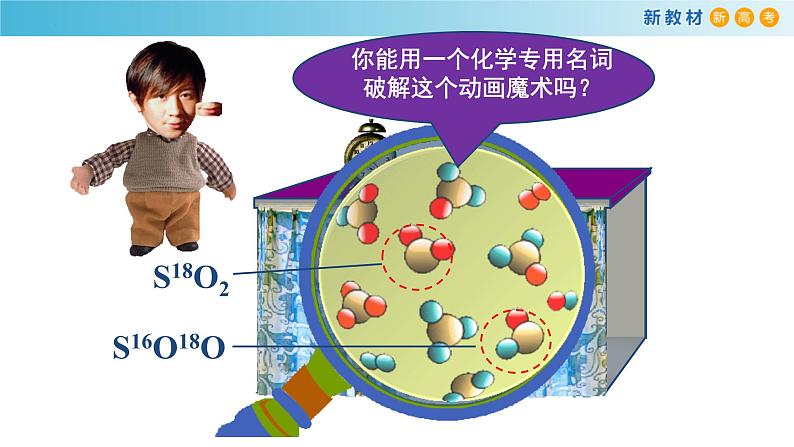
2SO2 + 18O2
2SO2 + 18O2
第2课时 化学反应的限度
了解可逆反应的含义及其特征
通过化学平衡状态的建立过程,知道化学平衡是一种动态平衡。3知道化学平衡状态的特征,判断反应是否达到化学平衡状态
2Fe3+ + 2I- = 2 Fe2++ I2
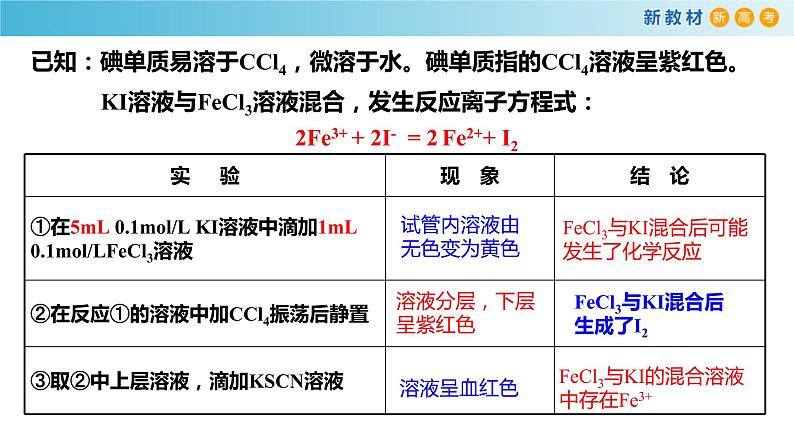
KI溶液与FeCl3溶液混合,发生反应离子方程式:
已知:碘单质易溶于CCl4,微溶于水。碘单质指的CCl4溶液呈紫红色。
【探究方案】取5mL0.1ml/L的KI溶液于试管中,滴加1mL0.1ml/L的FeCl3溶液,再加入2mLCCl4,充分振荡,静置后取上层溶液于另一试管,滴加KSCN溶液。
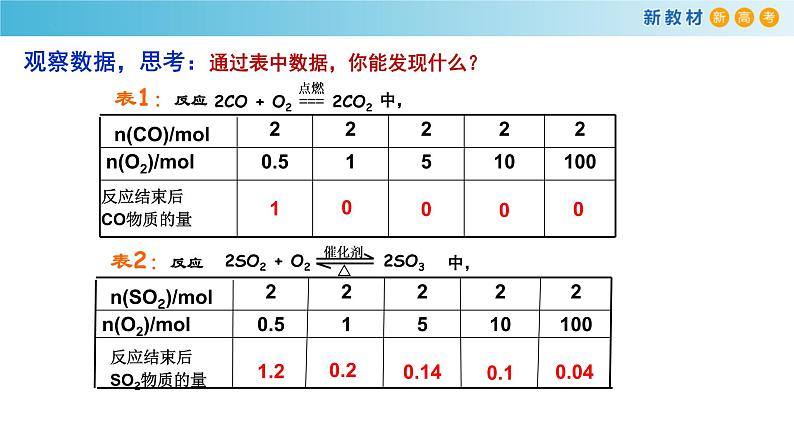
【实验探究】一个化学反应在实际进行时,反应物是否会按化学方 程式中的计量关系完全转变成产物?
试管内溶液由无色变为黄色
溶液分层,下层呈紫红色
FeCl3与KI混合后生成了I2
FeCl3与KI的混合溶液中存在Fe3+
FeCl3与KI混合后可能发生了化学反应
观察数据,思考:通过表中数据,你能发现什么?
很多化学反应在进行时都具有可逆性,即正向反应和逆向反应在同时进行,只是可逆程度有所不同且差异很大。
反应物 生成物
问题1:什么样的反应就是可逆反应?
在同一条件下,既能向正反应方向进行,同时,又能向逆反应方向进行的化学反应,叫做可逆反应。
练1.(1)2H2+O2 2H2O和2H2O 2H2↑+O2↑属于可逆反应吗?(2)把3 ml H2和1 ml N2充入密闭容器中反应,最终可以生成2 ml NH3吗?
v正 消耗 反应物
v逆 消耗 生成物
(反应物生成物并存,反应物转化率<100%)
问题2:可逆反应有什么特点?
①正反应和逆反应是两个方向完全相反的不同的化学反应,但同时存在
②正反应和逆反应发生的条件相同
③不能进行到底,反应物、生成物共同存在;任何一种物质的存在量都大于0
④可逆反应有一定的限度
2.已知N2(g)+3H2(g) ⇋ 2NH3(g) △H=-92.3kJ/ml,在某密闭容器中充入1ml N2和3ml H2使之反应,结果放出的热量小于92.3kJ,为什么?
答:因为可逆反应中反应物的转化率达不到100%,所以1ml N2和3ml H2不能完全反应,故放出的热量小于92.3kJ。
3.对于可逆反应2SO2+O2 ⇋ 2SO3,在混合气体中充入一定量的18O2足够长时间后,18O原子( )A、只存在于O2中 B、只存在于O2和SO3中C、只存在于SO2和O2中 D、存在于SO2、O2和SO3
4.在一密闭容器中进行反应:2SO2(g)+O2(g) ⇋ 2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别0.2ml•L-1、0.1ml•L-1、0.2ml•L-1。一段时间后再测量各物质的浓度,可能存在的数据是( )A、SO2为0.4ml•L-1,O2为0.2ml•L-1B、SO3为0.25ml•L-1C、SO2、SO3均为0.15ml•L-1D、SO3为0.4ml•L-1
解析 解这类题目时要善于利用极值法,可分别考虑反应正向进行彻底和反应逆向进行彻底两种情况。由可逆反应的含义知,0<c(SO2)<0.4 ml·L-1,0<c(O2)<0.2 ml·L-1,0<c(SO3)<0.4 ml·L-1。
科学史话:炼铁高炉尾气之谜
C+O2===CO2C+CO2===2COFe2O3+3CO===2Fe+3CO2
炼制生铁所需要的焦炭的实际用量,远高于按照化学方程式计算所需用量,且从高炉炉顶出来的气体中含有没有利用的CO气体。
启示:很多化学反应在进行时都具有可逆性,只是可逆的程度有所不同并且差异很大。并不能实现反应物到生成物的完全转化,即化学反应是有限度的。那么如何确定可逆反应的限度?
某温度和压强下的密闭容器中,2SO2+O2 2SO3
时间 (min)物质的量浓度(ml/L)
此条件下进行到什么时候达到了这个反应的限度?达到反应限度时该反应是否停止了?
学习任务二 化学反应的限度
(1)反应物浓度 ,正反应速率 ; 生成物浓度为 ,逆反应速率为 ;
1、化学平衡状态的建立
正逆反应都进行,v(逆) ≠0,v(正)> v(逆)
(2)反应物浓度 ,正反应速率 ; 生成物浓度 ,逆反应速率 ;
(3)正反应速率和逆反应速率 。反应物的浓度 ,生成物的浓度 。
反应一段时间(50min)后:
v(正)= v(逆) ≠0
达到一种表面静止的状态,我们称为“化学平衡状态”,简称化学平衡。
反应物浓度最大生成物浓度为0
反应物浓度减小生成物浓度增大
v正逐渐减小v逆逐渐增大
化学平衡状态的建立过程
1.定义:在一定条件下,可逆反应中,当正、逆两个方向的反应速率相等时,反应物的浓度和生成物的浓度都不在改变。达到了一种表面静止的状态,我们称之为“化学平衡状态”。
ν (正) = ν (逆)
条件改变,原平衡被破坏,在新的条件下建立新的平衡
判断可逆反应是否达到平衡的直接标志。
化学平衡的建立与途径无关,某一可逆反应无论是从正反应开始还是从逆反应开始,最终均可达到平衡状态。
可逆反应,在一定条件下建立化学平衡。
为什么增加炼铁高炉的高度不能改变高炉尾气中的CO比例呢?
直到19世纪下半叶,法国化学家勒夏特列经过深入的研究,才将这一谜底揭开。
1.(1)一个可逆反应达到的平衡状态就是该反应所能达到的最大限度。 提示:×。化学平衡状态是可逆反应在给定条件下所能达到的最大程度,条件改变限度可能改变。(2)化学反应达平衡状态时,该反应停止了。( )提示:×。可逆反应是动态平衡。(3)可逆反应达到平衡状态时,各反应物、生成物的浓度相等。( )提示:×。可逆反应达到平衡状态时,各反应物、生成物的浓度不再改变,并非相等。
2.某可逆反应达到平衡状态时,下列说法正确的是( )①正反应和逆反应同时进行,两者的速率完全相等②反应物和生成物同时存在,两者的浓度相同③混合物的组成比例不会因时间而改变A.① B.①③ C.② D.①②③
化学人教版 (2019)第七章 有机化合物第二节 乙烯与有机高分子材料授课课件ppt: 这是一份化学人教版 (2019)第七章 有机化合物第二节 乙烯与有机高分子材料授课课件ppt,共27页。PPT课件主要包含了学习目标,聚合反应,加成聚合反应等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第二册第二节 化学反应的速率与限度图文课件ppt: 这是一份高中化学人教版 (2019)必修 第二册第二节 化学反应的速率与限度图文课件ppt,共22页。PPT课件主要包含了学习目标,①③④⑤⑥,②③⑤⑥⑦⑨等内容,欢迎下载使用。
必修 第二册第一节 化学反应与能量变化备课课件ppt: 这是一份必修 第二册第一节 化学反应与能量变化备课课件ppt,共27页。PPT课件主要包含了电池是谁发现的,无处不在的电池,学习目标,第4课时化学电源等内容,欢迎下载使用。













