
- 2.4 Na2CO3和NaHCO3的性质(精讲)-2024-2025学年高一化学上学期常考题型精讲与精练高分突破(人教版) 试卷 0 次下载
- 2.5 氯气的性质 氯水(精练)-2024-2025学年高一化学上学期常考题型精讲与精练高分突破(人教版) 试卷 0 次下载
- 2.6 氯气的实验室制取(精练)-2024-2025学年高一化学上学期常考题型精讲与精练高分突破(人教版) 试卷 0 次下载
- 2.6 氯气的实验室制取(精讲)-2024-2025学年高一化学上学期常考题型精讲与精练高分突破(人教版) 试卷 0 次下载
- 2.7 氯离子的检验(精练)-2024-2025学年高一化学上学期常考题型精讲与精练高分突破(人教版) 试卷 0 次下载
化学必修 第一册第二节 氯及其化合物课后复习题
展开1.从微观结构认识氯气的化学性质及氯元素的存在形态。
2.从氧化还原反应角度认识氯气的化学性质,并能用方程式表达反应过程。
能力构建
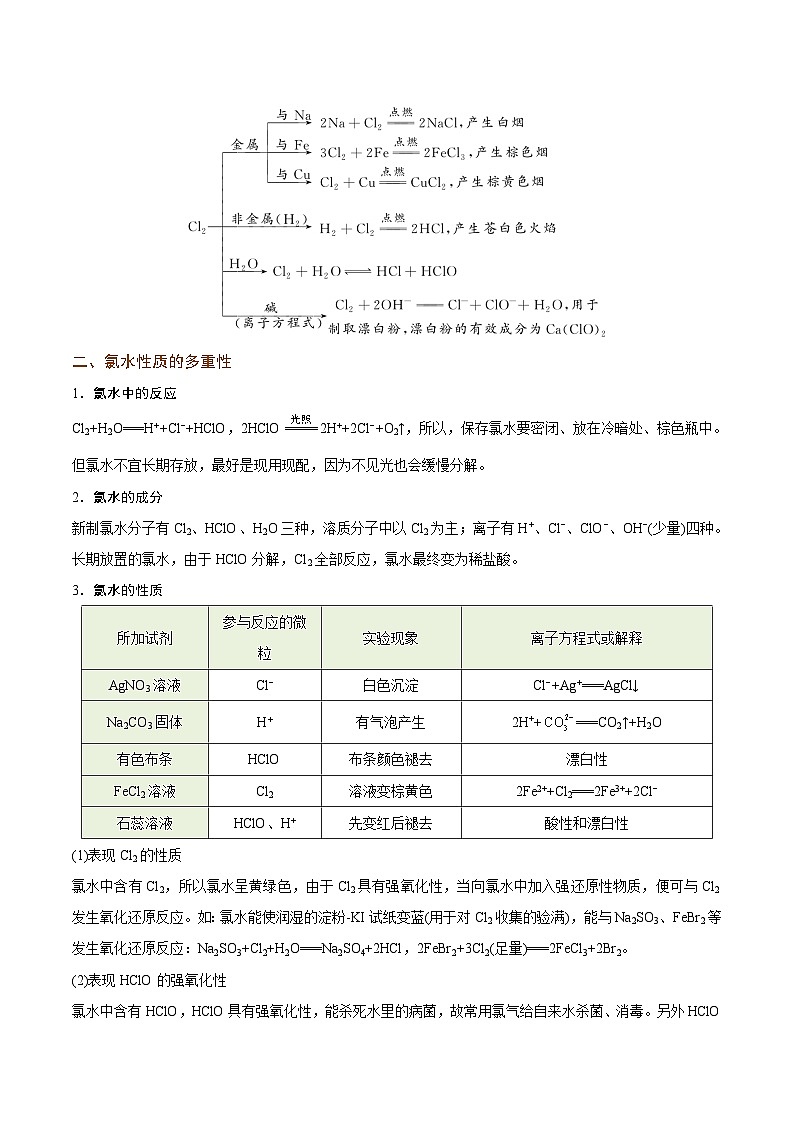
一、氯气的性质
1.氯气的物理性质
2.氯气的化学性质
Cl2的化学性质很活泼,具有很强的氧化性。
(1)氯气是很活泼的非金属单质,具有很强的氧化性。氯气能与绝大多数金属反应,把变价金属(如Fe、Cu)一般氧化到最高价。
①与钠反应2Na+Cl22NaCl,产生大量白烟;
②与铁反应2Fe+3Cl22FeCl3,产生大量棕褐色烟;
③与铜反应Cu+Cl2CuCl2,产生大量棕黄色烟。
(2)氯气能与非金属单质(如H2)反应:
①在空气中点燃氢气,然后把导管伸入盛有氯气的集气瓶中,观察到的现象是氢气在氯气中安静地燃烧,发出苍白色火焰。燃烧结束后,抽去盖在集气瓶口处的毛玻璃片,观察到的现象是集气瓶口上方出现白雾。反应的化学方程式是H2+Cl22HCl。
②氯气和氢气的混合气体在强光照射时爆炸,产生此现象的原因是H2和Cl2混合后点燃,反应瞬间完成,放出的热量使气体急剧膨胀而发生爆炸。
二、氯水性质的多重性
1.氯水中的反应
Cl2+H2O===H++Cl−+HClO,2HClO2H++2Cl−+O2↑,所以,保存氯水要密闭、放在冷暗处、棕色瓶中。但氯水不宜长期存放,最好是现用现配,因为不见光也会缓慢分解。
2.氯水的成分
新制氯水分子有Cl2、HClO、H2O三种,溶质分子中以Cl2为主;离子有H+、Cl−、ClO−、OH−(少量)四种。长期放置的氯水,由于HClO分解,Cl2全部反应,氯水最终变为稀盐酸。
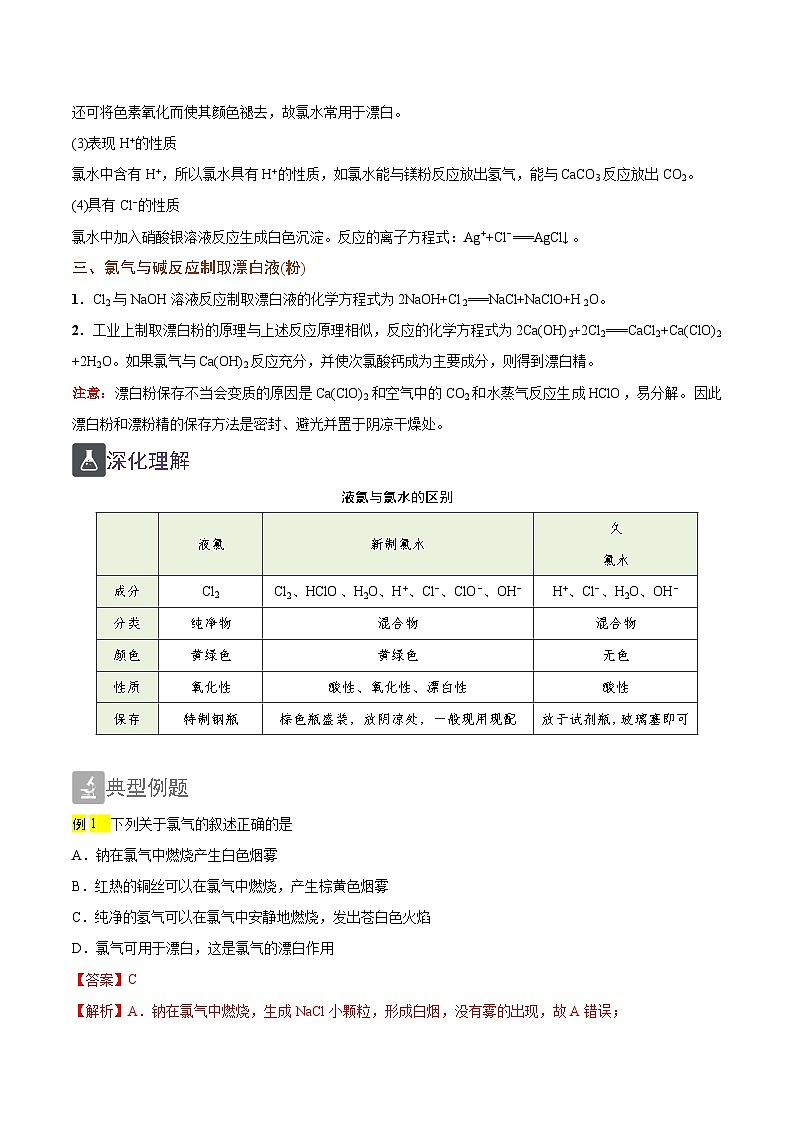
3.氯水的性质
(1)表现Cl2的性质
氯水中含有Cl2,所以氯水呈黄绿色,由于Cl2具有强氧化性,当向氯水中加入强还原性物质,便可与Cl2发生氧化还原反应。如:氯水能使润湿的淀粉KI试纸变蓝(用于对Cl2收集的验满),能与Na2SO3、FeBr2等发生氧化还原反应:Na2SO3+Cl2+H2O===Na2SO4+2HCl,2FeBr2+3Cl2(足量)===2FeCl3+2Br2。
(2)表现HClO的强氧化性
氯水中含有HClO,HClO具有强氧化性,能杀死水里的病菌,故常用氯气给自来水杀菌、消毒。另外HClO还可将色素氧化而使其颜色褪去,故氯水常用于漂白。
(3)表现H+的性质
氯水中含有H+,所以氯水具有H+的性质,如氯水能与镁粉反应放出氢气,能与CaCO3反应放出CO2。
(4)具有Cl−的性质
氯水中加入硝酸银溶液反应生成白色沉淀。反应的离子方程式:Ag++Cl−===AgCl↓。
三、氯气与碱反应制取漂白液(粉)
1.Cl2与NaOH溶液反应制取漂白液的化学方程式为2NaOH+Cl2===NaCl+NaClO+H2O。
2.工业上制取漂白粉的原理与上述反应原理相似,反应的化学方程式为2Ca(OH)2+2Cl2===CaCl2+Ca(ClO)2
+2H2O。如果氯气与Ca(OH)2反应充分,并使次氯酸钙成为主要成分,则得到漂白精。
注意:漂白粉保存不当会变质的原因是Ca(ClO)2和空气中的CO2和水蒸气反应生成HClO,易分解。因此漂白粉和漂粉精的保存方法是密封、避光并置于阴凉干燥处。
深化理解
液氯与氯水的区别
典型例题
例1 下列关于氯气的叙述正确的是
A.钠在氯气中燃烧产生白色烟雾
B.红热的铜丝可以在氯气中燃烧,产生棕黄色烟雾
C.纯净的氢气可以在氯气中安静地燃烧,发出苍白色火焰
D.氯气可用于漂白,这是氯气的漂白作用
【答案】C
【解析】A.钠在氯气中燃烧,生成NaCl小颗粒,形成白烟,没有雾的出现,故A错误;
B.CuCl2为鼓励提小颗粒,产生棕黄色的烟,没有雾,故B错误;
C.纯净的氢气可以在氯气中安静地燃烧,发出苍白色火焰,说法完全符合实验事实,故C正确;
D.氯气用于漂泊,这是对的,但是起漂白作用的不是氯气本身,而是次氯酸,故D错误。
故选C。
例2 如图,某兴趣小组设计如下装置进行氯气与金属钠的反应,先将钠预热,待钠熔融成小球时,撤火,并通入氯气即发生反应,下列叙述中错误的是
A.钠着火剧烈燃烧产生黄色的火焰
B.反应产生的大量白烟是氯化钠固体
C.棉球①的作用是吸收过量氯气防止产生污染
D.棉球②变蓝色则证明氯气已被碱液完全吸收
【答案】B
【解析】A.钠与氯气在加热时发生着火剧烈燃烧,产生黄色的火焰,同时得到白色固体,正确;B.钠与氯气在加热时发生反应产生NaCl白色固体,该物质在气体中扩散,形成大量白烟,正确;C.棉球①吸有大量的碱液,可以与氯气发生反应,防止其污染空气,所以其作用是吸收过量氯气防止产生污染,正确;D.棉球②变蓝色则证明氯气与KI发生反应产生了I2,说明氯气未被碱液完全吸收,错误。
例3 (2021·合肥艺术中学 高一月考)将足量新制氯水滴入下列物质中,对应现象错误的是
A.FeCl2溶液,溶液由浅绿色变为棕黄色B.淀粉-KI溶液,溶液变蓝
C.AgNO3溶液,有白色沉淀生成D.石蕊试液,溶液变红不褪色
【答案】D
【解析】A.向FeCl2溶液中加入氯水,发生反应:2FeCl2+Cl2=2FeCl3,因此看到溶液会由浅绿色变为棕黄色,A正确;
B.向淀粉-KI溶液中加入氯水,KI被Cl2氧化产生I2,I2遇淀粉溶液变蓝色,B正确;
C.氯水中含有HCl,与AgNO3溶液会发生复分解反应产生AgCl白色沉淀,C正确;
D.氯水中含有HCl、HClO,使溶液显酸性,酸能够使紫色石蕊试液变为红色;但由于HClO同时具有氧化性,又会将红色物质氧化变为无色,因此会看到石蕊试液先变红后褪色,D错误;
故合理选项是D。
例4 (2021·汕头市达濠华侨中学高一期末)“84”消毒液对新型冠状病毒具有消杀作用。如图所示为某品牌“84”消毒液使用说明的一部分,下列说法错误的是
A.次氯酸钠中的Cl元素显+1价B.“84”消毒液见光易变质
C.“84”消毒液能使品红溶液褪色D.“84”消毒液能用不锈钢容器盛放
【答案】D
【解析】A.次氯酸钠中Na为+1价、O为-1价,则Cl为+1价,A正确;
B.“84”消毒液会和空气中的CO2反应生成HClO,HClO见光易分解,从而导致变质,B正确;
C.“84”消毒液具有强氧化性,具有漂白性,可以漂白品红溶液,C正确;
D.“84”消毒液对金属制品有腐蚀作用,不能用不锈钢容器盛放,D错误;
综上所述答案为D。
例5 (2021·河南安阳三十五中高一开学考试)室温下,A是常见的金属单质、单质B是黄绿色气体、单质C是无色气体。在合适反应条件下,它们可以按下面框图进行反应;E溶液是无色溶液,F是淡绿色溶液。B和C反应发出苍白色火焰。请回答:
(1)A是_______,B是_______(请填写化学式);
(2)反应①的化学方程式_______;
(3)反应③的离子方程式_______;
(4)反应④的离子方程式_______。
【答案】Fe Cl2 2Fe+3Cl22FeCl3 2H++Fe=Fe2++H2↑ 2Fe2++Cl2=2Fe3++2Cl-
【分析】黄绿色气体单质B为Cl2,单质C是无色气体,B和C反应发出苍白色火焰,反应生成E,则C为H2,E为HCl;A与HCl水溶液反应得淡绿色溶液F与氢气,则A为Fe,F为FeCl2,由转化关系可知D为FeCl3,据此分析解答。
【解析】(1)由以上分析可知,A为Fe,B为Cl2,故答案为:Fe;Cl2;
(2)反应①为Fe和Cl2的反应,反应的化学方程式为:2Fe+3Cl22FeCl3,故答案为:2Fe+3Cl22FeCl3;
(3)反应③为Fe和HCl溶液的反应,反应的离子方程式为Fe+2H+=Fe2++H2↑,故答案为:Fe+2H+=Fe2++H2↑;
(4)反应④为FeCl2和Cl2的反应,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-。
学会了吗
1.下列关于氯气的化学性质或实验现象的描述不正确的是
A.在常温下,氯气与金属铁、铜等不反应
B.Fe可在氯气中燃烧,生成棕黄色的烟是FeCl2
C.H2在Cl2中燃烧,火焰呈苍白色,并在集气瓶口有白雾出现
D.在做H2,Cl2的光照爆炸实验时,所用的光应当为直射的强光
【答案】B
【解析】A.氯气与铁、铜反应需要点燃,在常温下不反应,故A正确;
B.铁与氯气反应得到高价态的氯化铁,氯化铁为棕黄色固体,故B错误;
C.H2在Cl2中燃烧,火焰呈苍白色火焰,生成的氯化氢极易溶于水,与空气中水蒸气结合形成盐酸小液滴,所以会产生白雾,故C正确;
D.氢气与氯气在光照条件下发生爆炸,在做H2、Cl2的光照爆炸实验时,所用的光应当为直射的强光,故D正确;
故选B。
2.(2021·山东高一期末)如图所示,将浓盐酸滴在晶体上生成,立即用表面皿盖好。由实验现象得出的结论正确的是
【答案】C
【解析】A.氯气与水反应生成盐酸和次氯酸,酸再与碱反应,是因为与水反应的生成物表现为酸性,不是氯气表现为酸性,故A错误;
B.滴有KSCN的FeCl2溶液变红,是因为氯气的氧化性把亚铁离子氧化为铁离子,铁离子与KSCN反应使得溶液呈红色,故B错误;
C.因为氯气能把碘化钾中碘离子氧化成碘,故KI淀粉溶液变成蓝色,故C正确;
D.紫色石蕊溶液先变红后褪色,是因为氯气与水反应生成盐酸和次氯酸,溶液中有氢离子,所以紫色石蕊溶液先变红,褪色是因为次氯酸具有漂白性,而非氯气具有漂白性,故D错误;
故选C。
3.下列关于氯及其化合物的叙述正确的是
A.氯气无漂白性,而次氯酸有,因此氯水能使鲜花褪色而干燥的氯气不行
B.漂白粉的主要成分是Ca(ClO)2,主要用于杀菌消毒
C.工业生产中不是将氯气通入澄清石灰水中来制取漂白粉
D.漂白液和洁厕灵(主要含HCl)两种都是消毒剂,一起用效果更好
【答案】C
【解析】A. 氯气无漂白性,而次氯酸有,鲜花中含有水,因此干燥的氯气能使鲜花褪色,A错误;
B. 漂白粉的主要成分是Ca(ClO)2和CaCl2,有效成分是Ca(ClO)2,B错误;
C. 澄清石灰水是稀溶液,工业生产中将氯气通入澄清石灰乳中来制取漂白粉,C正确;
D. 一起用时,漂白液中NaClO和洁厕灵中HCl发生氧化还原反应生成氯气,氯气有毒,D错误;
故选C。
4.氯水中含有多种成分,因而具有多种性质,根据氯水分别与如图四种物质作用(四种物质与氯水的重合部分代表物质间的反应,且氯水足量),请回答下列问题:
(1)能证明氯水具有漂白性的是___(填“a”“b”“c”“d”或“e”)。
(2)反应c过程中的现象是___,反应e的化学方程式为___,反应b的化学方程式为___。
(3)久置的氯水最终会变成___,用化学反应方程式表示为___。
(4)实验室保存氯水的方法是___。
【答案】(1)d
(2)有白色沉淀生成 Cl2+2NaOH=NaCl+NaClO+H2O Na2CO3+2HCl=2NaCl+H2O+CO2↑
(3)盐酸 2HClO2HCl+O2↑
(4)密封保存在棕色试剂瓶中,置于阴凉处
【解析】氯气溶于水时,与水发生可逆反应生成氯化氢和次氯酸,氯化氢完全电离,次氯酸不完全电离,水极弱电离。则氯水中存在三种分子(Cl2、H2O、HClO)、四种离子(H+、Cl-、ClO-、OH-),氯水兼有这些分子、离子的性质。
(1)氯水中HClO有漂白性(强氧化性),能漂白某些有色物质。氯水能使石蕊试液先变红(酸性)、后褪色(HClO有漂白性),故选填d。
(2)反应c是氯水中Cl-与硝酸银溶液的反应:Ag++Cl-=AgCl↓,故有白色沉淀。反应e是氯水与氢氧化钠溶液反应,化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O。反应b是氯水中H+与碳酸钠溶液反应,化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑。
(3)氯水久置过程中,次氯酸最终完全分解变成稀盐酸,化学方程式为2HClO2HCl+O2↑。
(4)因次氯酸见光易分解,故实验室将氯水密封保存在棕色试剂瓶中,置于阴凉处。
颜色
状态
气味
毒性
溶解性
黄绿色
气体
刺激性气味
有毒
1体积水约溶解2体积氯气
所加试剂
参与反应的微粒
实验现象
离子方程式或解释
AgNO3溶液
Cl−
白色沉淀
Cl−+Ag+===AgCl↓
Na2CO3固体
H+
有气泡产生
2H++===CO2↑+H2O
有色布条
HClO
布条颜色褪去
漂白性
FeCl2溶液
Cl2
溶液变棕黄色
2Fe2++Cl2===2Fe3++2Cl−
石蕊溶液
HClO、H+
先变红后褪去
酸性和漂白性
液氯
新制氯水
久
氯水
成分
Cl2
Cl2、HClO、H2O、H+、Cl−、ClO−、OH−
H+、Cl−、H2O、OH−
分类
纯净物
混合物
混合物
颜色
黄绿色
黄绿色
无色
性质
氧化性
酸性、氧化性、漂白性
酸性
保存
特制钢瓶
棕色瓶盛装,放阴凉处,一般现用现配
放于试剂瓶,玻璃塞即可
(主要成分)本品是以次氯酸钠(NaClO)为主要有效成分的消毒液。
(注意事项)
1.本品为外用消毒剂,不可内服。
2.本品对金属制品有腐蚀作用,对棉纺织品有漂白脱色作用。
3.密闭、避光、避热、置于阴凉处保存。
选项
实验现象
结论
A
滴有酚酞的NaOH溶液褪色
具有酸性
B
滴有KSCN的溶液变红
具有还原性
C
KI-淀粉溶液变成蓝色
具有氧化性
D
紫色石蕊溶液先变红后褪色
具有漂白性
人教版 (2019)必修 第一册第一节 原子结构与元素周期表课时练习: 这是一份人教版 (2019)必修 第一册<a href="/hx/tb_c161996_t7/?tag_id=28" target="_blank">第一节 原子结构与元素周期表课时练习</a>,共6页。试卷主要包含了了解元素、核素和同位素的含义,了解原子的构成等内容,欢迎下载使用。
化学必修 第一册第二节 氯及其化合物同步测试题: 这是一份化学必修 第一册<a href="/hx/tb_c161981_t7/?tag_id=28" target="_blank">第二节 氯及其化合物同步测试题</a>,共5页。试卷主要包含了检验Cl−的实验,检验Cl−的方法等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第二节 氯及其化合物课后复习题: 这是一份高中化学人教版 (2019)必修 第一册<a href="/hx/tb_c161981_t7/?tag_id=28" target="_blank">第二节 氯及其化合物课后复习题</a>,共9页。试卷主要包含了反应原理,仪器装置,收集方法,验满方法,尾气处理等内容,欢迎下载使用。













