






2024届高考化学一轮复习 第一章 物质及其变化 第5讲 氧化还原反应的相关计算及化学方程式的书写课件PPT
展开1.(2022·浙江选考)关于反应Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2O,下列说法正确的是 ( )A.H2SO4发生还原反应B.Na2S2O3既是氧化剂又是还原剂C.氧化产物与还原产物的物质的量之比为2∶1D.1 ml Na2S2O3发生反应,转移4 ml电子
解析:已知反应的本质是硫代硫酸根离子在酸性条件下发生歧化反应生成硫和二氧化硫,化合价发生变化的只有S元素一种,硫酸的作用是提供酸性环境。H2SO4转化为硫酸钠和水,其中所含元素的化合价均未发生变化,故其没有发生还原反应,A不正确;Na2S2O3中S的化合价为+2,其发生歧化反应生成S(0价)和SO2(+4价),故其既是氧化剂又是还原剂,B正确;该反应的氧化产物是SO2,还原产物为S,氧化产物与还原产物的物质的量之比为1∶1,C不正确;根据其中S元素的化合价变化情况可知,1 ml Na2S2O3发生反应,转移2 ml电子,D不正确。
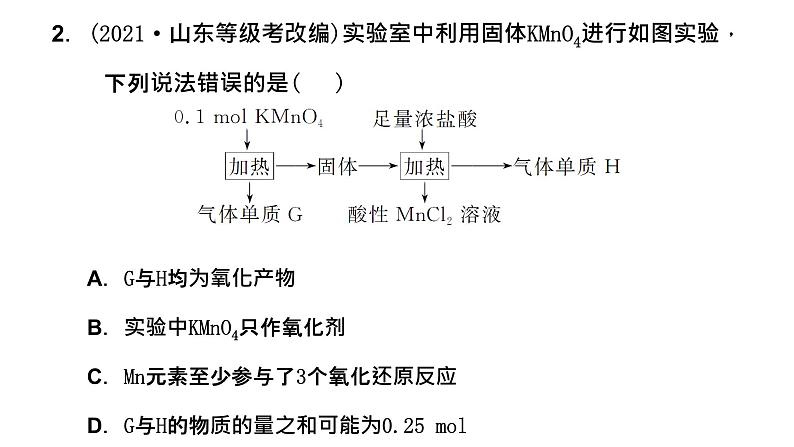
2.(2021·山东等级考改编)实验室中利用固体KMnO4进行如图实验, 下列说法错误的是( )( )A.G与H均为氧化产物B.实验中KMnO4只作氧化剂C.Mn元素至少参与了3个氧化还原反应D.G与H的物质的量之和可能为0.25 ml
3.(2020·全国卷Ⅱ·节选)(1)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 ml ClO2消耗NaClO2的量为________ml;产生“气泡”的化学方程式为__________________________。(2)“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是___________________________________________________________(用离子方程式表示)。工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1 000 kg该溶液需消耗氯气的质量为________kg(保留整数)。
解析:(1)结合题中信息制备ClO2时发生歧化反应,可知反应的化学方程式为5NaClO2+4NaHSO4===NaCl+4Na2SO4+4ClO2↑+2H2O,即生成1 ml ClO2时消耗1.25 ml NaClO2;溶液中溢出大量气泡是NaHCO3与NaHSO4反应产生的CO2气体。
答案:(1)1.25 NaHCO3+NaHSO4===CO2↑+Na2SO4+H2O(2)ClO-+Cl-+2H+===Cl2↑+H2O 203
4.(2022·河北等级考·节选)以焙烧黄铁矿FeS2(杂质为石英等)产生的红渣为原料制备铵铁蓝Fe(NH4)Fe(CN)6颜料。工艺流程如下:
回答下列问题:(1)红渣的主要成分为________________(填化学式),滤渣①的主要成分为______________(填化学式)。(2)还原工序中,不生成S单质的反应的化学方程式为________________________________________________________________________。
(3)沉铁工序产生的白色沉淀Fe(NH4)2Fe(CN)6中Fe的化合价为__________,氧化工序发生反应的离子方程式为________________________________。答案:(1)Fe2O3 SiO2
5.(2021·福建等级考·节选)四钼酸铵是钼深加工的重要中间产品,具有广泛的用途。一种以钼精矿(主要含MS2,还有Cu、Fe的化合物及SiO2等)为原料制备四钼酸铵的工艺流程如图所示。回答下列问题:
(1)“净化”后,溶液中若有低价钼(以MO表示),可加入适量H2O2将其氧化为MO,反应的离子方程式为_____________________________________。(2)高温下用H2还原(NH4)2M4O13可制得金属钼,反应的化学方程式为_________________________________________________________________。[已知:(NH4)2M4O13受热分解生成MO3]
题型(一) 氧化还原反应的相关计算1.氧化还原反应计算的思路对于氧化还原反应的计算,要根据氧化还原反应的实质——反应中氧化剂得到的电子总数与还原剂失去的电子总数相等,即得失电子守恒。利用守恒思想,可以抛开多步的反应过程,可不写化学方程式,不追究中间反应过程,只要把物质分为初态和终态,从得电子与失电子两个方面进行整体思维,便可迅速获得正确结果。
2.守恒法解题的思维流程
[典例] 24 mL浓度为0.05 ml·L-1的Na2SO3溶液恰好与20 mL浓度为0.02 ml·L-1的K2Cr2O7溶液完全反应。已知Na2SO3可被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为 ( )A.+2 B.+3 C.+4 D.+5[解题流程]
[综合应用训练]题点(一) 两元素之间的得失电子守恒计算1.在硫酸溶液中NaClO3和Na2SO3按2∶1的物质的量之比完全反应,生成一种棕黄色气体X。则X为 ( )A.Cl2 B.Cl2O C.ClO2 D.Cl2O5解析:由题意设气体中氯的化合价为x,得2×1×(5-x)=1×1×(6-4),x=4。
2.联氨(又称肼,N2H4,无色液体)可用于处理高压锅炉水中的氧,防止锅炉被腐蚀。理论上1 kg的联氨可除去水中溶解的O2________ kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是____________________________________________________________________________。解析:N2H4吸收O2时的化学方程式为N2H4+O2===N2+2H2O,由化学方程式可知参加反应的N2H4和O2的质量相等,故1 kg N2H4理论上可除去水中溶解的O2 1 kg。Na2SO3吸收O2生成Na2SO4:2Na2SO3+O2===2Na2SO4,两者相比较,N2H4的用量少,且不产生其他杂质。答案:1 N2H4的用量少,不产生其他杂质(或产物为N2和H2O,而Na2SO3产生Na2SO4)
题点(二) 多元素之间的得失电子守恒计算3.已知NaClO溶液与Ag反应的产物为AgCl、NaOH和O2,下列说法正确的是( )A.氧气是还原产物B.还原剂与氧化剂的物质的量之比为1∶1C.反应物中有水,且反应方程式中水的化学计量数为2D.若生成4.48 L(标准状况下)O2,则反应转移0.8 ml电子
解析:反应中O元素的化合价升高,氧气是氧化产物,故A错误;此反应中NaClO既是氧化剂,又是还原剂,则还原剂与氧化剂的物质的量之比为6∶4=3∶2,故B错误;反应物中有水,由反应方程式4Ag+4NaClO+2H2O===4AgCl+4NaOH+O2↑,可知水的化学计量数为2,故C正确;4.48 L(标准状况下)O2的物质的量为0.2 ml,则反应转移1.6 ml电子,故D错误。
4.在P+CuSO4+H2O―→Cu3P+H3PO4+H2SO4(未配平)的反应中,7.5 ml CuSO4可氧化P的物质的量为________ ml。生成1 ml Cu3P时,参加反应的P的物质的量为________ ml。解析:设7.5 ml CuSO4氧化P的物质的量为x,生成1 ml Cu3P时,被氧化的P的物质的量为y。根据得失电子守恒得:7.5 ml×(2-1)=x×(5-0),解得x=1.5 ml;1 ml×3×(2-1)+{1 ml×[0-(-3)]}=y×(5-0),解得y=1.2 ml。所以参加反应的P的物质的量为1.2 ml+1 ml=2.2 ml。答案:1.5 2.2
题点(三) 多步反应得失电子守恒计算5.14 g铜银合金与足量的某浓度的硝酸反应,将放出的气体与1.12 L(标准状况下)氧气混合,通入水中恰好全部被吸收,则合金中铜的质量为 ( )A.9.6 g B.6.4 g C.3.2 g D.1.6 g
6.为测定某血液样品中钙离子的含量,可取该样品2.00 mL用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀。将沉淀用稀硫酸处理得H2C2O4后,再用1.000×10-4 ml·L-1酸性KMnO4标准溶液滴定,到达终点时用去20.00 mL标准液。(1)用酸性KMnO4(aq)滴定H2C2O4(aq)的离子方程式为__________________________。(2)KMnO4标准溶液应用________式滴定管盛装。(3)滴定终点时的现象为____________________________________________________________________________________________________。(4)该样品中钙离子浓度为____________________ g·mL-1。
(2)酸 (3)滴入最后半滴标准KMnO4溶液,锥形瓶中溶液由无色变为浅红色,且半分钟内不褪色 (4)1.000×10-4
题型(二) 氧化还原反应方程式的配平类型(一) 氧化还原反应方程式的一般配平1.氧化还原反应方程式配平的基本原则
2.氧化还原反应方程式配平的基本方法(1)正向配平法 适合反应物分别是氧化剂、还原剂的反应。如:
(3)整体配平法若某一氧化还原反应中,有三种元素的化合价发生了变化,但其中一种反应物中同时有两种元素化合价升高或降低,这时要进行整体配平。
3.氧化还原反应方程式配平的一般步骤
(2)__NaBO2+__SiO2+__Na+__H2===__NaBH4+__Na2SiO3(3)__KI+__KIO3+__H2SO4===__I2+__K2SO4+__H2O(4)__Fe3O4+__HNO3(稀)===__Fe(NO3)3+__NO↑+__H2O(5)__P4+__KOH+__H2O===__K3PO4+__PH3
答案:(1)2 4 7 4 1 4 7 (2)1 2 4 2 1 2 (3)5 1 3 3 3 3 (4)3 28 9 1 14 (5)2 9 3 3 5 (6)6 1 14 6 2 7
类型(二) 补项配平氧化还原反应方程式1.配平流程缺项方程式是指某些反应物或生成物在方程式中没有写出来,它们一般为水、酸(H+)或碱(OH-),其配平流程为
[例2] 完成以下氧化还原反应的离子方程式:( )ClO-+( )Fe(OH)3+____ ===( )Cl-+( )FeO+ ____[配平流程]
答案:(1)2 5 6H+ 2 5 8(2)Al2O3 3C N2 2 3CO
题型(三) 新情境下陌生方程式的书写1.陌生化学方程式书写的思路首先根据题给材料中的信息写出部分反应物和生成物的化学式,再根据反应前后元素化合价有无变化判断反应类型:
2.非氧化还原反应方程式的书写第一步:根据信息或流程信息确定主要物质;第二步:根据物质的反应规律或介质补加未指明的物质;第三步:根据质量(原子)守恒或电荷守恒配平。3.陌生氧化还原反应方程式书写的具体步骤
[典例] 某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(NiSO4·7H2O):
溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
回答下列问题:(1)“碱浸”中NaOH的两个作用分别是除去油脂,溶解铝及其氧化物。为回收金属,用稀硫酸将“滤液①”调为中性,生成沉淀。写出该反应的离子方程式:___________________________________________________。(2)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式:________________________。
[综合应用训练]题点(一) 陌生情境下方程式的书写1.(1)SO2通入稀H2SO4酸化的KMnO4溶液,溶液褪色,其反应的化学方程式为_________________________________________________________。(2)酸性KMnO4溶液与H2O2溶液混合有气体生成,反应的离子方程式为_______________________________________________________________。(3)用酸性CO(NH2)2水溶液吸收NOx,吸收过程中存在HNO2与CO(NH2)2生成N2和CO2的反应。写出该反应的化学方程式:______________________。
答案:(1)5SO2+2KMnO4+2H2O===K2SO4+2MnSO4+2H2SO4(3)2HNO2+CO(NH2)2===2N2↑+CO2↑+3H2O
(2)用NaClO-NaOH溶液氧化AgNO3,制得高纯度的纳米级Ag2O2。写出该反应的离子方程式: ________________________________。(3)生产硫化钠大多采用无水芒硝(Na2SO4)-碳粉还原法,若煅烧所得气体为等物质的量的CO和CO2,写出煅烧时发生反应的化学方程式:____________________________________________________________。
(4)在酸性条件下,NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为___________________________________。(5)将ClO2通入KI和H2SO4的混合液中,发生反应的离子方程式为______________________________________________________________。
题点(二) 化工流程中方程式的书写3.工业上以富钒炉渣(主要成分为V2O5,含少量Fe2O3和FeO等杂质)为原料提取五氧化二钒的工艺流程如图所示:
焙烧炉中发生的主要反应的化学方程式为______________________;也可用氯化钠和氧气代替纯碱进行焙烧,写出对应反应的化学方程式:______________________________。
4.(2023·无锡模拟)用低品铜矿(主要含CuS、FeO)制备Cu2O的一种工艺流程如图:
(1)“酸浸”中CuS发生反应的化学方程式为_____________________________________________________________________________________。(2)“调pH”后滤液中Fe3+刚好沉淀完全(离子浓度小于1×10-5 ml·L-1认为沉淀完全),此时pH约为____________{常温下,Ksp[Fe(OH)3]=1×10-38}。(3)“除锰”时的离子方程式为___________________________________。
解析:(1)硫化铜有还原性,二氧化锰有氧化性,两者在酸性条件下发生氧化还原反应,依据得失电子守恒和原子守恒,可知反应的化学方程式为CuS+MnO2+2H2SO4===CuSO4+MnSO4+S+2H2O。
答案:(1)CuS+MnO2+2H2SO4===CuSO4+MnSO4+S+2H2O (2)3
备战2025届新高考化学一轮总复习第1章物质及其变化第5讲氧化还原反应方程式的配平和计算课件: 这是一份备战2025届新高考化学一轮总复习第1章物质及其变化第5讲氧化还原反应方程式的配平和计算课件,共40页。PPT课件主要包含了课标指引,目录索引,素养发展进阶,必备知识•梳理,氧化剂,还原剂,种类个数,化合价,第二步列得失,e-×2等内容,欢迎下载使用。
2024届高考化学一轮复习 第一章 物质及其变化 第4讲 氧化还原反应课件PPT: 这是一份2024届高考化学一轮复习 第一章 物质及其变化 第4讲 氧化还原反应课件PPT,共57页。PPT课件主要包含了浓硫酸,mol,答案C,答案D,物质得到电子,物质失去电子,氧化性,还原性,答案B,答案A等内容,欢迎下载使用。
2024届高考化学一轮复习课件 第一章 物质及其变化 第3讲 氧化还原反应: 这是一份2024届高考化学一轮复习课件 第一章 物质及其变化 第3讲 氧化还原反应,文件包含第3讲氧化还原反应pptx、第3讲氧化还原反应docx、第3讲氧化还原反应课后作业docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。












