




备战2025届新高考化学一轮总复习第1章物质及其变化第2讲电解质与离子反应课件
展开1.认识酸、碱、盐等电解质在水溶液中或熔融状态下能发生电离。2.能用电离方程式表示某些酸、碱、盐的电离。3.通过实验事实认识离子反应及其发生的条件。
考点一 电解质及其电离
考点二 离子反应及发生的条件
(1)在上述短文标有序号的物质中,属于电解质,且熔融状态下能导电的是________(填序号,下同);属于非电解质的是________。 (2)属于强电解质的是________;属于弱电解质的是________;既不是电解质,也不是非电解质的是________。
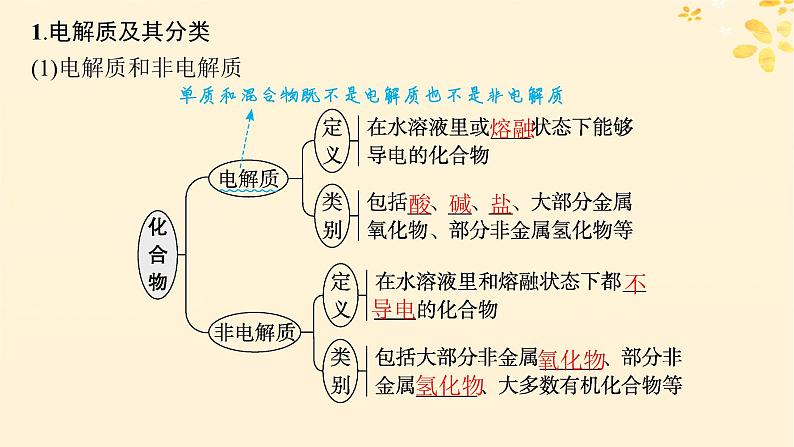
1.电解质及其分类(1)电解质和非电解质
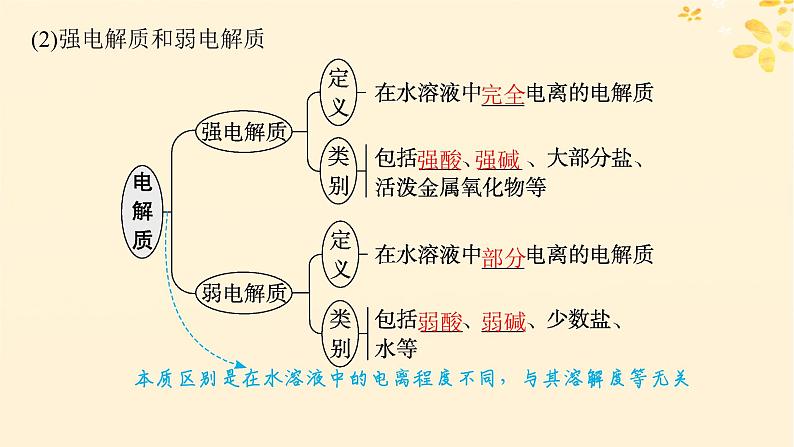
(2)强电解质和弱电解质
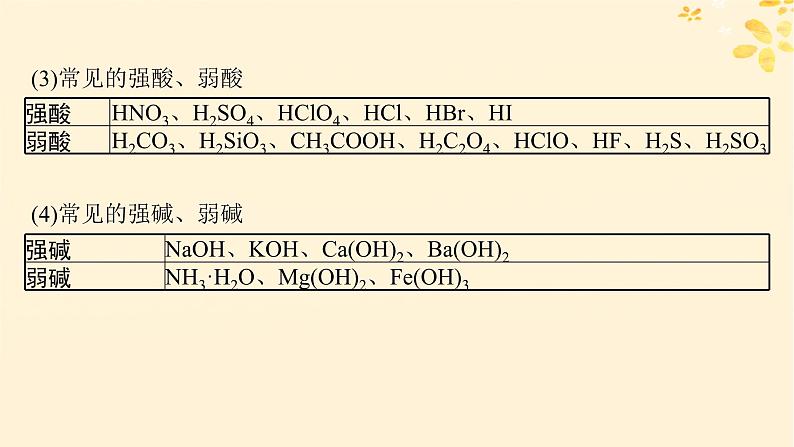
(3)常见的强酸、弱酸
(4)常见的强碱、弱碱
2.电解质的电离及符号表征(1)电离及其条件
溶于水 受热熔化
(2)符号表征——电离方程式
Ba(OH)2══ Ba2++2OH-
考向1 电解质的电离及符号表征例1NaCl是一种常见的电解质,其两种状态下的导电示意图如图所示,其中电极a、b、c、d均与电源相连。下列说法不正确的是( )
A.图乙中的NaCl处于熔融状态B.NaCl电离产生自由移动的离子C.NaCl在外电场的作用下才能发生电离D.NaCl溶于水过程可表示为NaCl═Na++Cl-
解析 图乙中只有钠离子和氯离子,且能移动,则说明NaCl处于熔融状态,图甲是水合钠离子和水合氯离子,说明NaCl处于水溶液中,A正确;NaCl电离产生的离子是自由移动的,在电场的作用下离子进行定向移动,B正确;根据甲可知NaCl在水的作用下就能发生电离,并不是在外电场的作用下才能发生电离,C错误;NaCl是强电解质,溶于水时发生电离,可表示为NaCl═Na++Cl-, D正确。
[对点训练1] 按要求写出下列物质的电离方程式:(1)Ca(OH)2: ________________________; (2)NH3·H2O: ________________________; (3)H2SO4溶于水: ________________________; (4)H2CO3溶于水: ___________________________________; (5)KHSO4溶于水: ________________________; (6)KHSO4受热熔化: ________________________。
考向2 溶液的导电性及变化例2电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。向0.01 ml·L-1 Ba(OH)2溶液中加入几滴酚酞溶液,然后向混合溶液中匀速、逐滴加入0.2 ml·L-1 H2SO4溶液,滴加过程中测得溶液电导率的变化如图所示。下列说法不正确的是( )
A.烧杯中红色逐渐变浅直至完全褪去B.由于水存在微弱电离、BaSO4存在微弱溶解,实际上电导率不会为0C.电导率减小的过程中,发生反应:D.若用相同浓度的Na2SO4溶液代替稀硫酸重复上述实验,电导率变化与原实验相同
[对点训练2] 化学图像可直观地描述化学反应的进程或结果。下列导电性变化图像与实验操作不相符的是( )
A.图①可表示向冰醋酸中不断加入蒸馏水B.图②可表示向HNO3溶液中通入少量NH3C.图③可表示向H2S水溶液中通入过量O2D.图④可表示向Ba(OH)2溶液中不断通入CO2
解析 冰醋酸不能导电,因此未加蒸馏水时导电能力为0,A错误;向强电解质HNO3的溶液中通入NH3反应生成强电解质NH4NO3和水,相比之下氢离子减少但铵根离子增多,离子浓度几乎不变,溶液导电能力不变,B正确;向H2S水溶液中通入过量O2反应生成硫单质和水,离子浓度减小为0,溶液导电能力减弱直至为0,C正确;向Ba(OH)2溶液中不断通入CO2先生成BaCO3沉淀,导电能力下降,过量的二氧化碳又能与BaCO3、H2O反应生成碳酸氢钡,导电能力又增强,D正确。
1.离子反应(1)定义:有离子参加或离子生成的化学反应统称离子反应。(2)本质:离子反应的本质是溶液中某些离子的浓度________。
离子反应一般在水溶液中进行
(3)离子反应发生的条件:
2.离子共存的判断(1)溶液中离子共存的实质同一溶液中,几种离子能大量共存,其实质是离子之间________发生任何反应;若离子之间能发生反应,则________大量共存。
(2)判断溶液中离子能否大量共存的“四角度”①生成沉淀(或微溶物)而不能大量共存
②生成难电离的物质(或其他)而不能大量共存
③强氧化性与强还原性离子因发生氧化还原反应而不能大量共存
④易水解的阴、阳离子发生相互促进的水解反应而不能大量共存,常考离子如下:
考向1 判断离子共存,注意隐含条件例1(2022·湖北卷)下列各组离子在给定溶液中能大量共存的是( )
[对点训练1] (2023·广东韶关二模)室温下,下列各组离子在指定溶液中能大量共存的是( )
易错警示警惕离子共存问题中的常见“陷阱”
考向2 判断离子共存,分析其中原因例2(2021·湖南卷)对下列粒子组在溶液中能否大量共存的判断和分析均正确的是( )
[对点训练2] 常温下,Ksp[Fe(OH)3]≈1.0×10-39。下列有关离子大量共存的分析正确的是( )
A.NaCl在三种状态下都存在自由移动的离子B.图b表示NaCl在外加电场的条件下发生电离C.电解质均能在图b所示状态下导电D.图c表示NaCl在水溶液中的导电情况
解析 图a中固体NaCl中没有自由移动的离子,A错误;电离不需要外加电场,溶于水或熔融状态下,均可以电离,B错误;氯化氢本身没有离子,熔融状态下也不能导电,只有类似于氯化钠的电解质本身由离子构成,熔融状态下才能产生自由移动的离子,才能导电,C错误;图c中,水分子使氯化钠发生了电离,故图c表示NaCl在水溶液中的导电情况,D正确。
2.向等体积、等浓度的稀硫酸a、b、c中分别加入(或通入)HCl气体、Ba(OH)2固体、H2O三种物质,加入物质(X)的质量与溶液导电能力(用电流强度I表示)的关系如图。下列说法正确的是( )A.a中加入的物质是H2OB.b中加入的物质是HCl气体C.c中加入的物质是Ba(OH)2D.c中硫酸与加入物质反应的产物均不是电解质
解析 若a中加入的物质是H2O,则稀硫酸的浓度降低,离子浓度减小,导电能力减弱,与曲线不相符,应该为曲线b,A错误;若b中加入的物质是HCl气体,溶于水电离出氢离子和氯离子,溶液中离子浓度增大,导电能力增强,与曲线不相符,应该为曲线a,B错误;若c中加入的物质是Ba(OH)2,反应生成硫酸钡沉淀和水,离子浓度减小,当Ba(OH)2过量时离子浓度又增大,导电能力先减弱后增强,与曲线相符,C正确;c中硫酸与加入物质Ba(OH)2反应的产物为硫酸钡和水,均是电解质,D错误。
进阶2 练热点·提素能3.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
4.常温下,下列各组微粒在指定溶液中因发生相互促进的水解反应而不能大量共存的是( )
进阶3 研真题·明考向5.(2022·天津卷)25 ℃时,下列各组离子可以在水溶液中大量共存的是( )
新教材适用2024版高考化学一轮总复习第1章物质及其变化第2讲离子反应课件: 这是一份新教材适用2024版高考化学一轮总复习第1章物质及其变化第2讲离子反应课件,共60页。PPT课件主要包含了第2讲离子反应,考点一,考点二,考点三,必备知识·梳理夯实,水溶液里,熔融状态下,自由移动离子,水溶液中或熔融状态下,水溶液中等内容,欢迎下载使用。
人教版高考化学一轮复习第2章化学物质及其变化第2讲离子反应课件: 这是一份人教版高考化学一轮复习第2章化学物质及其变化第2讲离子反应课件
新高考高考化学总复习专题二化学物质及其变化第2讲离子反应课件: 这是一份新高考高考化学总复习专题二化学物质及其变化第2讲离子反应课件,共58页。PPT课件主要包含了考点三离子共存等内容,欢迎下载使用。












