



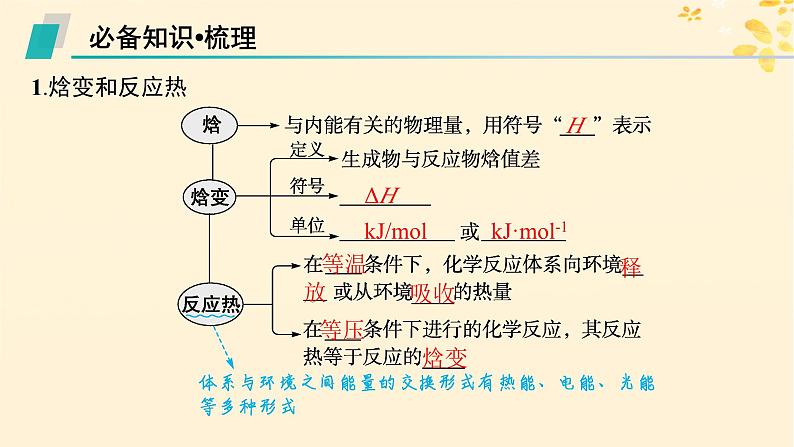


备战2025届新高考化学一轮总复习第6章化学反应与能量第29讲反应热热化学方程式课件
展开1.能辨识化学反应中的能量转化形式,能解释化学反应中能量变化的本质。2.能用热化学方程式表示反应中的能量变化,能运用反应焓变合理选择和利用化学反应。3.能举例说明化学在解决能源危机中的重要作用,能分析能源的利用对自然环境和社会发展的影响。能综合考虑化学变化中的物质变化和能量变化来分析、解决实际问题,如煤炭的综合利用等。
考点二 热化学方程式 燃烧热
kJ/ml kJ·ml-1
2.吸热反应和放热反应(1)从物质的总能量角度分析情境思考如图表示某反应的能量变化,按要求回答下列问题: ①该反应是________(填“放热”或“吸热”)反应。 ②该反应的ΔH=________。 ③使用催化剂________ (填“能”或“不能”)影响该反应的反应热。 ④逆反应的活化能可表示为________。
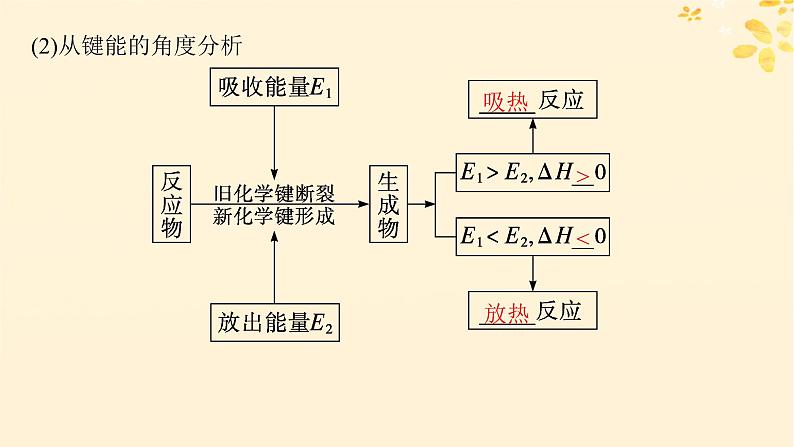
(2)从键能的角度分析
(3)常见的吸热反应和放热反应
考向1 反应热与能量变化的关系例1(2023·浙江1月选考卷)标准状态下,气态反应物和生成物的相对能量与反应历程示意图如下[已知O2(g)和Cl2(g)的相对能量为0],下列说法不正确的是( )
A.E6-E3=E5-E2B.可计算Cl—Cl键能为2(E2-E3) kJ·ml-1C.相同条件下,O3的平衡转化率:历程Ⅱ>历程ⅠD.历程Ⅰ、历程Ⅱ中速率最快的一步反应的热化学方程式为ClO(g)+O(g)═O2(g)+Cl(g) ΔH=(E5-E4) kJ·ml-1
解析 由图可知,反应O3+O═2O2的ΔH=(E6-E3) kJ·ml-1,反应O3+O+Cl═2O2+Cl(即O3+O═2O2)的ΔH=(E5-E2) kJ·ml-1,从而可得:E6-E3=E5-E2,A正确。由于Cl2(g)的相对能量为0,[O3+O]的相对能量为E3 kJ·ml-1,[O3+O+Cl]的相对能量为E2 kJ·ml-1,则Cl(g)的相对能量为(E2-E3) kJ·ml-1,故Cl—Cl键能为2(E2-E3) kJ·ml-1,B正确。由图可知,历程Ⅱ使用了催化剂,但催化剂不能使平衡发生移动,则平衡转化率不同,故O3的平衡转化率:历程Ⅰ=历程Ⅱ,C错误。一般来说,活化能越低,反应速率越快,由图可知,历程Ⅱ中第二步反应的活化能最低,该步反应速率最快,结合图中物质的相对能量,可得热化学方程式为ClO(g)+O(g)═O2(g)+Cl(g) ΔH=(E5-E4) kJ·ml-1,D正确。
[对点训练1] (2023·广东汕尾期末)酸催化丙烯与一元醇合成醚的反应机理、能量变化与反应过程的关系如图所示。下列说法正确的是( )
A.①②均为放热过程B.②的逆反应吸收的能量比③的逆反应吸收的能量多C.反应过程中只存在2种过渡态D.总反应为放热反应
解析 由图像可知①为吸热过程,②为放热过程,A错误;根据图中信息得到逆反应吸收的能量为③>②,B错误;图像中有3个峰,有3种过渡态,C错误;根据图像可知,反应物总能量大于生成物总能量,总反应是放热反应,D正确。
考向2 根据键能计算反应的焓变例2(2022·浙江6月选考卷)标准状态下,下列物质气态时的相对能量如下表:
可根据HO(g)+HO(g)═H2O2(g)计算出H2O2中氧氧单键的键能为214 kJ·ml-1。下列说法不正确的是( )A.H2的键能为436 kJ·ml-1B.O2的键能大于H2O2中氧氧单键的键能的两倍C.解离氧氧单键所需能量:HOO
则a=________。
解析 根据反应热=反应物的总键能-生成物的总键能,ΔH=-270 kJ·ml-1=2a kJ·ml-1+436 kJ·ml-1×4-413 kJ·ml-1×4-463 kJ·ml-1×4,则a=745。
1.热化学方程式(1)定义热化学方程式:2H2(g)+O2(g)═2H2O(l) ΔH=-571.6 kJ·ml-1,表示25 ℃、101 kPa下, _______________________________。 热化学方程式同时标明了化学反应中的_______变化和_______变化。
2 ml氢气和1 ml氧气反应生成2 ml液态水时放出571.6 kJ的热量
(2)书写步骤及要求
【应用示例】已知25 ℃、101 kPa下,石墨、金刚石燃烧的热化学方程式分别为C(石墨,s)+O2(g)═CO2(g) ΔH=-393.51 kJ·ml-1C(金刚石,s)+O2(g)═CO2(g) ΔH=-395.41 kJ·ml-1(1)请写出石墨转化为金刚石的热化学方程式_________________________________________。(2)已知物质的能量越低越稳定,请根据热化学方程式比较金刚石与石墨的稳定性________________。
C(石墨,s)══ C(金刚石,s) ΔH=+1.9 kJ·ml-1
S(s)+O2(g)══ SO2(g) ΔH=-269.8 kJ·ml-1
-890.3 kJ·ml-1
考向1 热化学方程式的书写例1依据事实写出下列反应的热化学方程式:(1)1 g碳与适量水蒸气反应生成CO和H2,需要吸收10.94 kJ热量,此反应的热化学方程式为____________________________________________。 (2)已知2.0 g燃料肼(N2H4)气体完全燃烧生成N2和水蒸气时,放出33.4 kJ的热量,则表示肼燃烧的热化学方程式为_____________________________。(3)2 ml Al(s)与适量O2(g)反应生成Al2O3(s),放出1 669.8 kJ的热量。此反应的热化学方程式为__________________________________________。
C(s)+H2O(g)═CO(g)+H2(g) ΔH=+131.28 kJ·ml-1
N2H4(g)+O2(g)═N2(g)+2H2O(g) ΔH=-534.4 kJ·ml-1
4Al(s)+3O2(g)═2Al2O3(s) ΔH=-3 339.6 kJ·ml-1
(4)硅粉与HCl在300 ℃时反应生成1 ml SiHCl3气体和H2,放出225 kJ热量,该反应的热化学方程式为_______________________________。 (5)在1 100 ℃下用镓与氨气制得氮化镓,该可逆反应每生成1 g H2放出5.15 kJ热量。该反应的热化学方程式是_______________________________。(已知金属镓的熔点是29.8 ℃,沸点是2 403 ℃;氮化镓的熔点为1 700 ℃)
Si(s)+3HCl(g)═SiHCl3(g)+H2(g) ΔH=-225 kJ·ml-1
考向2 燃烧热的理解及应用例2(2023·广东深圳模拟)分析下表中的3个热化学方程式,下列说法正确的是( )
A.丙烷的燃烧热为-2 039 kJ·ml-1B.等质量的氢气与丙烷相比较,充分燃烧时,丙烷放热更多C.3CO2(g)+10H2(g)═C3H8(g)+6H2O(g) ΔH=-381 kJ·ml-1D.3CO(g)+7H2(g)═C3H8(g)+3H2O(g) ΔH=+504 kJ·ml-1
[对点训练2] (1)(2022·海南卷,16)已知:电解液态水制备1 ml O2(g),电解反应的ΔH=+572 kJ·ml-1。由此计算H2(g)的燃烧热(焓)ΔH=________ kJ·ml-1。(2)[2022·河北卷,16(1)]298 K时,1 g H2燃烧生成H2O(g)放热121 kJ,1 ml H2O(l)蒸发吸热44 kJ,表示H2燃烧热的热化学方程式为_________________________________________。
进阶1 练易错·避陷阱1.查表得焓变数据(25 ℃,101 kPa),下列能正确表示物质燃烧热的热化学方程式是( )
解析 CO不是碳元素的稳定的氧化产物,应该是产生二氧化碳,A错误;气态水不是稳定的氧化产物,应该是液态水,B错误;1 ml H2S完全燃烧生成稳定的二氧化硫气体和液态水,符合燃烧热的概念,放出的热量为燃烧热,C正确;燃烧热是指1 ml纯净物完全燃烧生成指定物质放出的热量,方程式中为4 ml,不是燃烧热,D错误。
2.常温常压下,1 ml CH3OH与O2发生反应时,生成CO或HCHO的能量变化如图(反应物O2和生成物水略去),下列说法正确的是( )
A.加入催化剂后,生成CO的热效应变大,生成HCHO的热效应变小B.加入催化剂后,生成HCHO的速率变大,单位时间内生成HCHO量变多C.1 ml CH3OH完全燃烧生成液态水和二氧化碳(g)放出393 kJ的热量D.生成HCHO的热化学方程式为2CH3OH+O2═2HCHO+2H2O ΔH=+316 kJ·ml-1
解析 加入催化剂只改变反应历程而不改变热效应,加入催化剂生成CO的活化能增大而HCHO的活化能降低,A项错误;活化能越低反应越快。加入催化剂生成CO的活化能增大而HCHO的活化能降低,故生成HCHO速率更快,B项正确;1 ml CH3OH完全燃烧生成液态水和一氧化碳(g)放出393 kJ的热量,C项错误;该热化学方程式没有标注物质的状态,D项错误。
进阶2 练热点·提素能
4.(2023·广东深圳模拟)已知:298 K时,相关物质的相对能量如图所示。下列说法错误的是( )
进阶3 研真题·明考向5.(2023·北京卷,16节选)20世纪初,工业上以CO2和NH3为原料在一定温度和压强下合成尿素。反应分两步:ⅰ.CO2和NH3生成NH2COONH4;ⅱ.NH2COONH4分解生成尿素。
结合反应过程中能量变化示意图,下列说法正确的是________(填字母)。 a.活化能:反应ⅰ<反应ⅱb.ⅰ为放热反应,ⅱ为吸热反应c.CO2(l)+2NH3(l)═CO(NH2)2(l)+H2O(l) ΔH=E1-E4
备战2025届新高考化学一轮总复习第6章化学反应与能量第30讲反应热的测定及计算课件: 这是一份备战2025届新高考化学一轮总复习第6章化学反应与能量第30讲反应热的测定及计算课件,共36页。PPT课件主要包含了课标指引,目录索引,素养发展进阶,必备知识•梳理,3kJ,关键能力•提升,ΔH1+ΔH2,aΔH2,-ΔH2,a+c-2b等内容,欢迎下载使用。
第38讲 反应热 热化学方程式-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材): 这是一份第38讲 反应热 热化学方程式-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材),共47页。PPT课件主要包含了专项突破,归纳整合等内容,欢迎下载使用。
新高考化学一轮复习精品课件 第7章 第38讲 反应热 热化学方程式 (含解析): 这是一份新高考化学一轮复习精品课件 第7章 第38讲 反应热 热化学方程式 (含解析),共60页。PPT课件主要包含了反应热焓变,必备知识,关键能力,真题演练明确考向,课时精练等内容,欢迎下载使用。












