





备战2025届新高考化学一轮总复习第6章化学反应与能量第32讲电解池金属的腐蚀与防护课件
展开1.能辨识化学反应中的能量转化形式,能解释化学反应中能量变化的本质。2.能分析、解释电解池的工作原理,能设计简单的电解池。3.能利用电化学原理解释金属腐蚀现象,选择并设计防腐措施。
考点二 电解原理的应用
考点三 金属的腐蚀与防护
氧化反应 还原反应
电解质溶液 熔融电解质
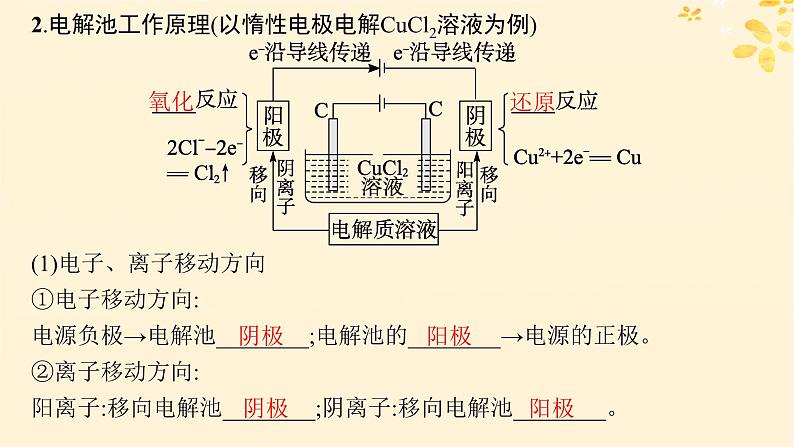
2.电解池工作原理(以惰性电极电解CuCl2溶液为例)
(1)电子、离子移动方向①电子移动方向:电源负极→电解池________;电解池的________→电源的正极。 ②离子移动方向:阳离子:移向电解池________;阴离子:移向电解池________。
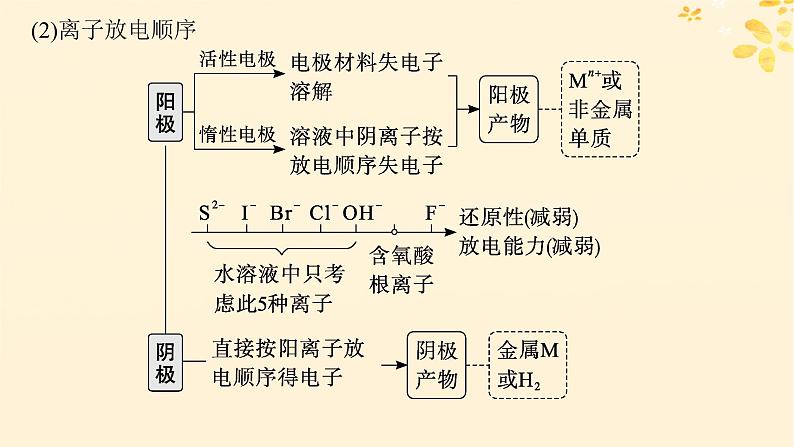
3.用惰性电极电解不同类型电解质溶液
2H2O-4e-══ 4H++O2↑
4H++4e-══ 2H2↑
4OH--4e-══ 2H2O+O2↑
4H2O+4e-══ 2H2↑+4OH-
2Cl--2e-══ Cl2↑
2H++2e- ══ H2↑
2Cl--2e- ══ Cl2↑
Cu2++2e- ══ Cu
2H2O+2e- ══ H2↑+2OH-
2H2O-4e- ══ 4H++O2↑
4Ag++4e- ══ 4Ag
【应用示例】用石墨作电极电解溶有物质的量之比为3∶1的NaCl和H2SO4的水溶液。根据反应产物,电解可明显分为三个阶段,这三个阶段电解的电解质分别是__________、__________、__________ (填化学式)。
考向1 电解池装置及工作原理例1(2023·浙江1月选考卷)在熔融盐体系中,通过电解TiO2和SiO2获得电池材料(TiSi),电解装置如图,下列说法正确的是( ) A.石墨电极为阴极,发生氧化反应B.电极A的电极反应:8H++TiO2+SiO2+8e-═TiSi+4H2OC.该体系中,石墨优先于Cl-参与反应D.电解时,阳离子向石墨电极移动
解析 在外加电源下石墨电极上C转化为CO,失电子发生氧化反应,为阳极,A错误;电极A的电极反应为TiO2+SiO2+8e-═TiSi+4O2-,B错误;根据图中信息可知,该体系中,石墨优先于Cl-参与反应,C正确;电解池中石墨电极为阳极,阳离子向阴极电极A移动,D错误。
[对点训练1] (2023·上海卷)电解食盐水间接氧化法去除工业废水中氨氮的原理如图所示,通过电解氨氮溶液(含有少量的NaCl),将NH3转化为N2(无Cl2逸出),下列说法正确的是( ) A.M为负极B.N极附近pH不变化C.n(N2)
考向2 电解规律及应用例2用惰性电极电解下列各组中的三种电解质溶液,在电解的过程中,溶液的pH依次升高、不变、降低的是( )A.AgNO3、NaCl、Cu(NO3)2B.KCl、Na2SO4、CuSO4C.CaCl2、KOH、NaNO3D.HCl、HNO3、K2SO4
解析 电解AgNO3、Cu(NO3)2、CuSO4溶液时有酸产生,溶液pH降低;电解NaCl、KCl、CaCl2溶液时有碱产生,溶液pH升高;电解HCl溶液时电解的是电解质本身,溶液中HCl减少,对应的H+减少,溶液的pH升高;电解KOH、HNO3溶液时相当于电解H2O,电解质浓度增大,对应的碱溶液碱性更强,酸溶液酸性更强。
[对点训练2] 如图所示,x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味的气体放出,符合这一情况的是( )
解析 由题意知a极板质量增加,a应为阴极,则b为阳极,x为电源负极,y为电源正极,参考各个选项知,A项符合,电解时,a极板有Cu附着,b极板有O2放出;B项不符合,电解时a极板无质量变化;C项不符合,阳极为Fe,为活性电极,电解时Fe在阳极放电溶解,无气体生成;D项不符合,电解时,Cl-在阳极放电生成Cl2,Cl2为黄绿色、有刺激气味的气体。
考向3 电解的有关计算例3(2023·全国甲卷)用可再生能源电还原CO2时,采用高浓度的K+抑制酸性电解液中的析氢反应来提高多碳产物(乙烯、乙醇等)的生成率,装置如下图所示。下列说法正确的是( )
A.析氢反应发生在IrOx-Ti电极上B.Cl-从Cu电极迁移到IrOx-Ti电极C.阴极发生的反应有:2CO2+12H++12e-═C2H4+4H2OD.每转移1 ml电子,阳极生成11.2 L气体(标准状况)
[对点训练3] 将两个铂电极插入500 mL CuSO4溶液中进行电解,通电一定时间后,某一电极增重0.064 g(设电解时该电极无氢气析出,且不考虑水解和溶液体积变化),此时溶液中氢离子浓度约为( )A.4×10-3ml·L-1B.2×10-3ml·L-1C.1×10-3ml·L-1D.1×10-7ml·L-1
1.氯碱工业情境思考氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
(1)写出电解饱和食盐水的离子方程式: ___________________________。 (2)离子交换膜的作用为_____________________________________________________________________________________________________。 (3)精制饱和食盐水从图中______(填“a”“b”“c”或“d”)位置补充,氢氧化钠溶液从图中______位置流出。
能得到纯度更高的氢氧化钠溶液,阻止阳极产生
的Cl2 和阴极产生的H2混合发生反应
2.电镀与电解精炼铜
Cu-2e-══ Cu2+
3.电冶金利用电解熔融盐(或氧化物)的方法来冶炼活泼金属,如Na、Ca、Mg、Al等。
Mg2++2e- ══ Mg
6O2--12e- ══ 3O2↑
考向1 氯碱工业与电解原理例1(2023·浙江6月选考卷)氯碱工业能耗大,通过如图改进的设计可大幅度降低能耗,下列说法不正确的是( )
A.电极A接电源正极,发生氧化反应B.电极B的电极反应式为2H2O+2e-═H2↑+2OH-C.应选用阳离子交换膜,在右室获得浓度较高的NaOH溶液D.改进设计中通过提高电极B上反应物的氧化性来降低电解电压,减少能耗
解析 电极A是氯离子变为氯气,化合价升高,失去电子,是电解池阳极,因此电极A接电源正极,发生氧化反应,A正确;电极B为阴极,通入氧气,氧气得到电子,其电极反应式为2H2O+4e-+O2═4OH-,B错误;右室生成氢氧根,应选用阳离子交换膜,左边的钠离子进入右边,在右室获得浓度较高的NaOH溶液,C正确;改进设计中增大了氧气的量,提高了电极B处的氧化性,通过提高反应物的氧化性来降低电解电压,减少能耗,D正确。
[对点训练1] 在氯碱工业中,离子交换膜法电解饱和食盐水示意图如下,下列说法不正确的是( ) A.电极A为阳极,发生氧化反应生成氯气B.离子交换膜为阳离子交换膜C.饱和NaCl从a处进,NaOH溶液从d处出D.OH-迁移的数量等于导线上通过电子的数量
考向2 电解精炼与电镀例2金属镍有广泛的用途,粗镍中含有Fe、Zn、Cu、Pt等杂质,可用电解法制得高纯度的镍。下列叙述中正确的是(已知:氧化性Fe2+
[对点训练2] 以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是( )A.未通电前上述镀锌装置可构成原电池,电镀过程是该原电池的充电过程B.因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系C.电镀时保持电流恒定,升高温度不改变电解反应速率D.镀锌层破损后即对铁制品失去保护作用
解析 电镀前,Zn与Fe构成原电池,Zn为负极,Fe为正极,电镀时,Fe为阴极,Zn为阳极,原电池充电时,原电池负极为阴极、正极为阳极,故不属于原电池的充电过程,A错误;根据电子守恒,通过电子的电量与析出Zn的量成正比,B错误;电流恒定,单位时间通过的电子的物质的量恒定,即电解速率恒定,C正确;镀层破损后,Zn与Fe仍能构成原电池,其中Zn为负极被腐蚀,Fe为正极被保护,D错误。
[对点训练3] MFC-电芬顿技术不需要外加能量即可发生,通过产生羟基自由基(·OH)处理有机污染物,可获得高效的废水净化效果。其耦合系统原理示意图如图,下列说法中错误的是( )
A.标准状况下,乙池中消耗22.4 L O2时,可以产生2 ml ·OHB.甲池是将化学能转化为电能,其中a极上发生氧化反应C.电子移动方向为:a→Y,X→bD.乙池中生成羟基自由基的反应为Fe2++H2O2+H+═Fe3++H2O+·OH
解析 乙池中Y电极上的反应为O2+2H++2e-═H2O2,之后再发生反应H2O2+H++Fe2+═Fe3++H2O+·OH,当产生1 ml羟基自由基时,需要1 ml H2O2,消耗1 ml O2。所以标准状况下消耗22.4 L O2时,产生1 ml羟基自由基,A错误;甲池为原电池,将化学能转化为电能,是燃料电池,b极上氧气被还原,为正极,a电极为负极,发生的是氧化反应,B正确;甲池为原电池,a电极为负极,b电极为正极。乙池为电解池,X电极为阳极,Y电极为阴极。串联装置中,电子由原电池负极流向电解池阴极,即a→Y,由电解池的阳极流向原电池正极,即X→b,C正确;乙池中Y极为阴极,电极反应式为O2+2e-+2H+ ═H2O2,则生成·OH的反应为Fe2++H2O2+H+═·OH+Fe3++H2O,D正确。
1.金属的腐蚀(1)金属腐蚀的本质金属原子________电子变为金属________,金属发生________。 (2)金属腐蚀的类型①化学腐蚀与电化学腐蚀
②析氢腐蚀和吸氧腐蚀(以钢铁的腐蚀为例)
2H++2e-══ H2↑
O2+2H2O+4e- ══ 4OH-
Fe+2H+ ══ Fe2++H2↑
2Fe+O2+2H2O ══ 2Fe(OH)2
【应用示例】 (1)若棉团浸有NH4Cl溶液,铁钉发生_______腐蚀,正极反应式为_____________________,右试管中现象是________________________。 (2)若棉团浸有NaCl溶液,铁钉发生_______腐蚀,正极反应式为_____________________,右试管中现象是________________________。
O2+4e-+2H2O ══ 4OH-
2.金属的防护(1)金属防护的原理金属的防护主要是从________、与金属接触的物质及两者________的条件等方面来考虑的。
(2)金属腐蚀的防护方法
【应用示例】如图所示,各烧杯中盛有海水,铁在其中被腐蚀的速率由快到慢的顺序为______________。
解析 ②③④均为原电池,③中Fe为正极,被保护;②④中Fe为负极,均被腐蚀,但Fe和Cu的金属活动性差别大于Fe和Sn的,故Fe-Cu原电池中Fe被腐蚀得较快。⑤是Fe接电源正极作阳极,Cu接电源负极作阴极的电解腐蚀,加快了Fe的腐蚀。⑥是Fe接电源负极作阴极,Cu接电源正极作阳极的电解腐蚀,防止了Fe的腐蚀。根据以上分析可知铁在其中被腐蚀的速率由快到慢的顺序为⑤>④>②>①>③>⑥。
考向1 金属腐蚀的原理及分析例1(2023·湖南雅礼中学期末)点蚀又称为孔蚀,是一种集中于金属表面很小的范围并深入到金属内部的腐蚀形态。某铁合金钝化膜破损后的孔蚀如图,则下列说法正确的是( )
A.为防止孔蚀发生可以将外接电源正极与金属相连B.反应时每吸收2.24 L O2,则此时HCl可以氧化0.2 ml FeC.在腐蚀的过程中钝化膜作为负极D.依题孔隙中局部可能发生析氢腐蚀
解析 与电源正极相连作阳极,阳极发生氧化反应,加快金属的腐蚀,故为防止孔蚀发生可以将外接电源负极与金属相连,A错误;未告知O2所处的状态,无法计算2.24 L O2的物质的量,故无法计算此时HCl可以氧化Fe的物质的量,B错误;由图示可知,在腐蚀的过程中钝化膜作为正极,O2在钝化膜上得到电子发生还原反应,C错误;依题孔隙中局部中可能存在酸性环境,则可能发生析氢腐蚀,D正确。
[对点训练1] 如图所示,将铁钉的一部分镀上不同的金属,放入培养皿中,加入含有饱和食盐水及琼脂的溶液,再各滴入几滴酚酞溶液和K3[Fe(CN)6]溶液。下列分析不正确的是( ) A.a中铁钉附近呈现蓝色B.b中铁钉附近出现红色C.a中铜上发生反应O2+2H2O+4e-═4OH-D.b中锌上发生还原反应
解析 a中铁比铜活泼,发生腐蚀时,铁作负极被氧化生成Fe2+,滴加K3[Fe(CN)6]溶液,铁钉附近出现蓝色沉淀,A正确;b中Zn比Fe活泼,发生腐蚀时,Zn作负极被氧化为Zn2+,铁钉作正极,电极反应式为O2+2H2O+4e-═4OH-,滴加酚酞溶液,铁钉负极溶液变成红色,B正确,D错误;a中铜是正极,发生吸氧腐蚀,电极反应式为O2+2H2O+4e-═4OH-,C正确。
考向2 金属腐蚀的防护方法例2验证牺牲阳极法,实验如下(烧杯内均为经过酸化的3% NaCl溶液)。
下列说法不正确的是( )A.对比②③,可以判定Zn保护了FeB.对比①②,K3[Fe(CN)6]可能将Fe氧化C.验证Zn保护Fe时不能用①的方法D.将Zn换成Cu,用①的方法可判断Fe比Cu活泼
解析 实验②中加入K3[Fe(CN)6]溶液,溶液无变化,说明溶液中没有Fe2+;实验③中加入K3[Fe(CN)6]溶液生成蓝色沉淀,说明溶液中有Fe2+,A项正确;对比①②可知,①中K3[Fe(CN)6]可能将Fe氧化成Fe2+,Fe2+再与K3[Fe(CN)6]反应生成蓝色沉淀,B项正确;由以上分析可知,验证Zn保护Fe时,可以用②③做对比实验,不能用①的方法,C项正确;K3[Fe(CN)6]可将单质铁氧化为Fe2+,Fe2+与K3[Fe(CN)6]生成蓝色沉淀,附着在Fe表面,无法判断铁比铜活泼,D项错误。
[对点训练2] (2023·陕西西安统考)用图示的方法可以保护钢质闸门,下列说法不正确的是( ) A.当a、b间用导线连接时,则X应发生氧化反应B.当a、b间用导线连接时,则X可以是锌C.当a、b与外接电源相连时,a应连接电源的负极D.当a、b与外接电源相连时,其方法为牺牲阳极法
解析 当a、b间用导线连接时形成了原电池,铁需要被保护,则铁为正极,X做负极,发生氧化反应,X需要的是一种活泼性比铁强的金属,可以是锌,A、B正确;当a、b与外接电源相连时,铁需要被保护,则铁做阴极,a应连接电源的负极,C正确;当a、b与外接电源相连时,利用电解原理保护金属铁,其方法是外加电流法,D错误。
进阶1 练易错·避陷阱 1.(2023·广东汕头二模)间接电解法可对大气污染物NO进行无害化处理。其工作原理如图所示(质子膜只允许H+通过)。下列有关说法错误的是( )
2.(2023·广东惠州检测)过硫酸铵[(NH4)2S2O8]可用作氧化剂、漂白剂。利用电解法在两极分别生产过硫酸铵和过氧化氢的装置如图所示。下列说法错误的是( )
解析 S元素化合价由+6价升高为+7价,化合价升高被氧化,故右侧Pt电极为阳极,b为外接电源正极,a为外接电源负极,左侧Pt电极为阴极,A正确;阴极氧气被还原,阳极硫酸根被氧化,电解总反应正确,B正确;根据阳极产物可知,反应需要消耗硫酸根,阴离子交换膜不可用阳离子交换膜替代,C错误;电解池工作时,Ⅰ室溶液中氢离子移向阴极,硫酸根移向阳极,消耗硫酸,Ⅰ室溶液质量理论上逐渐减小,D正确。
进阶2 练热点·提素能3.(2024·浙江温州模拟)利用电化学富集海水中锂的电化学系统如图所示。该电化学系统的工作步骤如下:①启动电源1,MnO2所在腔室的海水中的Li+进入MnO2结构而形成LixMn2O4;②关闭电源1和海水通道,启动电源2,使LixMn2O4中的Li+脱出进入腔室2。
下列说法不正确的是( )A.启动电源1时,电极1为阳极,发生氧化反应B.启动电源2时MnO2电极反应式为xLi++2MnO2+xe-═LixMn2O4C.电化学系统提高了腔室2中LiOH的浓度D.启动至关闭电源1,转化的n(MnO2)与生成的n(O2)之比为20∶3,可得LixMn2O4中的x=1.2
解析 由题意知,启动电源1,使海水中Li+进入MnO2结构形成LiMn2O4;可知二氧化锰中锰的化合价降低,为阴极,电极1为阳极,连接电源正极;关闭电源1和海水通道,启动电源2,向电极2上通入空气,使LixMn2O4中的Li+脱出进入腔室2,可知,电极2为阴极,电极反应式:2H2O+O2+4e-═4OH-;阳极的电极反应式:LixMn2O4-xe-═2MnO2+xLi+。由分析知,启动电源1时,腔室1中电极1连接电源1的正极,作阳极,发生氧化反应,A正确;启动电源2时MnO2对应电极为阳极,电极反应式:LixMn2O4-xe-═2MnO2+xLi+,B错误;电化学系统提高了腔室2中LiOH的浓度,C正确;根据分析可知,启动至关闭电源1,若转化的n(MnO2)与生成的n(O2)之比为20∶3,可得LixMn2O4中的x=1.2,D正确。
A.铁电极做阳极,发生还原反应B.Ni电极发生的反应为2H2O+2e-═H2↑+2OH-C.通电后Na+向右移动,阴极区Na+浓度增大D.当电路中通过1 ml电子时,阴极区有11.2 L H2生成
进阶3 研真题·明考向5.(2023·辽宁卷)某无隔膜流动海水电解法制H2的装置如下图所示,其中高选择性催化剂PRT可抑制O2产生。下列说法正确的是( )
A.b端电势高于a端电势B.理论上转移2 ml e-生成4 g H2C.电解后海水pH下降D.阳极发生反应:Cl-+H2O-2e-═HClO+H+
6.(2023·北京卷)回收利用工业废气中的CO2和SO2,实验原理示意图如下。
高考化学一轮复习第7章化学反应与能量第36讲电解池金属的腐蚀与防护课件: 这是一份高考化学一轮复习第7章化学反应与能量第36讲电解池金属的腐蚀与防护课件,共55页。PPT课件主要包含了氧化还原,通入HCl气体,加CuCl2固体,加入Ag2O固体,精制饱和NaCl溶液,淡盐水,NaOH溶液,Cl2,OH-,基本不变等内容,欢迎下载使用。
2025届高考化学一轮总复习第7章化学反应与能量第36讲电解池金属的腐蚀与防护课件: 这是一份2025届高考化学一轮总复习第7章化学反应与能量第36讲电解池金属的腐蚀与防护课件,共55页。PPT课件主要包含了氧化还原,通入HCl气体,加CuCl2固体,加入Ag2O固体,精制饱和NaCl溶液,淡盐水,NaOH溶液,Cl2,OH-,基本不变等内容,欢迎下载使用。
新教材(广西专版)高考化学一轮复习第6章化学反应与能量第3讲电解池金属的腐蚀与防护课件: 这是一份新教材(广西专版)高考化学一轮复习第6章化学反应与能量第3讲电解池金属的腐蚀与防护课件,共60页。PPT课件主要包含了内容索引,强基础增分策略,增素能精准突破,研专项前沿命题,明考向真题演练,课程标准,金属的防护,答案D,归纳总结,思路指导1等内容,欢迎下载使用。












