











大单元四 第十章 第38讲 反应热 热化学方程式-备战2025年高考化学大一轮复习课件(人教版)
展开1.知道常见的吸热反应和放热反应,理解反应热、焓变及相关概念。2.了解中和反应反应热的测定方法。3.能正确书写热化学方程式。4.会分析化学反应过程中能量变化图像。5.了解燃烧热的含义和能源及其利用的意义。
考点一 反应热 焓变
考点二 热化学方程式
考点三 燃烧热 能源
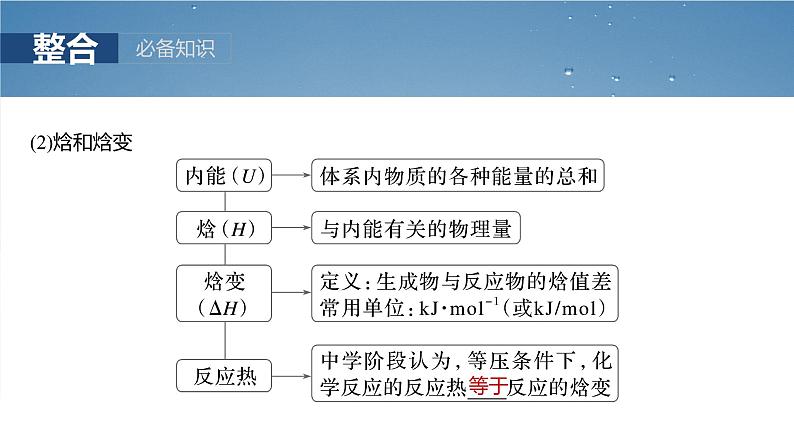
1.反应热和焓变及相关概念(1)反应热
2.识记常见的吸热反应和放热反应有下列常见的化学反应:①Ba(OH)2·8H2O与NH4Cl的反应 ②大多数的分解反应 ③大多数的化合反应 ④大多数的盐类水解 ⑤C和H2O(g)、C和CO2的反应 ⑥中和反应 ⑦可燃物的燃烧 ⑧金属与酸的置换反应 ⑨铝热反应其中属于放热反应的是____________(填序号,下同),属于吸热反应的是__________。
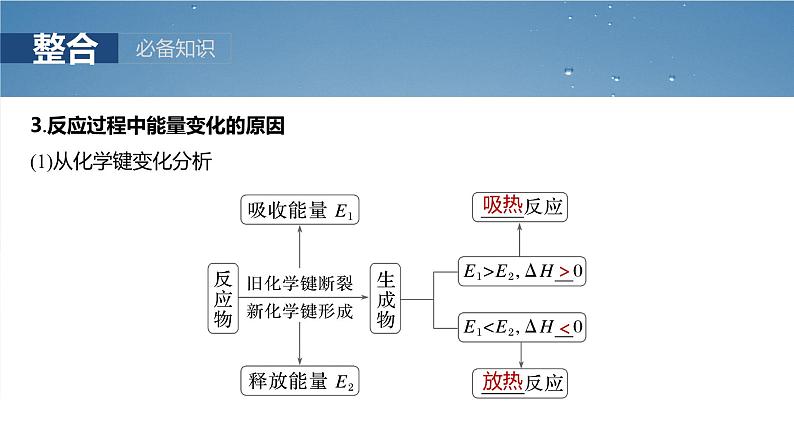
3.反应过程中能量变化的原因(1)从化学键变化分析
(2)从反应过程能量图理解
1.放热反应不需要加热就能反应,吸热反应不加热就不能反应( )2.弱电解质的电离是吸热反应,浓硫酸溶于水是放热反应( )3.反应体系的焓就是体系的内能( )4.活化能越大,表明化学反应吸收的能量越多( )
1.某化学实验小组用简易量热计(装置如图),采用50 mL0.50 ml· L-1盐酸与50 mL 0.55 ml· L-1 NaOH溶液反应,测量中和反应的反应热。
一、中和反应反应热测定
测定操作Ⅰ.用量筒量取50 mL 0.50 ml·L-1盐酸倒入量热计内筒中,测出盐酸的温度;Ⅱ.用另一量筒量取50 mL 0.55 ml·L-1 NaOH溶液,并用同一温度计测出其温度;Ⅲ.将NaOH溶液倒入量热计内筒中,使之混合均匀,测得混合液最高温度。重复上述步骤,记录数据。
回答下列问题:(1)NaOH溶液与盐酸混合均匀的正确操作是____(填字母)。a.把NaOH溶液分多次倒入量热计内筒小烧杯中与盐酸反应b.用温度计小心搅拌c.揭开杯盖用玻璃棒搅拌d.用套在温度计上的玻璃搅拌器上下轻轻地搅动e.实验时可用铜质搅拌器代替玻璃搅拌器
(2)NaOH溶液稍过量的原因:_____________________。
(3)稀盐酸和氢氧化钠溶液的密度都视为1 g·cm-3,溶液的比热容c=4.18×10-3 kJ·g-1·℃-1。某学生实验记录数据如下:
计算生成1 ml水的反应热。
-51.8 kJ·ml-1
(4)问题讨论①在中和反应反应热的测定实验中,使用弱酸或弱碱会使测得的中和反应反应热数值________(填“偏高”“不变”或“偏低”),其原因是______________________________________________________________________________________________。
弱酸或弱碱在溶液中部分电离,在反应过程中,弱酸或弱碱会继续电离,而电离是吸热的过程
②有两组实验:ⅰ.50 mL 0.50 ml·L-1盐酸和50 mL 0.55 ml·L-1 NaOH溶液,ⅱ.60 mL 0.50 ml·L-1盐酸和50 mL 0.55 ml·L-1 NaOH溶液。实验ⅰ、ⅱ反应放出的热量________(填“相等”或“不相等”,下同),测得的中和反应反应热________,原因是___________________________________________________________________。
中和反应反应热是以生成1 ml液态水为标准的,与反应物的用量无关
2.臭氧层中O3分解过程如图所示,回答下列问题。(1)ΔH_____(填“>”或“<”)0。(2)催化反应①是________(填“吸热”或“放热”,下同)反应,催化反应②是________反应。
二、反应过程中物质能量变化图像
(3)总反应的活化能是_____,催化反应①的活化能是______,催化反应②对应的逆反应的活化能是____________,总反应对应的逆反应活化能为__________。
3.铋基催化剂对CO2电化学还原制取HCOOH具有高效的选择性。其反应历程与相对能量变化如图所示,其中吸附在催化剂表面上的物种用*标注。
(1)使用Bi、Bi2O3两种催化剂,哪种更有利于CO2的吸附?________。简述判断依据:_____________________________________________________________________。
由图可知,使用Bi2O3催化剂时,相对能量减小得多,趋于更稳定状态
(2)CO2电化学还原制取HCOOH反应的ΔH_____(填“>”或“<”)0。(3)使用Bi催化剂时,最大能垒是________,使用Bi2O3催化剂时,最大能垒是__________。
(4)由 生成*HCOO-的反应为_______________________________________。
三、化学反应的焓变与键能的相互计算4.CH3—CH3(g)===CH2==CH2(g)+H2(g) ΔH,有关化学键的键能如下表:
则该反应的反应热为________________。
+124 kJ·ml-1
ΔH=E(C—C)+6E(C—H)-E(C==C)-4E(C—H)-E(H—H)=(347+6×414-615-4×414-436) kJ·ml-1=+124 kJ·ml-1。
5.有关键能数据如表,SiO2晶体部分微观结构如图,晶体硅在O2中燃烧的热化学方程式:Si(s)+O2(g)===SiO2(s) ΔH=-989.2 kJ·ml-1,则表中的x值为______。
已知Si(s)+O2(g)===SiO2(s) ΔH=-989.2 kJ·ml-1,由图可知,1 ml SiO2晶体中含有4 ml Si—O,1 ml O2中含有1 ml O==O,1 ml晶体硅中有2 ml Si—Si,则根据反应热与键能关系可得:ΔH=2×176 kJ·ml-1+498.8 kJ·ml-1-4x kJ·ml-1=-989.2 kJ·ml-1,解得x=460。
1.概念表明反应所释放或吸收的热量的化学方程式。2.意义既表明了化学反应中的 变化,也表明了化学反应中的 变化。如2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·ml-1表示在25 ℃、101 kPa条件下,________________________________________________________________。
2 ml H2(g)与1 ml O2(g)反应生成2 ml液态水时放出的热量为571.6 kJ
一、热化学方程式的书写及注意事项
1.判断下列热化学方程式的正误,错误的指明原因。(1)2NO2===O2+2NO ΔH=+116.2 kJ·ml-1
答案 × 物质未标明聚集状态。
(2)3.2 g CH4完全燃烧生成CO2(g)和H2O(l)时放出178 kJ的热量,其热化学方程式为CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890 kJ
答案 × ΔH单位为kJ·ml-1。
(4)在一定温度和压强下,1 ml SO2、0.5 ml O2混合反应后,放出热量a kJ,则气态SO2转化为气态SO3的热化学方程式为2SO2(g)+O2(g) 2SO3(g) ΔH=-2a kJ·ml-1
答案 × SO2与O2的反应为可逆反应,1 ml SO2、0.5 ml O2混合反应,消耗的SO2物质的量小于1 ml。
答案 × 同素异形体应指明名称。
(6)1 ml液态肼在足量氧气中完全燃烧生成水蒸气,放出642 kJ的热量:N2H4(l)+O2(g)===N2(g)+2H2O(g) ΔH=+642 kJ·ml-1
答案 × 液态肼的燃烧为放热反应,ΔH应为“-”号。
(5)若31 g白磷的能量比31 g红磷多b kJ,则白磷转化为红磷的热化学方程式为P4(s)===4P(s) ΔH=-4b kJ·ml-1
2.计算反应热书写热化学方程式。(1)已知2.0 g燃料肼(N2H4)气体完全燃烧生成N2和水蒸气时,放出33.4 kJ的热量,则表示肼燃烧的热化学方程式为_______________________________________________________________。(2)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、101 kPa下,已知该反应每消耗1 ml CuCl(s)放热44.4 kJ,该反应的热化学方程式是______________________________________________________________。
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=
-534.4 kJ·ml-1
2CuCl2(s)+2CuO(s) ΔH=-177.6 kJ·ml-1
4CuCl(s)+O2(g)===
(3)断开1 ml H—H,1 ml N—H,1 ml N≡N分别需要的能量是436 kJ、391 kJ、946 kJ,写出2 ml NH3分解的热化学方程式:________________________________________________________。
+92 kJ·ml-1
二、提取反应过程图像信息书写热化学方程式
3.分析下列图像,按要求书写热化学方程式。
(1)图甲表示的是NO2(g)和CO(g)反应生成CO2(g)和NO(g)的过程中能量变化示意图,请写出NO2(g)和CO(g)反应的热化学方程式:_____________________________________________________。
NO2(g)+CO(g)===NO(g)+CO2(g)
ΔH=-234 kJ·ml-1
(2)我国科学家研究化合物M(s)催化CO2氢化生成甲酸的机理,其中由化合物M(s)生成化合物N(s)的反应过程和相对能量曲线如图乙所示,TS1、TS2均为过渡态(已知:1 eV=96 kJ·ml-1)。写出该反应的热化学方程式:______________________________________________。
M(s)+CO2(g)===N(s) ΔH=
-48.96 kJ·ml-1
(3)图丙表示一定条件下,在水溶液中1 ml Cl-、 (x=1、2、3、4)的能量相对大小,①D是________(填离子符号)。②B→A+C反应的热化学方程式为____________________________________________________(用离子符号表示)。
+2Cl-(aq) ΔH=-117 kJ·ml-1
1.燃烧热(1)概念:在101 kPa时, ml纯物质 生成指定产物时所放出的热量。(2)意义:衡量燃料燃烧时放出热量的多少。(3)熟记常见元素完全燃烧生成的指定物质
2.燃料的选择、能源(1)燃料选择的原则要综合考虑①环境保护;②热值大小;③其他因素,如来源、价格、运输、稳定性等。(2)能源分类及利用
1.开发利用各种新能源,减少对化石燃料的依赖,可以降低空气中PM2.5的含量( )2.使用氢气作燃料有助于控制温室效应( )3.101 kPa时,1 ml碳燃烧所放出的热量为碳的燃烧热( )4.煤、石油、天然气等燃料的最初来源都可追溯到太阳能( )5.燃料燃烧阶段,可通过改进锅炉的炉型、燃料空气比等提高燃料的燃烧效率( )6.空气燃料比越大,燃料燃烧越充分,则燃烧效率一定越高( )7.氢气的燃烧热ΔH=-285.8 kJ·ml-1,则电解水的热化学方程式为2H2O(l)===2H2(g)+O2(g) ΔH=+285.8 kJ·ml-1( )
1.在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)。反应过程和能量关系可用如图简单表示(图中的ΔH表示生成1 ml产物的数据)。(1)写出表示S8燃烧热的热化学方程式:____________________________________________________。
S8(s)+8O2(g)===8SO2(g) ΔH=
-8a kJ·ml-1
1 ml S8(s)和O2(g)发生反应转化为SO2(g)时放出的热量为燃烧热,由图可知生成1 ml SO2(g)放出的热量为a kJ,则S8燃烧热的热化学方程式为S8(s)+8O2(g)===8SO2(g) ΔH=-8a kJ·ml-1。
(2)写出SO3分解生成SO2和O2的热化学方程式:________________________________________________。
ΔH=+b kJ·ml-1
2.长征系列部分火箭采用了肼(N2H4)作燃料,N2H4与NH3有相似的化学性质,回答下列问题:(1)已知肼分子中所有原子最外层都满足稀有气体原子结构,则肼的结构式为____________。
(2)下表是常见的键能数据:
已知合成氨反应N2(g)+3H2(g) 2NH3(g) ΔH=-92 kJ·ml-1,则a为________,肼蒸气在O2(g)中燃烧生成N2(g)与H2O(g)时的热化学方程式为_________________________________________________________。
N2(g)+2H2O(g) ΔH=-577 kJ·ml-1
N2H4(g)+O2(g)===
(3)火箭推进剂通常选择液态的H2O2作氧化剂,混合后会产生大量的气体从而推动火箭升空,试写出该反应的化学方程式:________________________________。
N2H4+2H2O2===N2↑+4H2O↑
(4)已知每12.8 g的液态肼与足量的液态过氧化氢反应生成气态产物时放出热量256 kJ,已知1 ml液态水转化为水蒸气需要吸收44 kJ的热量,则1 ml的液态肼发生反应生成液态水放出的热量为Q=________。
每12.8 g(0.4 ml)的液态肼与足量的液态过氧化氢反应生成气态产物时放出热量256 kJ,则1 ml的液态肼生成4 ml液态水所放出的热量Q=(256×2.5+4×44) kJ=816 kJ。
(5)常见的助燃剂有O2、H2O2、NO2,若消耗等物质的量的肼,消耗物质的量最多的助燃剂为________,实际中火箭选择的助燃剂是NO2,主要考虑的因素可能是________________________________。
高温下稳定,且更容易液化储存
1.(2023·湖北,1)2023年5月10日,天舟六号货运飞船成功发射,标志着我国航天事业进入到高质量发展新阶段。下列不能作为火箭推进剂的是A.液氮-液氢 B.液氧-液氢C.液态NO2-肼 D.液氧-煤油
液氮较稳定,氢气不能在氮气中燃烧,液氮-液氢不能作为火箭推进剂,A符合题意。
2.[2023·北京,16(2)]二十世纪初,工业上以CO2和NH3为原料在一定温度和压强下合成尿素。反应分两步:ⅰ.CO2和NH3生成NH2COONH4;ⅱ.NH2COONH4分解生成尿素。结合反应过程中能量变化示意图,下列说法正确的是______(填序号)。a.活化能:反应ⅰ<反应ⅱb.ⅰ为放热反应,ⅱ为吸热反应c.CO2(l)+2NH3(l)===CO(NH2)2(l)+H2O(l) ΔH=E1-E4
反应ⅰ的活化能是E1,反应ⅱ的活化能是E3,E1
可根据HO(g)+HO(g)===H2O2(g)计算出H2O2中氧氧单键的键能为214 kJ·ml-1。下列说法不正确的是A.H2的键能为436 kJ·ml-1B.O2的键能大于H2O2中氧氧单键的键能的两倍C.解离氧氧单键所需能量:HOO
由表格中的数据可知HOO===HO+O,解离其中氧氧单键需要的能量为249 kJ·ml-1+39 kJ·ml-1-10 kJ·ml-1=278 kJ·ml-1,H2O2中氧氧单键的键能为214 kJ·ml-1,C错误;由表中的数据可知H2O(g)+O(g)===H2O2(g)的ΔH=-136 kJ·ml-1-(-242 kJ·ml-1)-249 kJ·ml-1=-143 kJ·ml-1,D正确。
4.按要求书写热化学方程式。(1)[2022·河北,16(1)]298 K时,1 g H2燃烧生成H2O(g)放热121 kJ,1 ml H2O(l)蒸发吸热44 kJ,表示H2燃烧热的热化学方程式为________________________________________________。
-286 kJ·ml-1
(2)[2021·海南,16(1)]已知25 ℃,100 kPa时:1 ml葡萄糖[C6H12O6(s)]完全燃烧生成CO2(g)和H2O(l),放出2 804 kJ热量。则25 ℃时,CO2(g)与H2O(l)经光合作用生成葡萄糖[C6H12O6(s)]和O2(g)的热化学方程式为_____________________________________________________________。
6CO2(g)+6H2O(l)===C6H12O6(s)+6O2(g) ΔH=+2 804 kJ·ml-1
(3)[2021·天津,13(3)]合成氨反应常使用铁触媒提高反应速率。如图为有、无铁触媒时,反应的能量变化示意图。写出该反应的热化学方程式:________________________________________________。从能量角度分析,铁触媒的作用是___________________。
1.化学与人类生活、社会可持续发展密切相关,下列说法正确的是A.直接燃烧煤和将煤进行深加工后再燃烧的效率相同B.天然气、水能属于一次能源,水煤气、电能属于二次能源C.人们可以把放热反应释放的能量转化为其他可利用的能量,而吸热反应没有利用 价值D.地热能、风能、天然气和氢能都属于新能源
A项,将煤进行深加工后,脱硫处理、气化处理能很好地减少污染气体,提高燃烧效率,燃烧的效果好,错误;C项,有时需通过吸热反应吸收热量降低环境温度,有利用价值,错误;D项,天然气是化石燃料,不属于新能源,错误。
2.已知2H2(g)+CO(g)===CH3OH(g)为放热反应,下列对该反应的说法正确的是A.因该反应为放热反应,故不加热就可发生B.相同条件下,2 ml H2(g)的能量或1 ml CO(g)的能量一定高于1 ml CH3OH(g)的 能量C.相同条件下,2 ml H2(g)和1 ml CO(g)的总能量一定高于1 ml CH3OH(g)的总能量D.达到平衡时,CO的浓度与CH3OH的浓度一定相等
放热反应与反应条件无关,可能需要加热才能发生,A错误;由该反应为放热反应可知,相同条件下,2 ml H2(g)与1 ml CO(g)的总能量一定高于1 ml CH3OH(g)的能量,B错误、C正确;平衡时,各物质的浓度是否相等与起始量、转化率有关,D错误。
3.某同学设计如图所示实验,探究反应中的能量变化。下列判断正确的是A.由实验可知,(a)、(b)、(c)所涉及的反应都是放热反应B.将实验(a)中的铝片更换为等质量的铝粉后释放出的热量有所增加C.实验(c)中将玻璃搅拌器改为铁质搅拌器对实验结果没有影响D.若用NaOH固体测定中和反应反应热,则测定结果数值偏高
A项,Ba(OH)2·8H2O与NH4Cl的反应属于吸热反应,错误;B项,铝片更换为等质量的铝粉,没有改变反应物的本质,放出的热量不变,错误;C项,铁质搅拌器导热性好,热量损失较大,错误;D项,NaOH固体溶于水时放热,使测定结果数值偏高,正确。
4.研究表明,在一定条件下,气态HCN(a)与HNC(b)两种分子的互变反应过程能量变化如图所示。下列说法正确的是A.HNC比HCN更稳定B.HCN转化为HNC,反应条件一定要加热C.HNC(g) HCN(g) ΔH=-59.3 kJ·ml-1D.加入催化剂,可以减小反应的热效应
能量越低越稳定,根据图示,等物质的量的HNC比HCN的能量高,HCN比HNC更稳定,A错误;HCN转化为HNC是吸热反应,吸热反应的发生不一定需要加热,B错误;加入催化剂,能降低反应的活化能,反应的热效应不变,D错误。
6.丙烷与溴原子能发生以下两种反应:①CH3CH2CH3(g)+Br·(g)―→CH3CH2CH2·(g)+HBr(g)②CH3CH2CH3(g)+Br·(g)―→ +HBr(g)反应过程的能量变化如图所示。下列说法不正确的是A.反应①与②均为吸热反应B.反应②使用了催化剂
催化剂能改变反应途径,降低反应的活化能,加快化学反应速率。反应②的活化能低,反应速率快,但反应①与②同时发生,不能确定反应②是否使用催化剂,B说法错误。
7.某反应2A===3B,它的反应能量变化曲线如图所示,下列有关叙述正确的是A.该反应为吸热反应B.A比B更稳定C.加入催化剂会改变反应的焓变D.整个反应的ΔH=E1-E2
由图像可知物质A、B的能量相对大小,A比B能量高,B更稳定,所以A→B释放能量,是放热反应,A、B错误;催化剂能改变反应途径和活化能大小,但不能改变焓变,C错误。
8.根据下列已知条件,所写热化学方程式正确的是A.H2的燃烧热为a kJ·ml-1:H2(g)+Cl2(g) 2HCl(g) ΔH=-a kJ·ml-1B.1 ml SO2、0.5 ml O2完全反应,放出热量98.3 kJ:2SO2(g)+O2(g) 2SO3(g) ΔH=-98.3 kJ·ml-1C.H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·ml-1,则H2SO4(aq)+Ba(OH)2(aq) ===BaSO4(s)+2H2O(l) ΔH=-114.6 kJ·ml-1D.96 g O2(g)能量比96 g O3(g)的能量低b kJ:3O2(g) 2O3(g) ΔH=+b kJ·ml-1
9.反应M+Z―→Q(ΔH<0)分两步进行:①M+Z―→X(ΔH>0),②X―→Q(ΔH<0)。下列示意图中,能正确表示总反应过程中能量变化的是
M+Z―→Q(ΔH<0)是放热反应,M和Z的能量之和大于Q;由①M+Z―→X(ΔH>0)可知这步反应是吸热反应,则M和Z的能量之和小于X;由②X―→Q(ΔH<0)是放热反应,故X的能量大于Q;综上可知,只有图像D符合。
10.(2021·浙江1月选考,20)已知共价键的键能与热化学方程式信息如下表:
则2O(g)===O2(g)的ΔH为A.428 kJ·ml-1 B.-428 kJ·ml-1C.498 kJ·ml-1 D.-498 kJ·ml-1
设O==O的键能为x,则(2×436 kJ·ml-1+x)-2×2×463 kJ·ml-1=-482 kJ·ml-1,x=498 kJ·ml-1,所以2O(g)===O2(g)的ΔH=-498 kJ·ml-1,D正确。
11.下列示意图表示正确的是A.甲图表示Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH=+26.7 kJ·m1-1反应的能量变化B.乙图表示碳的燃烧热C.丙图表示实验的环境温度为20 ℃,将物质的量浓 度相等、体积分别为V1、V2的H2SO4、NaOH溶液 混合,混合液的最高温度随V(NaOH)的变化(已知 V1+V2=60 mL)D.已知稳定性顺序:B
12.C2H6在Ni的活化下可放出CH4,其反应历程如图所示:下列关于活化历程的说法正确的是A.该转化过程ΔH>0B.在此反应过程中Ni的成键数目未发生 变化C.该反应过程中,最大能垒(活化能)为 204.32 kJ·ml-1D.整个过程中,Ni是该反应的催化剂
据反应物和生成物所具有的能量可以判断出,该反应为放热反应,故A错误;根据图示,过渡态1中Ni的成键数目为2,过渡态2中Ni的成键数目为
3,反应过程中Ni的成键数目发生了变化,故B错误;根据图示,中间体2到过渡态2的能垒(活化能)最大,为204.32 kJ·ml-1,故C正确;根据图示,Ni是反应物不是催化剂,故D错误。
13.(1)已知CH3OH(l)的燃烧热ΔH=-726.5 kJ·ml-1,CH3OH(l)+ O2(g)===CO2(g)+2H2(g) ΔH=-a kJ·ml-1,则a____(填“>”“<”或“=”)726.5。
该反应未完全燃烧,生成的氢气燃烧还要放出热量,则a<726.5。
(2)将Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 ml Cl2参与反应时释放出145.0 kJ热量,写出该反应的热化学方程式:_________________________________________________________________。
2Cl2(g)+2H2O(g)+C(s)===4HCl(g)+
CO2(g) ΔH=-290.0 kJ·ml-1
当有1 ml Cl2参与反应时释放出145.0 kJ热量,该反应的热化学方程式:2Cl2(g)+2H2O(g)+C(s)===4HCl(g)+CO2(g) ΔH=-145.0 kJ·ml-1×2=-290.0 kJ·ml-1。
(3)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料:4Al(s)+3TiO2(s)+3C(s)===2Al2O3(s)+3TiC(s) ΔH=-1 176.0 kJ·ml-1,则反应过程中,每转移1 ml电子放出的热量为__________。
(4)CO2与H2在某催化剂的作用下反应如图所示:
写出该反应的热化学方程式:____________________________________________________________。
CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH=
-46 kJ·ml-1
由反应图示可知图形与化学键对应关系为
ΔH=反应物总键能-生成物总键能=2×803 kJ·ml-1+3×436 kJ·ml-1-3×414 kJ·ml-1-326 kJ·ml-1-3×464 kJ·ml-1=-46 kJ·ml-1。
14.(1)某科研小组尝试利用固体表面催化工艺进行CH4的裂解。若用 、 、 、 分别表示CH4、C2H2、H2和固体催化剂,在固体催化剂表面CH4的裂解过程如图所示,从吸附到解吸的过程中,能量状态最高的是_____(填字母),其理由是_____________________________________________________________________________________________________________。
A→B是甲烷中的C—H断裂过程,断键吸热,A的能量小于B;B→C是形成化学键的过程,成键放热,B的能量大于C
(2)[2021·海南,16(2)]已知:CO(g)+ O2(g)===CO2(g) ΔH=-283 kJ·ml-1。25 ℃,100 kPa时,气态分子断开1 ml化学键的焓变称为键焓。已知O==O、C≡O的键焓分别为495 kJ·ml-1、799 kJ·ml-1,CO2(g)分子中碳氧键的键焓为________kJ·ml-1。
(3)[2021·湖北,19(1)]反应Ⅰ(直接脱氢):C3H8(g) C3H6(g)+H2(g) ΔH1=+125 kJ·ml-1;已知键能:E(C—H)=416 kJ·ml-1,E(H—H)=436 kJ·ml-1,由此计算生成1 ml碳碳π键放出的能量为______kJ。
反应Ⅰ中断裂2 ml C—H、形成1 ml碳碳π键和1 ml H—H,故416 kJ·ml-1×2-E(碳碳π键)-436 kJ·ml-1=+125 kJ·ml-1,解得E(碳碳π键)=271 kJ·ml-1。
(4)CO2与H2在催化剂的作用下反应历程如图所示:反应历程中活化能(能垒)最大的化学方程式为_____________________________________,CO2(g)+H2(g)===·CO(g)+H2O(g) ΔH=___________eV·ml-1。
大单元三 第八章 第33讲 化学键-备战2025年高考化学大一轮复习课件(人教版): 这是一份大单元三 第八章 第33讲 化学键-备战2025年高考化学大一轮复习课件(人教版),文件包含大单元三第八章第33讲化学键pptx、大单元三第八章第33讲化学键教师版docx、大单元三第八章第33讲化学键学生版docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
大单元一 第一章 第四讲 氧化还原反应方程式的配平及计算-备战2025年高考化学大一轮复习课件(人教版): 这是一份大单元一 第一章 第四讲 氧化还原反应方程式的配平及计算-备战2025年高考化学大一轮复习课件(人教版),文件包含大单元一第一章第4讲氧化还原反应方程式的配平及计算pptx、大单元一第一章第4讲氧化还原反应方程式的配平及计算教师版docx、大单元一第一章第4讲氧化还原反应方程式的配平及计算学生版docx等3份课件配套教学资源,其中PPT共53页, 欢迎下载使用。
大单元一 第一章 第二讲 离子反应 离子方程式-备战2025年高考化学大一轮复习课件(人教版): 这是一份大单元一 第一章 第二讲 离子反应 离子方程式-备战2025年高考化学大一轮复习课件(人教版),文件包含大单元一第一章第2讲离子反应离子方程式pptx、大单元一第一章第2讲离子反应离子方程式教师版docx、大单元一第一章第2讲离子反应离子方程式学生版docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。












