




备战2025届新高考化学一轮总复习第6章化学反应与能量第31讲原电池和化学电源课件
展开1.认识化学能与电能相互转化的实际意义及其重要应用。2.能分析、解释原电池的工作原理,能设计简单的原电池。3.能列举常见的化学电源,并能利用相关信息分析化学电源的工作原理。4.能综合考虑化学变化中的物质变化和能量变化来分析、解决实际问题,如新型电池的开发等。
考点一 原电池的工作原理及应用
1.原电池及构成条件(1)原电池情境思考原电池工作时能量转化形式为________________;根据原电池形成条件,下列反应理论上可以设计成原电池的是________(填字母)。 A.Ba(OH)2·8H2O与NH4Cl的反应B.KOH和HCl的反应C.Cu和AgNO3的反应D.H2和O2的反应
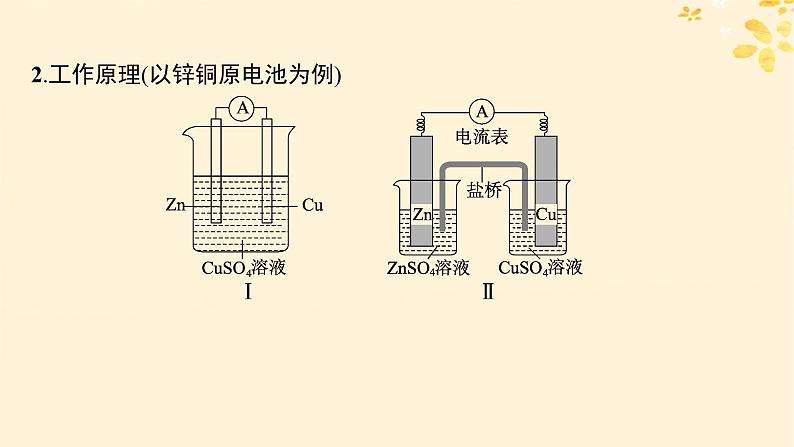
2.工作原理(以锌铜原电池为例)
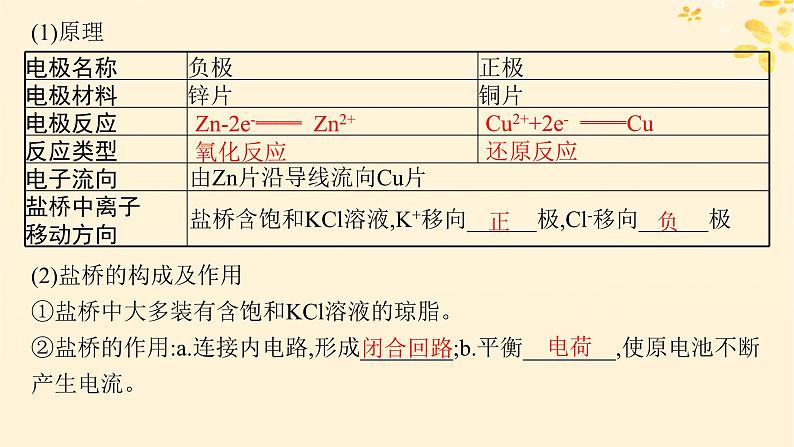
(2)盐桥的构成及作用①盐桥中大多装有含饱和KCl溶液的琼脂。②盐桥的作用:a.连接内电路,形成________;b.平衡________,使原电池不断产生电流。
Zn-2e-══ Zn2+
Cu2++2e- ══Cu
3.原电池原理的应用(1)比较金属的活动性强弱:原电池中,一般负极是活动性________的金属,正极是活动性较弱的金属(或非金属)。 (2)加快化学反应速率
情境思考若用粗锌(含少量金属铜)代替纯锌进行实验,氢气的生成速率明显加快的原因是________________________________。
(3)用于金属的防护:将需要保护的金属制品作原电池的________而受到保护。
金属铜、金属锌和硫酸形成原电池,金属锌失去电子的速率加快,生成H2速率加快
【应用示例】设计原电池装置证明Fe3+的氧化性比Cu2+强。(1)写出能说明氧化性Fe3+大于Cu2+的离子方程式: ________________________________。 (2)若要将上述反应设计成原电池,电极反应式分别是①负极: ________________________________。 ②正极: ________________________________。 (3)在方框中画出装置图,指出电极材料和电解质溶液:
2Fe3++Cu══ 2Fe2++Cu2+
Cu-2e- ══ Cu2+
2Fe3++2e- ══ 2Fe2+
考向1 原电池的构成及工作原理例1(2023·广东汕头联考)下图是以Cu和Zn为电极的两种原电池,设NA为阿伏加德罗常数的值,下列相关叙述错误的是( )
解析 (b)为双液原电池,避免了Zn与CuSO4溶液接触,(a)为单液原电池,负极Zn与CuSO4溶液接触,部分Cu2+会直接与Zn在负极反应,进而形成微小的原电池,能量利用率低且电流不稳定,A错误;活泼金属作负极,所以两原电池都是Zn作负极,Cu作正极,B正确;阳离子移向正极,阴离子移向负极,C正确; (b)中Zn片质量减少6.5 g时,理论上电路中转移0.2 ml电子,数目为0.2NA,D正确。
[对点训练1] 某学习小组设计如图所示原电池装置。该电池总反应为Cl-+Ag+═AgCl↓。下列说法正确的是( )
A.放电时,X电极发生还原反应B.放电时,Y电极反应式为Ag++e-═AgC.放电时,盐桥中K+向盛有NaCl溶液的烧杯中移动D.外电路中每通过0.1 ml e-,X电极质量增加14.35 g
解析 该原电池X电极反应式为Ag-e-+Cl-═AgCl,A错误;Y电极为原电池正极,电极反应式为Ag++e-═Ag,B正确;放电时,盐桥中的钾离子向正极移动, X电极为负极,C错误;放电时,当电路中转移0.1 ml e-时,X电极会有0.1 ml Ag失去0.1 ml电子生成银离子,银离子会与氯离子反应生成氯化银沉淀,D错误。
考向2 原电池原理的应用例2有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
据此判断这四种金属的活动性强弱顺序为( )A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c
解析 由实验①可知,a作原电池负极,b作原电池正极,金属活动性:a>b;由实验②可知,b极有气体产生,c极无变化,则活动性:b>c;由实验③可知,d极溶解,则d作原电池负极,c作正极,则活动性:d>c;由实验④可知,电流从a极流向d极,则d极为原电池负极,a极为原电池正极,则活动性:d>a。综上所述可知,活动性:d>a>b>c。
[对点训练2] 依据化学反应设计原电池(选用相同的盐桥)时,下列各项中合理的是( )
解析 原电池中,负极金属的活动性一般强于正极金属,Zn比Fe的活动性强,形成原电池时Zn作负极,A、C均错误;使用盐桥形成原电池时,为得到稳定的电流,正极、负极两个半电池中电解质溶液一般是含相应电极金属阳离子的盐溶液,D错误,B正确。
Zn+2OH--2e-══ Zn(OH)2
2MnO2+2H2O+2e- ══ 2MnOOH+2OH-
Zn+2OH--2e- ══ Zn(OH)2
Ag2O+H2O+2e- ══ 2Ag+2OH-
3.燃料电池氢氧燃料电池是目前最成熟的燃料电池,可分为酸性和碱性两种。
2H2+4OH--4e-══ 4H2O
O2+4e-+4H+ ══ 2H2O
【应用示例】燃料电池的电解质常有四种类型,酸性溶液、碱性溶液、固体电解质(可传导O2-)、熔融碳酸盐,不同电解质会对总反应式、电极反应式有影响。以甲醇燃料电池为例,试写出在固体氧化物(其中O2-可以在固体介质中自由移动)中的电极反应式。正极:_________________________________, 负极:_________________________________。
CH3OH-6e-+3O2-═CO2+2H2O
考向1 新型一次电池及应用例1(2023·广东惠州第三次调研)中科院科学家设计出一套利用SO2和太阳能综合制氢方案,其基本工作原理如图所示,下列说法错误的是( )
[对点训练1] (2022·湖南卷)海水电池在海洋能源领域备受关注,一种锂-海水电池构造示意图如下。下列说法错误的是( ) A.海水起电解质溶液作用B.N极仅发生的电极反应:2H2O+2e-═2OH-+H2↑C.玻璃陶瓷具有传导离子和防水的功能D.该锂-海水电池属于一次电池
解析 海水中含有丰富的电解质,如氯化钠、氯化镁等,可作为电解质溶液,A正确。锂-海水电池的总反应为4Li+2H2O+O2═4LiOH,M极上Li失去电子发生氧化反应,则M极为负极,电极反应式为Li-e-═Li+,N极为正极,电极反应式为O2+2H2O+4e-═4OH-,B错误。Li为活泼金属,易与水反应,玻璃陶瓷的作用是防止水和Li反应,并能传导离子,C正确。该电池不可充电,属于一次电池,D正确。
[对点训练2] 一种新型Na-CaFeO3可充电电池,其工作原理如图所示。下列说法正确的是( )
A.放电时,电极N是负极B.充电时,Na+通过钠离子交换膜向M极移动C.放电时,N极电极反应为2CaFeO2.5+O2--2e-═2CaFeO3D.充电时,每生成1 ml Na,有机电解质的整体质量减小23 g
解析 从图示装置可看出,Na-CaFeO3可充电电池放电时,Na失电子生成钠离子,所以Na电极为负极,发生氧化反应,生成的钠离子通过有机电解质移向右侧,右侧CaFeO3电极作正极,在放电时,CaFeO3转化为CaFeO2.5,发生还原反应。根据上述分析可知,放电时,电极M为负极,A错误;充电为放电的逆过程,所以充电时,Na+通过钠离子交换膜向阴极(M极)移动,B正确;放电时, N极CaFeO3转化为CaFeO2.5,发生还原反应,其电极反应为2CaFeO3+2e-═2CaFeO2.5+O2-,C错误;充电时,每生成1 ml Na,同时也会有0.5 ml O2-消耗,所以有机电解质的整体质量减小23 g+0.5 ml×16 g· ml-1=31 g,D错误。
考向3 燃料电池及分析例3(2021·山东卷)以KOH溶液为离子导体,分别组成CH3OH-O2、N2H4-O2、(CH3)2NNH2-O2清洁燃料电池,下列说法正确的是( )A.放电过程中,K+均向负极移动B.放电过程中,KOH物质的量均减小C.消耗等质量燃料,(CH3)2NNH2-O2燃料电池的理论放电量最大D.消耗1 ml O2时,理论上N2H4-O2燃料电池气体产物的体积在标准状况下为11.2 L
[对点训练3] 以葡萄糖为燃料的微生物燃料电池结构如图所示(假设M、N两电极均为惰性电极),下列说法正确的是( ) A.N电极上发生氧化反应,得到电子B.电池工作时,外电路中电子的流动方向:N电极→导线→M电极C.M电极上的电极反应式:O2+4H+-4e-═2H2OD.电路中每转移1.2 ml电子,此时生成CO2的质量为8.8 g
解析 N极是通入燃料的一极为负极,负极发生氧化反应失去电子,不是得到电子,A错误;N为负极,M为正极,电子由负极经过外电路流入正极,B正确;M极为正极发生还原反应,得到电子,不是失去电子,C错误;C6H12O6中碳的平均化合价为0价,生成二氧化碳为+4价,生成1 ml CO2转移4 ml电子,1.2 ml电子可以生成0.3 ml CO2,0.3 ml CO2是13.2 g,D错误。
进阶1 练易错·避陷阱1.(2024·广东湛江调研)氢负离子具有强还原性,是一种颇具潜力的能量载体。2023年4月5日,我国科学家开发了首例室温全固态氢负离子二次电池,该电池通过固态氢负离子导体实现对H-的快速传导,其工作原理如图所示,其中放电时乙电极的电极反应式为M+xH--xe-═MHx(M为Li、Na、K、Mg、Ti等金属),下列说法错误的是( )
A.放电时,电子经外电路流向甲电极B.放电时,氢负离子移向乙电极C.充电时,甲电极发生的反应可表示为MHn-x-xe-+xH-═MHnD.可将固态离子导体替换成电解质水溶液,对氢负离子进行传导
解析 放电时,乙电极的电极反应式为M+xH--xe-═MHx,则乙电极为负极,甲电极为正极,放电时,电子经外电路流向正极,A正确;放电时,阴离子移向负极,B正确;充电时,甲电极为阳极,发生氧化反应:MHn-x-xe-+xH-═MHn,C正确;氢负离子具有强还原性,可与水反应生成氢气,因此不可替换成电解质水溶液,D错误。
2.(2023·广东揭阳二模)硅-酸电池是一种新型电池,如图为硅-酸电池的装置示意图,已知:硅可与NaOH溶液反应。下列说法错误的是( )
A.负极区的电极附近溶液pH减小B.电池转移1 ml电子,溶液中有1 ml H+通过质子交换膜移向正极区C.硅-酸电池电解质溶液用碱性溶液代替,也有较好的长期放电性能D.电池总反应为Si+2MnO2+4H+═SiO2+2Mn2++2H2O
解析 由图可知,MnO2在α-MnO2电极得到电子生成Mn2+,则α-MnO2电极是正极,CuSi@C电极为负极。Si在负极失去电子生成SiO2,电极反应式为Si-4e-+2H2O═SiO2+4H+,电极附近H+浓度增大,pH减小,A正确;原电池中,阳离子向正极移动,电池转移1 ml电子,溶液中有1 ml H+通过质子交换膜移向正极区,B正确;Si能够和碱性溶液直接反应,硅-酸电池电解质溶液不能用碱性溶液代替,C错误;MnO2在α-MnO2电极得到电子生成Mn2+,电极反应式为MnO2+2e-+4H+═Mn2++2H2O,结合负极电极反应式:Si-4e-+2H2O═SiO2+4H+,电池总反应为Si+2MnO2+4H+═SiO2+2Mn2++2H2O,D正确。
进阶2 练热点·提素能3.(2023·广东广州一模)新型Li-Mg双离子可充电电池是一种高效、低成本的储能电池,其工作原理如图所示。放电时电极a的反应为Li1-xFePO4+xLi+ +xe-═LiFePO4。下列说法不正确的是( )
A.充电时,Mg极为阴极B.放电时,Li+从Ⅰ室向Ⅱ室迁移C.放电时,Ⅱ室Li2SO4溶液的浓度增大D.每消耗1 ml Mg,电极a质量理论上增加14 g
解析 放电时电极a的反应为Li1-xFePO4+xLi++xe-═LiFePO4,a为正极,Mg为负极,所以充电时Mg为阴极,A正确;放电时Ⅰ室为负极区,Ⅱ室为正极区,阳离子向正极移动,所以向Ⅱ室迁移,B正确;放电时电极a的反应为Li1-xFePO4 +xLi++xe-═LiFePO4,消耗Li+,同时锂离子通过透过膜进入Ⅱ室,所以Li2SO4溶液的浓度不变,C错误;放电时Mg发生反应:Mg-2e-═Mg2+,当有1 ml Mg发生反应时,转移2 ml e-,电极a理论上增加2 ml Li+,质量为14 g,D正确。
4.目前科学家发明了一种利用微生物进行脱硫、脱氮的原电池装置,其基本原理如图所示(图中隔膜为质子交换膜)。下列有关说法正确的是( )
进阶3研真题·明考向5.(2023·广东卷,6)负载有Pt和Ag的活性炭,可选择性去除Cl-实现废酸的纯化,其工作原理如图。下列说法正确的是( )
A.Ag作原电池正极B.电子由Ag经活性炭流向PtC.Pt表面发生的电极反应:O2+2H2O+4e-═4OH-D.每消耗标准状况下11.2 L的O2,最多去除1 ml Cl-
解析 本题考查了原电池结构与工作原理。O2在Pt得电子发生还原反应,Pt为正极,Cl-在Ag极失去电子发生氧化反应,Ag为负极。由分析可知,Cl-在Ag极失去电子发生氧化反应,Ag为负极,A项错误;电子由负极Ag经活性炭流向正极Pt,B项正确;溶液为酸性,故Pt表面发生的电极反应为O2+4H++4e-═2H2O,C项错误;每消耗标准状况下11.2 L的O2,转移电子2 ml,而2 ml Cl-失去2 ml电子,故最多去除2 ml Cl-,D项错误。
新教材适用2024版高考化学一轮总复习第6章化学反应与能量第18讲原电池化学电源课件: 这是一份新教材适用2024版高考化学一轮总复习第6章化学反应与能量第18讲原电池化学电源课件,共60页。PPT课件主要包含了考点一,考点二,必备知识·梳理夯实,自发进行,氧化还原,2反应原理,Zn片,Cu片,电极材料,装置如下图所示等内容,欢迎下载使用。
2024年高考化学一轮总复习 第8单元 第1讲 原电池 化学电源 课件: 这是一份2024年高考化学一轮总复习 第8单元 第1讲 原电池 化学电源 课件,共60页。PPT课件主要包含了化学能,氧化还原,活泼性,直接或间接接触,Cl-,电极材料,考点二化学电源,Ag2O,PbO2,高考真题演练等内容,欢迎下载使用。
人教版高考化学一轮复习第6章化学反应与能量第2讲原电池化学电源课件: 这是一份人教版高考化学一轮复习第6章化学反应与能量第2讲原电池化学电源课件












