






备战2025届新高考化学一轮总复习第8章水溶液中的离子反应与平衡第39讲电离平衡课件
展开1.理解弱电解质在水溶液中的电离平衡,能用电离方程式进行表征。2.依据勒夏特列原理分析外界条件对电离平衡的影响及结果。3.了解电离平衡常数的含义,掌握电离平衡常数的相关计算。
考点一 电离平衡及影响因素
考点二 电离平衡常数及应用
1.弱电解质电离平衡的建立及特征
(1)开始时,v(电离)________,而v(结合)为________。 (2)平衡的建立过程中,v(电离) ________v(结合)。 (3)当v(电离) ________v(结合)时,电离过程达到平衡状态。
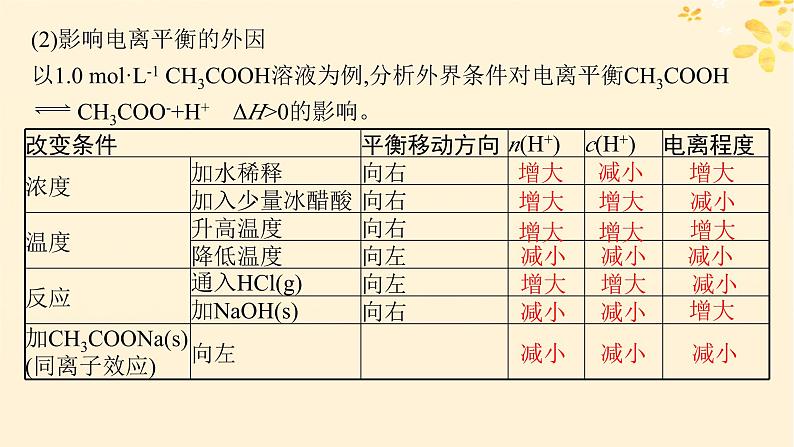
2.影响电离平衡的因素(1)影响电离平衡的内因影响电离平衡的内因是弱电解质本身的________________,其他条件相同时,电解质越弱越难电离。
影响电离平衡的决定性因素
【应用示例】常温下,①100 mL 0.01 ml·L-1的CH3COOH溶液,②10 mL 0.1 ml·L-1的CH3COOH溶液。用“>”“=”或“<”回答下列问题。(1)c(CH3COO-):①________②。 (2)电离程度:①________②。 (3)在上述两种溶液中加入足量锌片。开始时的反应速率:①________②,反应结束生成相同状况下H2的体积:①________②。 (4)与同浓度的NaOH溶液完全反应消耗NaOH溶液的体积:①________②。
考向1 外界条件对电离平衡的影响例1(2023·广东广州检测)将0.1 ml·L-1 CH3COOH溶液加水稀释或加入少量CH3COONa晶体时,都会引起的变化是( )A.溶液的pH增大B.CH3COOH的电离度变大C.溶液中c(OH-)减小D.溶液的导电能力减弱
A.加水,平衡向右移动,溶液中氢离子浓度增大B.通入过量SO2气体,平衡向左移动,溶液pH增大C.滴加新制氯水,平衡向左移动,溶液pH减小D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
解析 加水促进H2S的电离,由于溶液体积增大,氢离子浓度减小,A项错误;反应:2H2S+SO2═3S↓+2H2O,pH增大,当SO2过量,溶液显酸性,因H2SO3酸性比H2S强,故pH减小,B项错误;滴加新制氯水,发生反应Cl2+H2S═2HCl+S↓,平衡向左移动,生成了强酸,溶液pH减小,C项正确;加入少量硫酸铜固体,发生反应H2S+Cu2+═CuS↓+2H+,H+浓度增大,D项错误。
考向2 电离平衡移动的结果及分析例2(2024·湖南长沙南雅中学高三模拟)室温下,向10 mL pH=3的CH3COOH溶液中加入下列物质,对所得溶液的分析正确的是( )
解析 向10 mL pH=3的CH3COOH溶液中加入90 mL H2O,醋酸的电离平衡正向移动,c(H+)>10-4 ml·L-1,故由水电离出的c(H+)<10-10 ml·L-1,选项A错误;向10 mL pH=3的CH3COOH溶液中加入0.1 ml CH3COONa固体,醋酸根离子浓度增大,醋酸的电离平衡逆向移动,c(H+)降低,c(OH-)比原CH3COOH溶液中的大,选项B正确;向10 mL pH=3的CH3COOH溶液中加入10 mL pH=1的H2SO4溶液,氢离子浓度增大,抑制醋酸的电离,CH3COOH的电离程度减小,选项C错误;向10 mL pH=3的CH3COOH溶液中加入10 mL pH=11的NaOH溶液,醋酸过量,所得溶液呈酸性,故c(CH3COO-)>c(Na+)>c(H+)>c(OH-),选项D错误。
[对点训练2] (2023·广东江门检测)一定温度下,冰醋酸加水稀释过程中,溶液导电能力的实验结果如图所示,下列说法错误的是( )
A.冰醋酸导电能力约为零B.a、b、c三点溶液中,溶液的pH:c>a>bC.a、b、c三点溶液中,CH3COOH电离程度最大的是b点D.a、b、c三点溶液用1 ml·L-1 NaOH溶液中和,恰好完全中和时消耗NaOH溶液体积相等
解析 由图可知,加水量为0时为冰醋酸,冰醋酸是纯净的醋酸,不能电离,导电能力约为零,A正确;由图可知,导电能力b>a>c,溶液中氢离子浓度b>a>c,pH:b
通常用Ka、Kb分别表示弱酸、弱碱的电离平衡常数
2.电离平衡常数的表示(1)一元弱酸和一元弱碱一元弱酸和一元弱碱均一步电离,直接书写,例如:
3.电离平衡常数的特点
【应用示例】常温下0.1 ml·L-1的CH3COOH溶液在加水稀释过程中,填写下列表达式中的数据变化情况(填“变大”“变小”或“不变”)。
4.电离度(教材拓展)
考向1 根据电离常数判断弱电解质的相对强弱例1(教材改编题)25 ℃时,HNO2、HF、HCN三种酸的电离平衡常数分别为6.3×10-4、5.6×10-4、6.2×10-10中的一种。已知下列反应可以发生:①NaCN+HNO2═HCN+NaNO2;②NaCN+HF═HCN+NaF;③NaNO2+HF═HNO2+NaF。由此判断,下列有关叙述不正确的是( )A.Ka(HF)=6.3×10-4,Ka(HNO2)=6.2×10-10B.电离常数:Ka(HF)>Ka(HNO2)>Ka(HCN)C.反应HNO2+NaF═NaNO2+HF不能发生D.该温度下,0.1 ml·L-1 HF溶液中c(H+)≈8×10-3 ml·L-1
解析 根据酸与盐发生复分解反应遵循“较强酸制取较弱酸”的规律,由反应①、②、③可得酸性:HNO2>HCN、HF>HCN、HF>HNO2,从而可得酸性:HF>HNO2>HCN,则电离平衡常数:Ka(HF)>Ka(HNO2)>Ka(HCN)。结合三个电离平衡常数的相对大小推知,Ka(HF)=6.3×10-4,Ka(HNO2)=5.6×10-4,Ka(HCN)=6.2×10-10,A错误;由前面分析可知,B正确;由于酸性:HF>HNO2,故HNO2和NaF不发生反应,C正确;结合电离常数表达式可得,c2(H+)=Ka(HF)·c(HF)=6.3×10-4×0.1,解得c(H+)≈8×10-3 ml·L-1,D正确。
[对点训练1] (2023·广东广州联考)部分弱电解质的电离常数如下表:
考向2 结合电离常数判断溶液中微粒浓度比值的变化例2 25 ℃时,下列有关电解质溶液的说法正确的是( )
进阶1 练易错·避陷阱1.(2023·广东广州统考)对室温下pH和体积均相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是( )A.温度都升高20 ℃后,醋酸溶液的pH小于盐酸B.加入少量的醋酸钠晶体后,只有醋酸的pH发生变化C.加水稀释10倍后,盐酸的pH变化较小D.加入足量的镁条充分反应后,两溶液产生的氢气一样多
解析 醋酸在溶液中的电离为吸热过程,升高温度,平衡右移,溶液中的氢离子浓度增大,pH减小,而盐酸是强酸,升高温度,溶液中的氢离子浓度基本不变,则温度都升高20 ℃后,醋酸溶液的pH小于盐酸,A正确;盐酸中加入少量的醋酸钠晶体后,盐酸与醋酸钠反应生成醋酸和氯化钠,溶液中氢离子浓度减小,溶液pH增大,B错误;醋酸在溶液中存在电离平衡,分别加水稀释10倍后,电离平衡右移,所以pH相同的醋酸溶液的pH变化小于盐酸,C错误;醋酸在溶液中存在电离平衡,pH相同的醋酸溶液的浓度大于盐酸,中和能力强于盐酸,与足量的镁条充分反应后,醋酸溶液产生的氢气多于盐酸,D错误。
2.已知亚磷酸(H3PO3)为二元弱酸,常温下,向某浓度的亚磷酸溶液中逐滴加入一定物质的量浓度的KOH溶液,混合溶液的pH与离子浓度的关系如图所示。
(1)写出亚磷酸电离的方程式:__________________________、__________________________。
4.常温时,改变饱和氯水的pH,得到部分含氯微粒的物质的量分数与pH的关系如图所示。下列叙述不正确的是( )
进阶3 研真题·明考向5.(2022·广东卷,17节选)食醋是烹饪美食的调味品,有效成分主要为醋酸(用HAc表示)。HAc的应用与其电离平衡密切相关。25 ℃时,HAc的Ka=1.75×10-5=10-4.76。(1)某小组研究25 ℃下HAc电离平衡的影响因素。提出假设:稀释HAc溶液或改变Ac-浓度,HAc电离平衡会发生移动。设计方案并完成实验:用浓度均为0.1 ml·L-1的HAc和NaAc溶液,按下表配制总体积相同的系列溶液;测定pH,记录数据。
①根据表中信息,补充数据:a=________,b=________。 ②由实验Ⅰ和Ⅱ可知,稀释HAc溶液,电离平衡________(填“正”或“逆”)向移动;结合表中数据,给出判断理由:_____________________________________________________________________________________。 ③由实验Ⅱ~Ⅷ可知,增大Ac-浓度,HAc电离平衡逆向移动。实验结论:假设成立。
实验Ⅱ相较于实验Ⅰ,醋酸溶液稀释
到体积为原来的10倍,而实验Ⅱ的pH增大值小于1
对比数据发现,实验Ⅷ中pH=4.65与资料数据Ka=10-4.76存在一定差异;推测可能由物质浓度准确程度不够引起,故先准确测定HAc溶液的浓度再验证。①移取20.00 mL HAc溶液,加入2滴酚酞溶液,用0.100 0 ml·L-1 NaOH溶液滴定至终点,消耗体积为22.08 mL,则该HAc溶液的浓度为_______ ml·L-1。②用上述HAc溶液和0.100 0 ml·L-1 NaOH溶液,配制等物质的量的HAc与NaAc混合溶液,测定pH,结果与资料数据相符。
(3)小组进一步提出:如果只有浓度均约为0.1 ml·L-1的HAc和NaOH溶液,如何准确测定HAc的Ka。小组同学设计方案并进行实验。请完成下表中Ⅱ的内容。
实验总结:得到的结果与资料数据相符,方案可行。(4)根据Ka可以判断弱酸的酸性强弱。写出一种无机弱酸及其用途________________________。
向滴定后的混合液中加入20.00 mL HAc溶液
HClO:漂白剂和消毒液(或H2SO3:还原剂、防腐剂或H3PO4:食品添加剂、制药、生产肥料等)
备战2025届新高考化学一轮总复习第8章水溶液中的离子反应与平衡热点专攻19电离平衡常数的计算课件: 这是一份备战2025届新高考化学一轮总复习第8章水溶液中的离子反应与平衡热点专攻19电离平衡常数的计算课件,共10页。PPT课件主要包含了热点精讲,热点精练,2×10-7等内容,欢迎下载使用。
新教材适用2024版高考化学一轮总复习第8章水溶液中的离子反应与平衡第24讲水的电离和溶液的pH课件: 这是一份新教材适用2024版高考化学一轮总复习第8章水溶液中的离子反应与平衡第24讲水的电离和溶液的pH课件,共60页。PPT课件主要包含了考点一,考点二,考点三,考点一水的电离,必备知识·梳理夯实,×10-14,电解质,OH-,归纳拓展,cH+等内容,欢迎下载使用。
新教材适用2024版高考化学一轮总复习第8章水溶液中的离子反应与平衡第23讲弱电解质的电离平衡课件: 这是一份新教材适用2024版高考化学一轮总复习第8章水溶液中的离子反应与平衡第23讲弱电解质的电离平衡课件,共60页。PPT课件主要包含了考点一,考点二,考点三,必备知识·梳理夯实,强碱大多数盐,电离成离子,电离的,形成分,归纳拓展,2表达式等内容,欢迎下载使用。












