





备战2025届新高考化学一轮总复习第8章水溶液中的离子反应与平衡第41讲酸碱中和滴定及拓展应用课件
展开1.了解酸碱中和滴定的原理和滴定终点的判断方法,掌握指示剂的变色范围及选择方法。2.掌握酸碱中和滴定的操作、数据处理方法及误差分析的方法;掌握滴定法在定量测定实验中的应用。
考点一 酸碱中和滴定的原理与操作
考点二 氧化还原滴定和沉淀滴定
答题模板4 滴定终点的判断及描述
考点一酸碱中和滴定的原理与操作
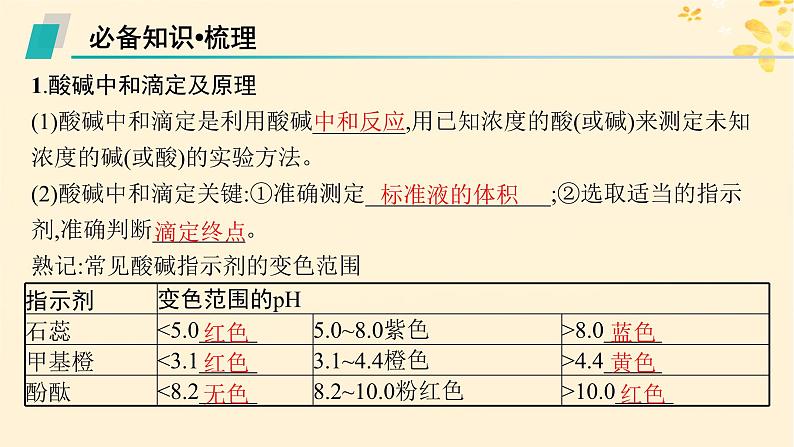
1.酸碱中和滴定及原理(1)酸碱中和滴定是利用酸碱________,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法。 (2)酸碱中和滴定关键:①准确测定________________;②选取适当的指示剂,准确判断________。 熟记:常见酸碱指示剂的变色范围
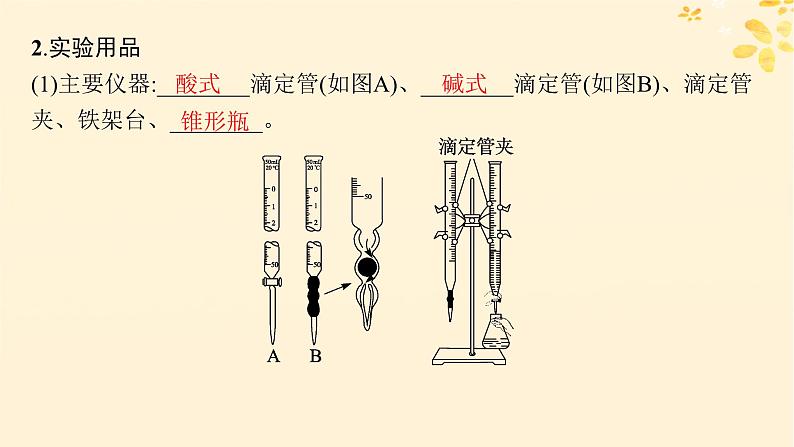
2.实验用品(1)主要仪器:________滴定管(如图A)、________滴定管(如图B)、滴定管夹、铁架台、________。
【应用示例】如图表示50.00 mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积______________________。
一定大于(50-a) mL
(2)试剂:标准溶液、待测溶液、指示剂、蒸馏水。(3)滴定管的使用:滴定管的精确度为______ mL。
3.实验操作(以酚酞作指示剂,用标准盐酸滴定待测NaOH溶液)(1)滴定准备
异常数据舍弃,再求数据平均值,减小误差
4.滴定曲线以0.100 0 ml·L-1 NaOH溶液滴定20.00 mL 0.100 0 ml·L-1盐酸为例
考向1 酸碱中和滴定操作及分析例1(2023·广东佛山统考)用NaOH标准液滴定未知浓度盐酸,滴定曲线如图1实线所示。下列说法正确的是( )
A.若使用酚酞作指示剂,滴定终点pH=7B.图1中虚线可表示该NaOH标准液滴定与盐酸浓度相同的醋酸C.向锥形瓶中加入少量蒸馏水,对测量结果没有影响D.图2为碱式滴定管,读数是28.20 mL
解析 酚酞的变色范围8~10,故若使用酚酞作指示剂,滴定终点pH略大于7,A错误;醋酸为弱酸,与盐酸浓度相同的醋酸的初始pH大于盐酸,B错误;向锥形瓶中加入少量蒸馏水,不影响标准液用量,对测量结果没有影响,C正确;用NaOH标准液滴定未知浓度盐酸,则图2为碱式滴定管,但读数应该大于29.00 mL,D错误。
[对点训练1] 现用中和滴定来测定某NaOH溶液的浓度。 (1)滴定:用________式滴定管盛装c ml·L-1盐酸标准液。如图表示某次滴定时50 mL滴定管中前后液面的位置。把用去的标准盐酸的体积填入表格中,此次滴定结束后的读数为________ mL,滴定管中剩余液体的体积_____________,可用______________作指示剂。
大于25.10 mL
(2)排出碱式滴定管中气泡的方法应采用下图________(填“甲”“乙”或“丙”)的操作,然后挤压玻璃球使尖嘴部分充满碱液。
(3)有关数据记录如下:
根据所给数据,写出计算NaOH溶液的物质的量浓度的表达式:_____________________________________(不必化简)。
考向2 酸碱中和滴定实验误差及分析例2实验室用标准盐酸测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏高的是( )A.酸式滴定管在装酸液前用标准盐酸润洗2~3次B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失C.锥形瓶内溶液颜色由黄色变橙色,立即记下滴定管液面所在刻度D.盛NaOH溶液的锥形瓶滴定前用水洗2~3次
[对点训练2] (2023·广东江门检测)在实验室里可用NaOH标准溶液滴定醋酸的方法准确测定某醋酸的物质的量浓度,下列操作会导致测定结果偏低的是( )A.滴定前锥形瓶未干燥B.未用NaOH标准溶液润洗滴定管C.滴定后俯视读数D.盛放标准液的滴定管滴定至终点时有一滴悬在管口
解析 A项,锥形瓶未干燥对实验结果无影响;B项,未润洗标准液滴定管,导致标准液浓度偏低,体积偏大,待测液浓度偏大;C项,滴定后俯视读数,导致读数偏小,标准液体积偏小,待测液浓度偏小;D项,达到滴定终点时,有一滴悬在管口,说明标准液体积偏大,待测液浓度偏大;故答案为C。
(2)读数误差分析 分析下列图示读数对滴定结果的影响:
①如图Ⅰ,开始仰视读数,滴定完毕俯视读数,滴定结 果会偏低。 ②如图Ⅱ,开始俯视读数,滴定完毕仰视读数,滴定结 果会偏高。
考向3 滴定曲线的分析例3(2023·广东深圳期末)等体积的两种一元酸“酸1”和“酸2”分别用等浓度的NaOH溶液滴定,滴定曲线如图所示。下列说法正确的是( )
A.“酸1”比“酸2”的酸性弱B.“酸2”的浓度为0.01 ml·L-1C.“酸2”的Ka的数量级约为10-5D.滴定“酸1”和“酸2”均可用甲基橙作指示剂
解析 由图中可以看出,滴定达终点时,“酸2”消耗NaOH溶液的体积大,则表明c(酸2)>c(酸1),而起始时pH(酸2)>pH(酸1),所以“酸1”比“酸2”的酸性强,A错误;“酸2”为弱酸,c(H+)=0.01 ml·L-1,则“酸2”的起始浓度比0.01 ml·L-1大得多,B错误;“酸2”滴定一半时,c(酸2)=c(酸2的酸根离子),此时溶液pH介于4~5之间,所以Ka的数量级约为10-5,C正确;滴定终点时,“酸2”的pH与酚酞的变色范围接近或重叠,可用酚酞作指示剂,D错误。
[对点训练3] 室温条件下,将0.1 ml·L-1的NaOH溶液逐滴滴入10 mL 0.1 ml·L-1 HB溶液中,所得溶液pH随NaOH溶液体积的变化如图。下列说法正确的是( ) A.Ka(HB)的数量级为10-4B.该中和滴定可采用酚酞作为指示剂C.V1=10D.b点时,NaOH与HB恰好完全反应
1.氧化还原滴定(1)原理:以氧化剂(或还原剂)为滴定剂,直接滴定一些具有还原性(或氧化性)的物质。(2)试剂
(3)实例①酸性KMnO4溶液滴定H2C2O4溶液
②Na2S2O3溶液滴定碘液
考向1 氧化还原滴定及应用例1某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下:Ⅰ.取样、氧的固定用溶解氧瓶采集水样。记录大气压及水体温度。将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2,实现氧的固定。Ⅱ.酸化、滴定将固氧后的水样酸化,MnO(OH)2被I-还原为Mn2+,在暗处静置5 min,然后用标准Na2S2O3溶液滴定生成的I2(反应原理: )。回答下列问题:
(1)“氧的固定”中发生反应的化学方程式为_________________________。(2)Na2S2O3溶液不稳定,使用前需标定。配制该溶液时需要的玻璃仪器有烧杯、玻璃棒、试剂瓶和________;蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除________及二氧化碳。 (3)取100.00 mL水样经固氧、酸化后,用a ml·L-1 Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为__________________________________;若消耗Na2S2O3溶液的体积为b mL,则水样中溶解氧的含量为__________ mg·L-1。(4)上述滴定完成时,若滴定管尖嘴处留有气泡会导致测定结果偏________ (填“高”或“低”)。
2Mn(OH)2+O2══ 2MnO(OH)2
当最后半滴标准液滴入时,溶液由蓝色变为无色,且半分钟内无变化
解析 (1)根据氧化还原反应原理,Mn(OH)2被氧气氧化为MnO(OH)2,由此可得反应的化学方程式为2Mn(OH)2+O2═2MnO(OH)2。(2)一定物质的量浓度溶液的配制还需要量筒量取液体体积;煮沸可以除去水中溶解的氧气,避免实验结果不准确。(3)该实验用硫代硫酸钠标准液滴定I2,终点现象:当滴入最后半滴标准溶液时,溶液由蓝色变为无色,且半分钟内无变化;根据关系式O2~2MnO(OH)2~2I2~4Na2S2O3,可得水样中溶解氧的含量为
(4)终点读数时有气泡,气泡占据液体应占有的体积,会导致消耗的Na2S2O3体积偏小,最终结果偏低。
[对点训练1] 为了测定某样品中NaNO2的含量,某同学进行如下实验:①称取样品a g,加水溶解,配制成100 mL溶液。②取25.00 mL溶液于锥形瓶中,用0.020 0 ml·L-1 KMnO4标准溶液(酸性)进行滴定,滴定结束后消耗KMnO4溶液V mL。(1)滴定过程中发生反应的离子方程式是___________________________;测得该样品中NaNO2的质量分数为________。 (2)若滴定过程中刚出现颜色变化就停止滴定,则测定结果________(填“偏大”“偏小”或“无影响”)。
考向2 沉淀滴定及应用例2(经典真题)用沉淀滴定法快速测定NaI等碘化物溶液中的c(I-),实验过程包括准备标准溶液和滴定待测溶液。Ⅰ.准备标准溶液a.准确称取AgNO3基准物4.246 8 g(0.025 0 ml)后,配制成250 mL标准溶液,放在棕色试剂瓶中避光保存,备用。b.配制并标定100 mL 0.100 0 ml·L-1 NH4SCN标准溶液,备用。
Ⅱ.滴定的主要步骤a.取待测NaI溶液25.00 mL置于锥形瓶中。b.加入25.00 mL 0.100 0 ml·L-1 AgNO3溶液(足量),使I-完全转化为AgI沉淀。c.加入NH4Fe(SO4)2溶液作指示剂。d.用0.100 0 ml·L-1 NH4SCN溶液滴定过量的Ag+,使其恰好完全转化为AgSCN沉淀后,体系出现淡红色,停止滴定。e.重复上述操作两次。三次测定数据如下表:
回答下列问题:(1)Ⅱ中b和c两步操作是否可以颠倒________,说明理由_____________________________________________________。 (2)所消耗的NH4SCN标准溶液平均体积为________ mL,测得c(I-)= ________ ml·L-1。 (3)在滴定管中装入NH4SCN标准溶液的前一步,应进行的操作为__________________________________。 (4)判断下列操作对c(I-)测定结果的影响(填“偏高”“偏低”或“无影响”)。①若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则测定结果_________。 ②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果________。
若颠倒,Fe3+与I-反应,指示剂耗尽,无法判断滴定终点
用NH4SCN标准溶液润洗滴定管2~3次
[对点训练2] 利用沉淀滴定法快速测定NaBr等卤化物溶液中c(Br-),实验过程包括配制标准溶液和滴定待测溶液。Ⅰ.配制标准溶液准确称取AgNO3基准物8.5 g,配制成500 mL标准溶液,放在棕色试剂瓶中避光保存,备用。Ⅱ.滴定的主要步骤a.取待测NaBr溶液25.00 mL,配制成100 mL溶液,取其中25.00 mL置于锥形瓶中。b.加入K2CrO4溶液作指示剂。c.用AgNO3标准溶液进行滴定,记录消耗标准溶液的体积。
d.重复上述操作三次,测定数据如下表:
e.数据处理。请回答下列问题:
(1)将称得的AgNO3配制成标准溶液,所使用的玻璃仪器除烧杯和玻璃棒外还有__________________________________,配制的AgNO3溶液的浓度为____________。 (2)AgNO3标准溶液应使用________(填“酸式”或“碱式”)棕色滴定管盛装,检漏后装液前需要进行的操作有_________________。(3)实验可用铬酸钾(K2CrO4)作指示剂,一方面是由于Ag2CrO4是砖红色沉淀,现象变化明显,另一方面是由于____________________________________________________________________________________________。(4)达到滴定终点时的现象为_______________________________________________________________________________________________。 (5)由上述实验数据测得原溶液中c(Br-)=________ ml·L-1。
500 mL(棕色)容量瓶、胶头滴管
0.1 ml·L-1
AgBr比Ag2CrO4更难溶,在含相同浓
砖红色沉淀,且30 s内不消失
滴入最后半滴标准溶液,锥形瓶中产生了
进阶1 练易错·避陷阱1.(2023·广东汕尾统考)某温度下,0.010 0 ml·L-1 NaOH溶液滴定20.00 mL 0.010 0 ml·L-1盐酸的滴定曲线如图所示。下列说法错误的是( )
A.该温度高于室温B.b点时溶液中c(Cl-)>c(Na+)>c(H+)>c(OH-)C.滴定过程中,水的电离程度先增大后减小D.相同条件下,若使用0.020 ml·L-1 NaOH溶液滴定,反应终点由b点变为a点
解析 当加入20 mL NaOH溶液时溶液呈中性,此时pH=6.5,则c(H+)=c(OH-) =10-6.5 ml·L-1,KW=c(H+)×c(OH-)=10-13,温度升高,水的电离程度增大,所以该温度高于室温,A正确;b点时恰好完全反应,溶液呈中性,此时溶液中c(Cl-) =c(Na+)>c(H+)=c(OH-),B错误;HCl与NaOH均会抑制水的电离,滴定过程中,水的电离程度增大直至反应完全,然后随着NaOH溶液的加入,水的电离程度减小,C正确;相同条件下,若使用0.020 ml·L-1 NaOH溶液滴定,反应终点时消耗NaOH溶液的体积为10 mL,终点的pH不变,所以滴定终点由b点变为a点,D正确。
进阶2 练热点·提素能 3.(2023·广东深圳期中)常温下,向某浓度的H2A(二元弱酸)溶液中逐滴加入某浓度的KOH溶液,所得溶液中H2A、HA-、A2-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )
4.称取0.500 g CuCl成品置于过量FeCl3(aq)中,待固体完全溶解后,用0.200 0 ml·L-1的Ce(SO4)2标准液滴定至终点,消耗Ce(SO4)2标准液24.60 mL。相关反应如下:Fe3++CuCl═Fe2++Cu2++Cl-,Ce4++Fe2+═Fe3++Ce3+。则CuCl的质量分数是________________(保留四位有效数字),若滴定操作耗时过长可能会使测定的CuCl质量分数________________(填“偏大”或“偏小”)。
进阶3 研真题·明考向5.(2023·山东卷)阅读下列材料,完成题目。一定条件下,乙酸酐[(CH3CO)2O]醇解反应[(CH3CO)2O+ROH→ CH3COOR+CH3COOH]可进行完全,利用此反应定量测定有机醇(ROH)中的烃基含量,实验过程中酯的水解可忽略。实验步骤如下:①配制一定浓度的乙酸酐—苯溶液。②量取一定体积乙酸酐—苯溶液置于锥形瓶中,加入m g ROH样品,充分反应后,加适量水使剩余乙酸酐完全水解:(CH3CO)2O+H2O→2CH3COOH。③加指示剂并用c ml·L-1 NaOH—甲醇标准溶液滴定至终点,消耗标准溶液V1 mL。④在相同条件下,量取相同体积的乙酸酐—苯溶液,只加适量水使乙酸酐完全水解;加指示剂并用c ml·L-1 NaOH—甲醇标准溶液滴定至终点,消耗标准溶液V2 mL。
(1)对于上述实验,下列做法正确的是( )A.进行容量瓶检漏时,倒置一次即可B.滴入半滴标准溶液,锥形瓶中溶液变色,即可判定达滴定终点C.滴定读数时,应单手持滴定管上端并保持其自然垂直D.滴定读数时,应双手一上一下持滴定管
解析 本题主要考查酸碱中和滴定的基本操作。容量瓶检漏时,应倒置两次,第二次时将塞子旋转180°再将容量瓶倒置,两次倒置,容量瓶瓶塞周围均无水渗出,表明容量瓶不漏水,A项错误;判断滴定终点时,锥形瓶中溶液变色,且半分钟内不恢复原来的颜色,即可判定到达滴定终点,B项错误;滴定读数时,应将滴定管固定在滴定台上,或者单手持滴定管上端无刻度处,并保持其自然垂直,C项正确,D项错误。
(2)ROH样品中羟基含量(质量分数)计算正确的是( )
(3)根据上述实验原理,下列说法正确的是( )A.可以用乙酸代替乙酸酐进行上述实验B.若因甲醇挥发造成标准溶液浓度发生变化,将导致测定结果偏小C.步骤③滴定时,不慎将锥形瓶内溶液溅出,将导致测定结果偏小D.步骤④中,若加水量不足,将导致测定结果偏大
解析 本题主要考查酯化反应原理、酸碱中和滴定误差的分析。乙酸与醇的酯化反应是可逆反应,因此无法用乙酸定量测定有机醇中的羟基含量,A项错误;甲醇挥发会造成标准溶液浓度增大,进行步骤③时,消耗的标准溶液体积变小,即V1变小,由于在使用过程中甲醇不断挥发,步骤④中的NaOH—甲醇溶液的浓度相对步骤③中溶液浓度更大了,即V2减小的程度更大了,因此V2-V1偏小,导致测定结果偏小,B项正确;若步骤③滴定时锥形瓶内液体溅出,则V1偏小,则导致测定结果偏大,C项错误;若步骤④中加水量不足,在滴定过程中未水解的乙酸酐继续醇解,乙酸酐不能完全转化为乙酸,则V2偏小,导致测定结果偏小,D项错误。
例(2022·江苏选考卷,16节选)实验中需要测定溶液中Ce3+的含量。已知水溶液中Ce4+可用准确浓度的(NH4)2Fe(SO4)2溶液滴定。以苯代邻氨基苯甲酸为指示剂,滴定终点时溶液由紫红色变为亮黄色,滴定反应为Fe2++Ce4+→Fe3++Ce3+。请补充完整实验方案:
①准确量取25.00 mL Ce3+溶液[c(Ce3+)约为0.2 ml·L-1],加氧化剂将Ce3+完全氧化并去除多余氧化剂后,用稀硫酸酸化,将溶液完全转移到250 mL容量瓶中后定容。②按规定操作分别将0.020 00 ml·L-1 (NH4)2Fe(SO4)2和待测Ce4+溶液装入如图所示的滴定管中。③__________________________________
从左侧滴定管中放出一定体积的待测Ce4+溶液,加入指示剂苯代邻氨基苯甲酸,用0.020 00 ml·L-1 (NH4)2Fe(SO4)2溶液来滴定,当滴入最后半滴标准液时,溶液由紫红色变为亮黄色,且半分钟不恢复原色,即达到滴定终点,记录标准液的体积
(1)用a ml·L-1的HCl滴定未知浓度的NaOH溶液,用酚酞作指示剂,达到滴定终点的现象是________________________________________________;若用甲基橙作指示剂,滴定终点现象是___________________________。 (2)用标准碘溶液滴定溶有SO2的水溶液,以测定水中SO2的含量,应选用________作指示剂,达到滴定终点的现象是________________________。
滴入最后半滴标准液,溶液由红色变为无色,且半分钟内不恢复红色
当滴入最后半滴标准液,溶液由黄色变为橙色,且半分钟内不恢复黄色
当滴入最后半滴标准液,溶液由无色变为蓝色,且半分钟内不褪色
2024届高考一轮复习 第八章 水溶液中的离子反应与平衡 第2讲 酸碱中和滴定及拓展应用课件PPT: 这是一份2024届高考一轮复习 第八章 水溶液中的离子反应与平衡 第2讲 酸碱中和滴定及拓展应用课件PPT,共60页。PPT课件主要包含了2滴定,无影响,实验数据如下表等内容,欢迎下载使用。
新高考化学一轮复习精品课件 第9章 第53讲 酸碱中和滴定及拓展应用 (含解析): 这是一份新高考化学一轮复习精品课件 第9章 第53讲 酸碱中和滴定及拓展应用 (含解析),共60页。PPT课件主要包含了必备知识,关键能力,氧化还原滴定,滴定终点判断,规范精炼,真题演练明确考向,课时精练等内容,欢迎下载使用。
2024年高考化学一轮复习课件(鲁科版)第8章 第48讲 酸碱中和滴定及拓展应用: 这是一份2024年高考化学一轮复习课件(鲁科版)第8章 第48讲 酸碱中和滴定及拓展应用,文件包含第8章第48讲酸碱中和滴定及拓展应用pptx、第8章第48练酸碱中和滴定及拓展应用docx、第8章第48讲酸碱中和滴定及拓展应用docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。












