






第39讲 反应热的测定与计算-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材)
展开1.了解中和反应反应热测定的原理及操作。2.掌握盖斯定律的内容及意义,并能进行有关反应热的计算。
考点一 中和反应反应热的测定
考点二 盖斯定律及其应用
考点三 反应热大小的比较
考点一 中和反应反应热的测定
稀溶液中,酸与碱反应生成1ml液态H2O(l)时释放的热量.
⑤若反应过程中有其他物质生成(沉淀、难电离物质等),这部分反应热不属于中和热。{如硫酸与氢氧化钡的反应}
③特别地,强酸、强碱的稀溶液:H+(aq)+OH-(aq)=H2O(l)
①必须是稀溶液,如浓硫酸稀释或NaOH固体溶解时放热;
②以生成1ml H2O(l)为标准
一般地,酸、碱浓度:C(H+)≤ 1ml/L或C(OH—)≤ 1ml/L
△H = -57.3 kJ/ml
④中和热不包括物质溶解、电离、水合等过程的热效应
→已知强酸与强碱的稀溶液发生中和反应的热化学方程式为 H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·ml-1,又知电解质的电离是吸热过程。向1 L 0.5 ml·L-1的NaOH溶液中加入下列物质:①稀醋酸;②浓硫酸;③稀硝酸,恰好完全反应。则其焓变ΔH1、ΔH2、ΔH3的关系是( ) A. ΔH1>ΔH2>ΔH3 B. ΔH1<ΔH3<ΔH2 C. ΔH1=ΔH3>ΔH2 D. ΔH1>ΔH3>ΔH2
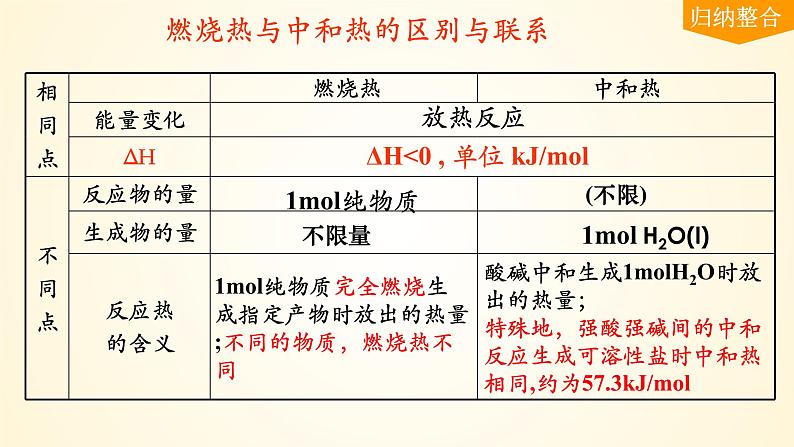
燃烧热与中和热的区别与联系
ΔH<0 , 单位 kJ/ml
1ml纯物质完全燃烧生成指定产物时放出的热量;不同的物质,燃烧热不同
酸碱中和生成1mlH2O时放出的热量;特殊地,强酸强碱间的中和反应生成可溶性盐时中和热相同,约为57.3kJ/ml
n为生成H2O的物质的量。稀溶液的密度用1 g·mL-1进行计算。
二.中和反应反应热的测定
用简易量热计测量盐酸与NaOH溶液反应前后的温度差Δt。
放热 Q = m c Δt
= (m酸+m碱)·c · (t终— t始)
比热容:c=4.18×10-3 kJ·g-1·℃-1
使反应物混合均匀,充分接触(操作:上下移动)
思考:该实验中,玻璃搅拌器换成铁制或者铜制的搅拌器行不行?
另取一量筒,量取50 mL 0.55ml/L氢氧化钠,测温并记录;
量取50 mL 0.50 ml·L-1盐酸,倒入内筒,盖上杯盖,测温并记录;洗净温度计并擦干,备用
③ 取两次温度的平均值记为反应前体系温度t1
将酸碱溶液迅速混合,用玻璃搅拌器轻轻搅动溶液,准确读取混合溶液的最高温度 ,记为t2
(3)重复以上步骤2-3次
问题一:能否更换温度计?
问题二:能否测完酸后直接测量碱的温度?
不能,残留的酸与碱反应,造成酸碱消耗,热量损失
问题三:为什么碱的浓度稍大于酸?
碱过量,保证酸完全反应
→求平均温度差(t终-t始)→计算中和反应反应热ΔH。
假设中和后溶液密度近似为1 g/cm,中和后溶液的比热容c=4.18 J/(g·℃),则根据公式和实验数据可计算出:该反应放出的热量 Q =mcΔt ≈ kJ,
则,生成 1 ml H2O时放出的热量为 kJ。
若有数据偏差太大,应舍弃该数据
无影响。因为强酸强碱的稀溶液反应生成1 ml H2O(l)时放出的热量是相同的,与用KOH溶液还是NaOH 溶液无关。
(2)酸、碱混合时,为何要把量筒中的NaOH溶液一次倒入小烧杯而不能缓缓倒入?
(3)用浓硫酸代替盐酸对结果会产生什么影响? 用醋酸代替盐酸对结果会产生什么影响? 用稀硫酸和稀Ba(OH)2溶液测定,对结果会产生什么影响?
浓硫酸稀释放热,数值偏大
醋酸电离吸热,数值偏小
生成BaSO4沉淀,会多放出部分热量,数值偏大
提高中和反应反应热的测定准确度的措施
①酸、碱溶液选用强酸、强碱的稀溶液;
②为保证盐酸被完全中和,碱的浓度应稍大。
①酸碱溶液混合要迅速,防止热量散失
②在测量反应混合液的温度时,记录最高温度值
①不可将温度计当搅拌器使用;玻璃搅拌器应上下移动。
②应使用玻璃搅拌器,不能用金属质搅拌器代替。
对于定量实验,均需重复实验步骤,取2~3次实验数据的平均值反应热测定实验中,温度数据至少要测量、记录6次(一次实验测3个数据,至少重复2次)选用数据进行计算时,相差太大的数据应舍弃玻璃搅拌器仅在反应热测定这一实验中出现和使用
通过测定反应过程中所放出的热量可计算中和热。回答下列问题:①从实验装置上看,图中尚缺少的一种玻璃用品是 。②如果不盖杯盖,求得的中和热数值 (填“偏大”“偏小” “无影响”)。③实验中改用60 mL 0.50 ml/L盐酸跟50 mL 0.55 ml/L NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”“不相等”),所求中和热 (填“相等”“不相等”),简述理由: 。④用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”“偏小”“无影响”)若所用NaOH溶液因吸收CO2已少量变质,则该NaOH溶液耗酸量 (填“改变”“不变”),对中和热的测定有无影响?
因为中和热是指酸跟碱发生中和反应生成1mlH2O所放出的能量,与酸碱的用量无关
ml/L盐酸与50mL0.55 ml/L NaOH溶液在图示的装置中进行中和反应。
Ⅰ.配制0.50 ml·L-1 NaOH溶液(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体 g。
(2)从上图中选择称量NaOH固体所需要的仪器是(填字母): 。
0.25L× 0.50 ml·L-1 ×40g/ml=5.0g
2.某实验小组用0.50 ml/L NaOH溶液和0.50 ml/L硫酸溶液进行中和热的测定。
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如右图所示。
取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
②近似认为0.50 ml·L-1 NaOH溶液和0.50 ml·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·(g·℃)-1。则中和热ΔH= (取小数点后一位)。
= -53.5KJ/ml
①请填写下表中的空白:
③上述实验数值(53.5KJ/ml)结果与57.3 kJ·ml-1有偏差, 产生偏差的原因可能是(填字母) 。 a.实验装置保温、隔热效果差 b.量取NaOH溶液的体积时仰视读数c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
1.中和反应是放热反应,下列关于中和反应反应热测定的说法错误的是A.等温条件下,试管中进行的中和反应,反应体系向空气中释放的热量 就是反应的热效应B.测定中和反应反应热时,需要快速的将两种溶液混合C.测定中和反应反应热时,最重要的是要保证实验装置的隔热效果D.不同的酸碱反应生成1 ml液态水释放的热量可能不相同
若用的是弱酸或弱碱,其电离需吸收一部分热量,D正确。
快速混合,防止热量散失
2.某化学实验小组用简易量热计(装置如图)测量中和反应的反应热,实验采用50 mL 0.5 ml·L-1盐酸与50 mL 0.55 ml·L-1 NaOH溶液反应。下列说法错误的是A.采用稍过量的NaOH溶液是为了保证盐酸完全被中和B.仪器a的作用是搅拌,减小测量误差C.NaOH溶液应迅速一次性倒入装有盐酸的内筒中D.反应前测完盐酸温度的温度计应立即插入 NaOH溶液中测量温度
反应前测完盐酸温度的温度计应洗净、擦干后再插入NaOH溶液中测量温度,D错误。
考点二 盖 斯 定 律 及 其 应 用
①不管化学反应是一步完成或分几步完成,其反应热是相同。
②化学反应的反应热只与反应体系的 有关,而与 无关。
ΔH1=-(ΔH2+ΔH3)
有些反应进行得很慢;有些反应不容易直接发生;有些反应的产品不纯(有副反应发生)。这些都给测量反应热造成了困难,利用盖斯定律可以间接地把它们的反应热计算出来
注意: ΔH要带正负号进行计算
“正逆”反应的反应热效应数值相等,符号相反
1.依据图示关系,下列说法不正确的是A.ΔH2>0B.1 ml S(g)完全燃烧释放的能量小于2 968 kJC.ΔH2=ΔH1-ΔH3D.16 g S(s)完全燃烧释放的能量为1 484 kJ
ΔH2+ΔH3=ΔH1
2.已知 (g)=== (g)+H2(g) ΔH1=+100.3 kJ·ml-1① H2(g)+I2(g)=2HI(g) ΔH2=-11.0 kJ·ml-1②对于反应: (g)+I2(g)= (g)+2HI(g) ΔH3=______kJ·ml-1。
解析:根据盖斯定律,将反应①+反应②得到目标反应,则ΔH3=ΔH1+ΔH2=[+100.3+(-11.0)]kJ·ml-1=+89.3 kJ·ml-1。
3.火箭的第一、二级发动机中,所用的燃料为偏二甲肼和N2O4 ,偏二甲肼可用肼来制备。用肼(N2H4)作燃料, N2O4作氧化剂,二者反应生成氮气和气态水。已知:①N2(g)+2O2(g)=N2O4(g) ΔH=+10.7 kJ·ml-1②N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-543 kJ·ml-1写出气态肼和N2O4反应的热化学方程式:_______________________。
2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)
ΔH=-1 096.7 kJ·ml-1
3.[2020·全国卷Ⅱ,28(1)①]乙烷在一定条件可发生如下反应:C2H6(g)=C2H4(g)+H2(g) ΔH1,相关物质的燃烧热数据如下表所示:
解析: 先写出三种气体的燃烧热的热化学方程式,然后根据盖斯定律计算
则ΔH1= kJ·ml-1。
①确定待求的反应方程式;②找出待求方程式中各物质出现在已知方程式的什么位置;③根据待求方程式中各物质计量数和位置的需要,对已知方程式进行处理,或调整计量数,或调整反应方向;④实施叠加并检验上述分析的正确与否。
关 键:通过加、减、乘、除“四则运算式”导出目标方程式ΔH
考点三 反 应 热 大 小 的 比 较
1.同一反应,生成物状态不同时
如: 2H2(g)+O2(g) = 2H2O(1) H1 ; 2H2(g)+O2(g) = 2H2O(g) H2
因为气体变液体会放热,故: H1 H2
2. 同一反应 , 反 应 物 状 态 不 同 时
如: S(g)+O2(g) = SO2(g) H1 ; S(s)+O2(g) = SO2(g) H2
故: H1 H2
① ②
物质本身的内能: S(g) S(s)
∴ 放热:反应① 反应②
特别提醒:热量比较比数值△H比较带正负号比较
S(s)+O2(g)
已知铝热反应为 ,故ΔH<0,
如: C(s)+O2(g) = CO2(g) H1 ; C(s)+1/2O2(g) = CO(g) H2
3. 两个相 联系的不同反应比较
可以设计成:C(s) ——CO(g)———CO2(g) ,故: H1 H2
(1) (2)
① ②
4.根据特殊反应的焓变情况比较反应焓变的大小
① 2Al(s)+3/2O2(g)=Al2O3(s) ΔH1② 2Fe(s)+3/2O2(g)=Fe2O3(s) ΔH2
由①-②可得2Al(s)+Fe2O3(s)=2Fe(s)+Al2O3(s) ΔH=ΔH1-ΔH2,
下列有关判断正确的是A.ΔH2>0,ΔH3<0B.ΔH2<ΔH4C.ΔH4<ΔH1+ΔH2D.ΔH1>ΔH3
生成BaSO4沉淀,为放热反应,ΔH2<0
NH3·H2O与强酸发生的中和反应,为放热反应,ΔH3<0
④除了生成沉淀放热,还有中和反应放热,放出的热量大于②,即ΔH4<ΔH2
ΔH4=2ΔH1+ΔH2
已知ΔH1<0, 故ΔH4<ΔH1+ΔH2
NH3·H2O电离需吸收能量,故ΔH3>ΔH1
2.室温下,将1 ml的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将1 ml的CuSO4(s)溶于水会使溶液温度升高,热效应为ΔH2;CuSO4·5H2O受热分解的化学方程式为CuSO4·5H2O(s)=CuSO4(s)+5H2O(l),热效应为ΔH3。下列判断正确的是A.ΔH2>ΔH3 B.ΔH1<ΔH3C.ΔH1+ΔH3=ΔH2 D.ΔH1+ΔH2>ΔH3
胆矾溶于水时是吸热过程
③CuSO4•5H2O(s) = CuSO4(s)+5H2O(l) ΔH3
②CuSO4(s)= Cu2+(aq)+SO42-(aq) ΔH2<0
①CuSO4·5H2O(s)=Cu2+(aq)+SO42-(aq)+5H2O(l) ΔH1>0
ΔH3=ΔH1-ΔH2
CuSO4(s)溶于水是放热过程
A. ΔH1>ΔH2>ΔH3 B. ΔH2>ΔH3>2ΔH1C. ΔH2>2ΔH1>ΔH3 D. ΔH3>ΔH2>ΔH1
对于反应a、b,ΔHa>0、ΔHb>0。
反应a=反应②-反应③,ΔHa=ΔH2-ΔH3>0
反应b=反应③-2×反应①,故ΔHb=ΔH3-2ΔH1>0
1.(2020·北京,12)依据图示关系,下列说法不正确的是A.石墨燃烧是放热反应B.1 ml C(石墨,s)和1 ml CO分别在足量O2中燃烧,全部转化为CO2,前者放热多C.C(石墨,s)+CO2(g)=2CO(g) ΔH=ΔH1-ΔH2D.化学反应的ΔH,只与反应体系的始态和终态有关,与反应途径无关
2.(2022·浙江1月选考,18)相关有机物分别与氢气发生加成反应生成1 ml环己烷( )的能量变化如图所示:下列推理不正确的是A.2ΔH1≈ΔH2,说明碳碳双键加氢放出 的热量与分子内碳碳双键数目成正比B.ΔH2<ΔH3,说明单双键交替的两个碳碳双键间存在相互作用,有利于物质稳定C.3ΔH1<ΔH4,说明苯分子中不存在三个完全独立的碳碳双键D.ΔH3-ΔH1<0,ΔH4-ΔH3>0,说明苯分子具有特殊稳定性
但不能是存在相互作用的两个碳碳双键
钒催化剂参与反应的能量变化如图所示,V2O5(s)与SO2(g)反应生成VOSO4(s)和V2O4(s)的热化学方程式为____________________。
ΔH=-98 kJ·ml-1。
2V2O5(s)+2SO2(g)=2VOSO4(s)+V2O4(s)
①V2O4(s)+2SO3(g)=2VOSO4(s) ΔH1=-399 kJ·ml-1
②V2O4(s)+SO3(g)=V2O5(s)+SO2(g) ΔH2=-24 kJ·ml-1
ΔH=-351kJ·ml-1
4.[2022·广东,19(1)②]Cr2O3催化丙烷脱氢过程中,部分反应历程如图,X(g)→Y(g)过程的焓变为________________________(列式表示)。
(E1-E2)+ΔH+(E3-E4)
第26讲 氨和铵盐-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材): 这是一份第26讲 氨和铵盐-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材),共60页。PPT课件主要包含了考点一氨,专项突破,归纳整合,NH3等内容,欢迎下载使用。
第22讲 硫及其氧化物-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材): 这是一份第22讲 硫及其氧化物-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材),共55页。PPT课件主要包含了氧族元素,易得2e-,专项突破,归纳整合,CS2,氧化性,还原性,漂白性,迁移应用,思考与交流等内容,欢迎下载使用。
第19讲 氯及其化合物-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材): 这是一份第19讲 氯及其化合物-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材),共60页。PPT课件主要包含了专项突破,归纳整合,生活小知识等内容,欢迎下载使用。












