

江苏省扬州市宝应县2024届九年级上学期期末测试化学试卷(含答案)
展开这是一份江苏省扬州市宝应县2024届九年级上学期期末测试化学试卷(含答案),共20页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
一、单选题
1.全国文明城市建设关系淮安长远发展,事关各行各业,惠及全市人民,人人都是主力军,个个都是责任人。淮安市民的下列生活方式中,你认为不可行的是( )
A.乘电动公交车,提倡低碳出行B.淘米水浇花,节约淡水资源
C.实施绿化工程,防治扬尘污染D.回收垃圾,直接露天焚烧处理
2.以下春节传统民间风俗中,主要涉及物理变化的是( )
A.酿米酒B.扫尘埃C.烧年菜D.放爆竹
3.学校采购了一批含75%酒精的免洗消毒喷雾。你建议在存放处张贴的警示标识是( )
A.B.C.D.
4.下列化学用语书写正确的是( )
A.2个氮原子:B.硫酸铝:
C.2个铁离子:D.氧化镁中镁元素的化合价为+2价:
5.下列反应,属于中和反应的是( )
A.B.
C.D.
6.硫酸是一种重要的工业原料,下列说法不正确的是( )
A.浓硫酸可用于干燥
B.浓硫酸可使纸张炭化
C.实验室可用块状石灰石与稀硫酸制备
D.稀硫酸可用于金属表面除锈
7.化学元素与人体健康密切相关。缺少下列元素可能会引起骨质疏松、佝偻病的是( )
A.碘B.钙C.锌D.铁
8.在按一定顺序排列的含硫物质:、X、S、中的X可能是( )
A.B.C.D.
9.下列实验设计正确的是( )
A.用明矾软化硬水B.用溶液除去中的
C.用托盘天平称取6.45g食盐D.用磁铁区分铁粉和四氧化三铁粉末
10.著名画家刘海粟擅长山水画中运用的颜料石绿,其主要成分可能是( )
A.氧化铁B.碳酸钙C.碱式碳酸铜D.高锰酸钾
11.下列实验操作正确的是( )
A.滴加液体B.取用固体
C.测溶液pHD.过滤
12.一些食物的近似pH如下,其中酸性最强的是( )
A.柠檬汁2.2~2.4B.苹果汁2.9~3.3C.番茄汁4.0~4.4D.鸡蛋清7.6~8.0
13.现有下列四组物质:
①乙炔和苯
②乳酸和果糖
③丁烷和乙醚
④甲苯和甘油;当总质量一定时,各组中的两种物质无论按何种质量比混合,完全燃烧生成水的质量均相同.符合该条件的共有( )
A.1组B.2组C.3组D.4组
14.将红色的铜丝置于酒精灯火焰上加热,表面变黑。将变黑的铜丝插入盛有稀硫酸的试管中一段时间。有关说法不正确的是( )
A.铜丝表面变黑,质量增加
B.变黑的钢丝插入稀硫酸,表面恢复红色
C.变黑的铜丝插入稀硫酸,铜丝质量不变
D.变黑的铜丝插入稀硫酸,溶液质量增加
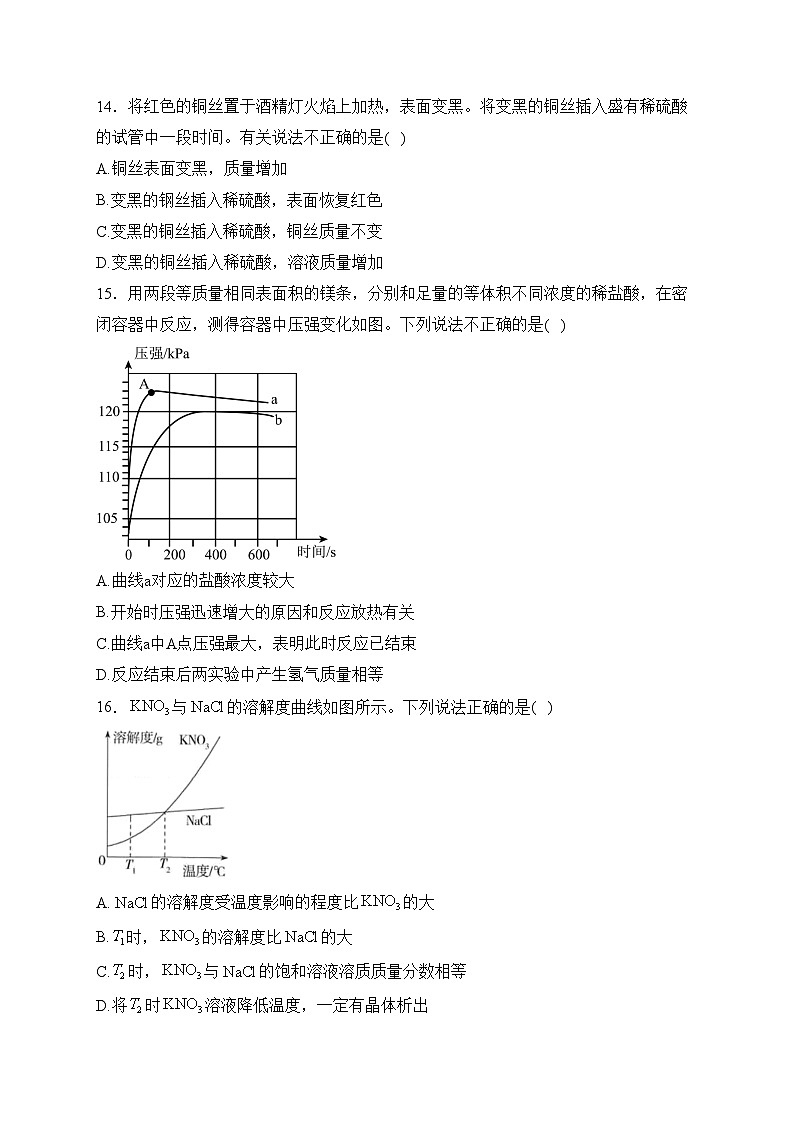
15.用两段等质量相同表面积的镁条,分别和足量的等体积不同浓度的稀盐酸,在密闭容器中反应,测得容器中压强变化如图。下列说法不正确的是( )
A.曲线a对应的盐酸浓度较大
B.开始时压强迅速增大的原因和反应放热有关
C.曲线a中A点压强最大,表明此时反应已结束
D.反应结束后两实验中产生氢气质量相等
16.与的溶解度曲线如图所示。下列说法正确的是( )
A.的溶解度受温度影响的程度比的大
B.时,的溶解度比的大
C.时,与的饱和溶液溶质质量分数相等
D.将时溶液降低温度,一定有晶体析出
17.据报道,科学家开发出一种新型催化剂,能在光照下将二氧化碳转化为甲烷(反应的微观过程如下图所示)。下列有关该反应的说法正确的是( )
A.反应前后氧元素的化合价没有改变
B.反应的二氧化碳和水的质量比为11:9
C.反应前后元素的个数和种类均不变
D.生成的甲烷和氧气的分子个数比为1:1
18.除去下列物质中所含的少量杂质(括号内为杂质),所用试剂和方法正确的是( )
A.溶液:加入过量的锌粉,过滤
B.:导出,点燃
C.粉:加入过量溶液,过滤、洗涤、干燥
D.固体:加入足量的水溶解,过滤、洗涤、干燥
19.在一定条件下,甲、乙、丙、丁四种物质在密闭容器中发生某个反应,测得反应前后各物质的质量如下表:
下列叙述错误的是( )
A.参加反应的甲与丁的质量比为4:1B.x+y=75
C.y≤20时,该反应一定是化合反应D.x的取值范围:
20.科学家预测,到2050年4种途径对全球碳中和的贡献率如图1,在研究膜吸收法吸收时,研究人员通过实验比较了3种吸收剂对烟气中的脱除效果,结果如图2。下列说法错误的是( )
A.到2050年对全球碳中和贡献率最大的途径是碳替代
B.光合作用是自然界中碳循环的重要途径
C.随烟气流速增大,二氧化碳脱除效果增强
D.当烟气流速相同时氨基乙酸钾对烟气中的脱除效果最好
二、填空题
21.“宏观—微观—符号”三重表征是化学独特的表示物质及其变化的方式。前不久,嫦娥5号探测器携带月球样本返回地球。经分析得出月球上含有、N、、、、等元素(对应的原子结构示意图如下)。回答下列问题:
(1)氦原子失去2个电子后形成的粒子称为α粒子,α粒子的化学符号为_______。
(2)氦元素和镁元素的原子最外层电子数相同但化学性质不同,其原因是_______。镁的原子在化学反应中都比较容易_______(填“得到”或“失去”)电子形成稳定结构。
(3)图1中②和⑤对应的元素组成的物质是一种耐高温陶瓷,两种元素的化合价分别为-3价和+4价,则该物质化学式为_______。
(4)由图2可知硒的相对原子质量为_______,n的值为_______。
(5) 、N、、、、等元素的原子最本质的区别是_______。
22.化学与生产、生活、实验密切联系。
(1)高铁已成为中国铁路高质量发展的靓丽名片。结合图所示信息回答问题。
①电网通过石墨电刷给动车供电,体现了石墨具有良好的_______性。
②动车车身表面防锈采用的方法是_______。
③制造铁轨的锰钢是一种铁合金,与纯铁相比,其硬度更_______(填“大”或“小”)。
④高铁的运营离不开高性能的芯片。生产芯片的可用与C在高温条件下反应获得,同时产生。该反应的化学方程式为_______。
⑤乘客喝完矿泉水后的塑料瓶应放入_______(填“可回收”或“不可回收”)垃圾箱中。
(2)铅蓄电池在生产、生活中使用广泛。
①铅蓄电池充电时是将电能转化为_______(填序号)。
a.机械能b.热能c.化学能
②用98%的浓硫酸配制5%的稀硫酸100克,为准确量取浓硫酸的体积,还需查阅的数据是_______。
③铅蓄电池的工作原理可以表示为:_______,请将化学方程式补充完整,据此可知,铅蓄电池在充电时,溶液pH将不断_______(填“增大”、“减小”或“不变”)。
23.实验室制取气体的部分装置如图所示。
(1)装置B中仪器a的名称为_______。
(2)实验室用高锰酸钾制取氧气的化学方程式为_______,用装置F收集氧气,使用氧气时,可用水将装置中的氧气排出,水应从导管_______(选填“b”或“c”)口通入。
(3)实验室制取二氧化碳的化学方程式为_______,用F装置收集气体应从_______(选填“b”或“c”)端通入。
(4)某兴趣小组用如图装置研究氧气的性质,将透明的实验盒中间用隔板分成两部分,在倾倒室放入氧气传感器并连接电脑,将燃着的蜡烛放入燃烧室,倾倒入倾倒室后,过一段时间后提起中间隔板,采集信息形成下列图像。
①实验中“提起中间隔板”操作对应的时间点约在第_______s。
②10~25s时曲线快速上升,说明氧气的性质是_______。
③25~50s时燃烧室的实验现象是_______。
④蜡烛熄灭后集气瓶中含量最多的气体是_______(填化学式)。
24.随着碳中和、能源转型逐渐成为全球共识,氢能产业正在成为世界各主要经济体竞相发展的新兴产业。
(1)下图甲中A、B两种原子和乙中的_______(填字母)原子均属于氢元素。
(2)2023年3月,我国首次实现“固态氢能”发电并网,“绿电”与“绿氢”转化的示意图如图所示。
①将光伏、风力发出的电用于电解水制氢。电解水的化学方程式为_______。
②贮氢:合金是一种潜在的贮氢材料,高温时在氩气保护下,由一定质量比的、单质熔炼获得。该合金在一定条件下完全吸氢生成氢化物和另一种合金,其化学方程式为:
A.熔炼制备合金时,通入氩气的目的是_______。
B.氢化物与水反应生成氢氧化镁沉淀,并释放出氢气,发生反应的化学方程式为_______。
(3)电解水制氢联合碳酸钙分解制备氧化钙,能减少碳排放,助力碳中和。该方法的示意图如图所示。
①反应器1:在750℃时反应效果最佳,反应器1中反应的化学方程式_______。
②反应器2:同温同压下,相同体积的任何气体含有相同的分子数。一定条件下,和发生化合反应生成甲醇,参与反应的和的体积比为1:2,请推测甲醇中各原子的个数比为_______。若56kg完全反应,理论上最多生成甲醇的质量为_______kg。
(4)工业生产中可用硫化氢气体()制备氢气,硫化氢高温分解生成氢气时还生成另一种单质,该单质的一个分子由8个原子构成,该反应的化学方程式为_______。
三、实验题
25.某兴趣小组进行粗盐(杂质只含有泥沙)提纯实验,并利用所得精盐配制100g溶质质量分数为15%的氯化钠溶液。请完成下列问题:
实验一:上图是甲同学进行粗盐提纯实验的操作示意图。
(1)进行操作④时,玻璃棒的作用是_______。
(2)进行操作③时,玻璃棒的作用是_______,当观察到_______时,停止加热。
(3)操作⑤中缺少的仪器会造成的后果是_______。
实验二:乙同学用提纯得到的精盐配制100g溶质质量分数为15%的氯化钠溶液(假设称量氯化钠时1g以下用游码)。
(4)计算。需要称取氯化钠的质量为_______g,需要水的体积为_______mL。
(5)称量氯化钠时如果发现指针偏向右侧,正确的操作是_______。
(6)用量筒量取水,当液面接近指定刻度时,需改用_______(填仪器名称)添加液体。
(7)经检测所配溶液的溶质质量分数偏小,原因可能是_______(填序号)。
①量筒量取水时仰视读数②倾倒水时,有部分水洒出
③转移溶液时,溶液洒出一部分④使用托盘天平时,药品与砝码的位置放反
26.溶液在生产、生活中起着十分重要的作用。某学习小组的同学对溶液的性质进行探究。
【知识回顾】
(1)生理盐水是医疗上常用的一种溶液。一瓶合格的生理盐水密封放置一段时间后,不会出现浑浊现象,原因是_______。
(2)在20℃时,氯化钠的溶解度为36g。这句话的含义是_______。
【提出问题】溶液的某些性质是否可以通过定量实验进行验证?
【查阅资料】电导率传感器用于测量溶液的导电性强弱;一定条件下,电导率的大小能反映离子浓度的大小;蒸馏水几乎不导电,其电导率几乎为0。
【实验探究1】蔗糖溶液、氯化钠溶液电导率的测定。
用电导率传感器分别测定相同浓度的蔗糖溶液、氯化钠溶液中不同位置的电导率。实验数据如图1所示。
(3)蔗糖溶液的电导率几乎为0,因为蔗糖在溶液中以_______(写具体微观粒子的名称)形式存在。
(4)通过实验中_______现象,可以说明氯化钠溶液是均一的。
【实验探究2】氯化钠溶于水形成溶液的过程中电导率的测定。
第一步:读取室温为20℃,取100mL蒸馏水,加入烧杯中,放入磁力搅拌器磁珠;
第二步:校准传感器,组装仪器,设定搅拌档位;
第三步:用电导率传感器采集数据,迅速将6g氯化钠加入烧杯中、实验数据如图2所示。
(5)请说明实验过程中液体的电导率变化的原因_______。
参考答案
1.答案:D
解析:A、乘电动公交车,提倡低碳出行可以减少二氧化碳的排放,缓解温室效应,措施可行;
B、淘米水浇花,节约淡水资源,这有助于保护水资源,措施可行;
C、实施绿化工程,防治扬尘污染可以防止空气污染,措施可行;
D、露天焚烧垃圾会产生大量的烟尘和有害气体而造成空气污染,措施不可行。
故选:D。
2.答案:B
解析:A、酿米酒过程中有酒精生成,属于化学变化,A不符合题意;
B、扫尘埃只是扫掉尘土,属于物理变化,B符合题意;
C、烧年菜过程涉及燃烧,燃烧属于化学变化,C不符合题意;
D、爆竹爆炸属于化学变化,D不符合题意。
故选B
3.答案:D
解析:酒精为易燃液体,应贴易燃物品标志
A.图示为腐蚀品标志,故A错误;
B.图示为节约用水标志,故B错误
C.图示为剧毒品标志,故C错误;
D.图示为易燃品标志,故D正确;
故选:D。
4.答案:B
解析:A.原子的表示方法:用元素符号来表示一个原子,若表示多个原子,则在其元素符号前加上相应的数字,则2个氮原子表示为2N,错误;
B.铝元素常显+3价,硫酸根常显-2价,根据化合价的计算原则,则硫酸铝的化学式为,正确;
C.离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负号在后,带1个电荷时,1省略不写,若表示多个离子,则在该离子符号前面加上相应的数字,则2个铁离子表示为,错误;
D.化合价的表示方法:在该元素的正上方用“+n”或“-n”表示,正负号在前,数字在后,当n为1时,1不能省略,则氧化镁中镁元素的化合价为,错误;
故选B。
5.答案:C
解析:A、中和反应是酸碱之间的反应。该反应是金属单质与酸的反应,不是酸碱之间的反应,不是中和反应,此选项不符合题意;
B、该反应是金属氧化物与酸的反应,不是酸碱之间的反应,不是中和反应,此选项不符合题意;
C、该反应是酸碱之间的反应,是中和反应,此选项符合题意;
D、该反应是非金属氧化物与碱的反应,不是酸碱之间的反应,不是中和反应,此选项不符合题意。
故选C。
6.答案:C
解析:A、浓硫酸有吸水性,常做某些气体的干燥剂,可用于干燥,选项正确;
B、浓硫酸有脱水性,可将某些有机物中的氧、氢元素以原子个数比1:2(水)的形式脱出来,称为“碳化”,故可使纸张炭化,选项正确;
C、实验室不可用块状石灰石与稀硫酸制备,因硫酸和碳酸钙反应生成的硫酸钙微溶于水,附着在石灰石的表面,会使反应逐渐停止,选项错误;
D、稀硫酸可用于金属表面除锈,因铁锈的主要成分是氧化铁,能和硫酸反应生成硫酸铁和水,选项正确。
故选C。
7.答案:B
解析:A、缺少碘元素会引起甲状腺肿大。
B、幼儿及青少年缺钙会患佝偻病和发育不良,老年人缺钙会引起骨质疏松,容易骨折。
C、缺锌会引起食欲不振、生长迟缓,发育不良。
D、缺铁会引起贫血。
综上所述:选择B。
8.答案:A
解析:中,钠元素化合价为+1价,氧元素化合价为-2价,设硫元素化合价为x,根据化合物中各元素化合价代数和为零,则(+1)×2+x+(-2)×4=0,解得x=+6,S中硫元素化合价为0,中,设硫元素化合价为y,则(+1)×2+y=0,解得y=-2,则X中硫元素化合价为0~+4之间,则:
A、中,氢元素化合价为+1,设硫元素化合价为z,则(+1)×2+z+(-2)×3=0,解得z=+4,符合题意;
B、中,硫酸根中硫元素化合价为+6,不符合题意;
C、中硫元素化合价为-2价,不符合题意;
D、中,设硫元素化合价为a,则a+(-2)×3=0,解得a=+6,不符合题意。
故选A。
9.答案:B
解析:A、明矾是一种常见的絮凝剂,可以吸附水中的悬浮物,但不能吸附硬水中的可溶性钙、镁离子,故不能软化硬水,错误;
B、溶液可以和反应,不与一氧化碳反应,用溶液除去中的,正确;
C、托盘天平只能精确到0.1g,错误;
D、铁粉和四氧化三铁粉末都能被磁铁吸引,不能用磁铁区分二者,错误;
故选B。
10.答案:C
解析:石绿是混合物,石青的主要成分为碱式碳酸铜;故选C。
11.答案:C
解析:A、使用胶头滴管滴加少量液体的操作,注意胶头滴管不能伸入到试管内或接触试管内壁,应垂直悬空在试管口上方滴加液体,防止污染胶头滴管,图中所示操作错误;
B、取用固体药品时,瓶塞应倒放,图中瓶塞正放,所示操作错误;
C、用pH试纸测定未知溶液的pH时,正确的操作方法为用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH,图中所示操作正确;
D、过滤液体时,要注意“一贴、二低、三靠”的原则,图中缺少玻璃棒引流、漏斗下端没有紧靠在烧杯内壁上,图中所示操作错误.
故选C.
12.答案:A
解析:pH<7的溶液显酸性,且pH的数值越小,酸性越强,故选A。
13.答案:C
解析:①乙炔和苯中,由于二者碳原子和氢原子两种原子个数比相同,都为1:1,故二者所含氢元素质量分数相同;故正确;
②乳酸和果糖由于二者碳原子和氢原子和氧原子三种原子个数比相同,都为1:2:1,故二者所含氢元素质量分数相同;故正确;
③由于每个丁烷和乙醚分子中氢原子的个数相等,但二者相对分子质量不同(每一个乙醚分子比一个丁烷分子多一个氧原子),即氢元素的质量分数不同;故错误;
④每个甲苯和甘油分子中都含有8个氢原子,由于二者相对分子质量相同[甲苯的相对分子质量=12×7+8=92;甘油的相对分子质量=12×3+8+16×3=92].即所含氢元素质量分数相同;故正确;故答案为C。
14.答案:C
解析:A、铜和氧气反应生成黑色的氧化铜,质量增加,正确;
B、氧化铜和硫酸反应生成硫酸铜和水,表面恢复红色,正确;
C、氧化铜和硫酸反应生成硫酸铜和水,有一部分铜进入溶液,铜丝质量减少,不正确;
D、氧化铜和硫酸反应生成硫酸铜和水,变黑的铜丝插入稀硫酸,溶液质量增加,正确。
故选C。
15.答案:B
解析:A、相同的镁条加进体积相同而浓度不同的稀盐酸中,曲线a产生的气体压强升高较快,则曲线a对应的盐酸浓度更大,正确;
B、开始时压强迅速增大的原因和反应放热以及生成气体有关,错误;
C、曲线a中A点压强最大,表明此时氢气已经完全产生,反应已结束,正确;
D、相同质量的镁条与足量的盐酸反应,产生的氢气质量相等,正确。
故选B。
16.答案:C
解析:A、由溶解度曲线可知,硝酸钾、氯化钠溶解度随温度升高而增大,的溶解度受温度影响的程度比的小,故选项说法不正确;
B、时,的溶解度比的小,故选项说法不正确;
C、时,硝酸钾和氯化钠的溶解度曲线交于一点,即℃时,硝酸钾和氯化钠的溶解度相等,则℃时,与的饱和溶液溶质质量分数相等,故选项说法正确;
D、时,溶液的状态不能确定,所以降低温度,不一定有晶体析出,故选项说法不正确;
故选:C。
17.答案:B
解析:A、反应前氧元素化合价为-2价,反应后生成的氧气中氧元素的化合价为0价,化合价发生改变,故A错误;
B、在光照和催化剂条件下,二氧化碳和水生成甲烷和氧气,方程式为 ,反应中二氧化碳和水的质量比为44:36=11:9,故B正确;
C、元素只论种类不论个数,故C错误;
D、由质量守恒定律可知,反应后生成的甲烷和氧气的分子个数比为1:2,故D错误;
故选B。
18.答案:C
解析:A、锌排在铁和铜的前面,加入锌后会与氯化亚铁以及氯化铜都发生反应,原物质被反应,除杂错误;
B、二氧化碳不燃烧也不支持燃烧,因此一氧化碳根本无法燃烧,选项错误;
C、铁排在铜前会和硫酸铜反应生成硫酸亚铁和铜,过量的硫酸铜会使铁完全反应,最终过滤、洗涤、干燥得到铜,选项正确;
D、二氧化锰难溶于水,氯化钾能溶于水,因此应该采用加水溶解,过滤,蒸发结晶的方法提纯氯化钾,选项错误;
故选:C。
19.答案:D
解析:A、从表中可知,甲20g全部参加了反应,而丁反应前后减少了5g,说明参加反应的丁质量为5g,因此参加反应的甲与丁的质量比为:20g:5g=4:1,选项A正确;
B、根据质量守恒定律,反应前后物质的总质量不变,所以20+30+20+15=0+x+y+10,x+y=75,选项B正确;
C、从表中可知,甲20g全部参加了反应,而丁反应前后减少了5g,说明甲和丁是反应物,当y=20g时,丙既不是反应物,也不是生成物,甲和丁是反应物,乙必然是生成物,反应物是两种,生成物是一种,是化合反应;当y<20g时,丙也是反应物,此时反应物是三种,生成物是一种,是化合反应,因此时,该反应一定是化合反应,选项C正确;
D、当时,乙是反应物,丙是生成物;当x=30g时,乙既不是反应物也不是生成物,丙是生成物;但当丙是反应物时,乙必然就是生成物,,因此x的取值范围是:,选项D错误。
故选D。
20.答案:C
解析:A、根据图1,到2050年对全球碳中和贡献率最大的途径是碳替代,该选项说法正确;
B、光合作用吸收空气中的二氧化碳,释放氧气,这就在一定程度上保证了生物圈中的碳氧平衡,该选项说法正确;
C、由图2可知,随烟气流速增大,二氧化碳脱除效果减弱,该选项说法不正确;
D、由图2可知,当烟气流速相同时氨基乙酸甲对烟气中的脱除效果最好,该选项说法正确。
故选C。
21.答案:(1)
(2)核外电子层数不同;失去
(3)
(4)78.96;6
(5)质子数不同或核电荷数不同
解析:(1)氦为2号元素,则氦原子的质子数和核外电子数均为2,失去2个电子会形成带2个单位正电荷的氦离子,则符号为。
(2)虽然氦元素和镁元素的原子的最外层电子数相同,但氦原子核外只有一个电子层,属于稳定结构,镁原子核外有多个电子层,最外层电子不属于稳定结构,则它们的化学性质不同;
镁原子最外层电子数为2,小于4,在化学变化中易失去电子形成稳定结构。
(3)7、14号元素分别为氮、硅元素,在化合物中,氮、硅的化合价分别为-3价和+4价,则组成的化合物的化学式为。
(4)元素周期表单元格中,最下方的数字表示相对原子质量,则硒的相对原子质量为78.96;
原子的质子数=原子序数=原子的核外电子数,则m=34,n=34-2-8-18=6。
(5)决定元素种类的为质子数或核电荷数,则这些元素的原子最本质的区别为质子数或核电荷数不同。
22.答案:(1)导电;喷漆或刷漆或涂漆;大;;可回收
(2)c;98%的浓硫酸的密度;;减小
解析:(1)①石墨作电刷通过电网给动车供电,说明它有良好的导电性;
②动车车身表面防锈采用的方法是喷漆(刷漆、涂漆),以达到隔绝水和氧气的功能;
③锰钢是一种铁合金,合金的硬度大于其组分金属,所以锰钢硬度大于纯铁;
④二氧化硅和碳在高温条件下反应生成硅和一氧化碳,反应的化学方程式为:;
⑤ 塑料瓶属于可回收垃圾,应放入可回收垃圾箱中。
(2)①铅蓄电池充电时是将电能转化为化学能,故填:c;
②用98%的浓硫酸配制5%的稀硫酸100克,为准确量取浓硫酸的体积,还需查阅的数据是98%的浓硫酸的密度,是因为根据提供数据可以计算浓硫酸的质量,再根据密度可以计算浓硫酸的体积;
③由质量守恒定律可知,反应前后铅原子都是2个,反应前硫原子是2个,反应后应该是2个,包含在未知物质中,反应前氧原子是10个,反应后应该是10个,其中8个包含在未知物质中,反应前铅原子是4个,反应后应该是4个,包含在未知物质中,未知物质是;据此可知,铅蓄电池在充电时,不断生成硫酸,溶液酸性增强,因此溶液pH将不断减小。
23.答案:(1)长颈漏斗
(2);c
(3);c
(4)25;氧气密度大于空气;蜡烛剧烈燃烧,发出白光;
解析:(1)由图可知装置B中仪器a为长颈漏斗;
(2)高锰酸钾加热生成锰酸钾、二氧化锰和氧气,故化学方程式为:;
水的密度比氧气大,若用水将瓶中氧气排出,水应从c端进入;
(3)实验室用大理石和稀盐酸反应制取二氧化碳,反应原理是碳酸钙与盐酸反应生成氯化钙水和二氧化碳,故方程式为:;
二氧化碳密度比空气大,应长进短出,故气体从c进入;
(4)①实验中“提起中间隔板”后氧气进入原隔板左侧,氧气浓度降低,故操作对应的时间点约在第25s;
②10~25s 时曲线快速上升,说明氧气的密度大于空气,聚集在装置底部,故填:密度大于空气;
③氧气具有助燃性,故25~50s 时燃烧室的实验现象是蜡烛剧烈燃烧,发出白光;
④空气中含量最多的气体是氮气约占空气体积的78%,蜡烛熄灭后集气瓶中含量最多的气体仍是氮气,化学式为。
24.答案:(1)C
(2);防止金属被氧化;
(3);1:4:1;64
(4)
解析:(1)元素的种类由质子数决定,氢元素的质子数为1,因此根据图示可知,图甲中A、B两种原子和图乙中的C原子,质子数均为1,均属于氢元素;
(2)①水铁粉分解生成氢气和氧气,化学方程式为:;
②A、氩气的化学性质稳定,熔炼制备合金时,通入氩气可以起到保护作用,防止金属被氧化;
B、氢化物与水反应生成氢氧化镁沉淀,并释放出,其化学反应方程式为:;
(3)①反应器1中,在750℃时反应效果最佳,即碳酸钙与氢气在750℃下反应生成一氧化碳、氧化钙和水,反应的化学方程式为:;
②同温同压下,相同体积的任何气体含有相同的分子数,一定条件下,和发生化合反应生成甲醇,参与反应的和的体积比为1:2,即一氧化碳分子和氢分子按照1:2的比例反应生成甲醇,根据质量守恒定律,化学反应前后原子种类和数目不变,则甲醇分子中各原子(按C、H、O顺序排列)的个数比为1:4:1;则甲醇的化学式为;
若56kg完全反应,根据碳元素质量守恒,则理论上最多生成甲醇的质量为;
(4)硫化氢高温分解生成氢气时还生成另一种单质,根据质量守恒定律,反应前后元素种类不变,则该单质是由硫元素组成的,该单质的一个分子由8个原子构成,即为S8,则该反应的化学方程式为:。
25.答案:(1)搅拌,加快溶解速率
(2)搅拌,防止因局部温度过高造成液滴飞溅;较多固体出现时
(3)液体洒出
(4)15;85
(5)继续添加氯化钠
(6)胶头滴管
(7)①
解析:(1)操作④为溶解,溶解时,玻璃棒不断搅拌,加快溶解速率
(2)操作③为蒸发,蒸发时,玻璃棒不断搅拌,防止因局部温度过高造成液滴飞溅;当观察到蒸发皿中大部分固体析出时,停止加热,利用余热将其蒸干;
(3)操作⑤为过滤,缺少玻璃棒引流,可能会导致液体洒出
(4)氯化钠的质量为:100g×15%=15g;水的质量为85g,体积为85ml;
(5)称量氯化钠时如果发现指针偏向右侧,说明药品的质量偏小,应继续添加氯化钠至天平平衡;
(6)量取水时需要量筒和胶头滴管,当液面接近指定刻度时,需改用胶头滴管;
(7)①量筒量取水时仰视读数,读取数值小于实际数值,会导致量取水的体积偏大,溶液质量偏大,溶质质量分数偏小,正确;②倾倒水时,有部分水洒出,会导致溶剂质量偏小,溶液质量偏小,溶质质量分数偏大,错误;③转移溶液时,溶液洒出一部分,溶液具有均一性,不影响溶质质量分数的大小,错误;④所需氯化钠的质量为:100g×15%=15g,使用托盘天平时,药品与砝码的位置放反,但是没有使用游码,不影响溶质质量分数大小,错误;故选①。
26.答案:(1)溶液具有均一性
(2)在20℃时,在100g水中最多可溶解氯化钠的质量为36g
(3)蔗糖分子
(4)氯化钠溶液不同位置的电导率相同
(5)蒸馏水几乎不导电,当氯化钠溶解后,随着溶液中离子浓度的增加,电导率增大,当氯化钠完全溶解后,电导率不变
解析:(1)溶液具有均一性,则外界条件不变,放置一段时间后,不会出现浑浊现象。
(2)在20℃时,氯化钠的溶解度为36g,是指在20℃时,在100g水中最多可溶解氯化钠的质量为36g。
(3)蔗糖在溶液中主要以蔗糖分子形式存在。
(4)氯化钠溶液不同位置的电导率相同,而电导率的大小能反映离子浓度的大小,则说明氯化钠溶液是均一的。
(5)刚开始时电导率几乎为零,说明蒸馏水几乎不导电,当氯化钠溶解后,随着溶液中离子浓度的增加,电导率增大,当氯化钠完全溶解后,电导率不变。
物质
甲
乙
丙
丁
反应前质量/g
20
30
20
15
反应后质量/g
0
x
y
10
相关试卷
这是一份江苏省扬州市宝应县2023-2024学年九年级上学期期末模拟化学试题,共7页。试卷主要包含了 下列属于氧化物的是, 下列关于溶液的说法正确的是, 微量元素对人体健康有重要作用, 下列表示两个氢原子是, 下列做法符合安全要求的是等内容,欢迎下载使用。
这是一份江苏省扬州市宝应县2023-2024学年九年级上学期期中测试化学试题,共6页。
这是一份江苏省扬州市宝应县2023-2024学年九年级上学期11月期中化学试题,共8页。












