

湖南省岳阳市华容县2023-2024学年高二上学期期末监测化学试题(含答案)
展开满分:100分 时间:75分钟
可能用到的原子量:H-1 C-12 N-14 O-16 Cl-35.5 Be-9 Na-23 Fe-56
一、单项选择题(本题共14小题,每小题3分,共42分)
1.华容县有很多风味独特的美食,其中火锅类菜品以酸辣香鲜出名。火锅底料的配料有食盐、白糖、陈醋、味精、辣椒、黄酒、生姜、油脂等。下列配料属于弱电解质的是( )
A.C2H5OHB.CH3COOHC.NaClD.白糖
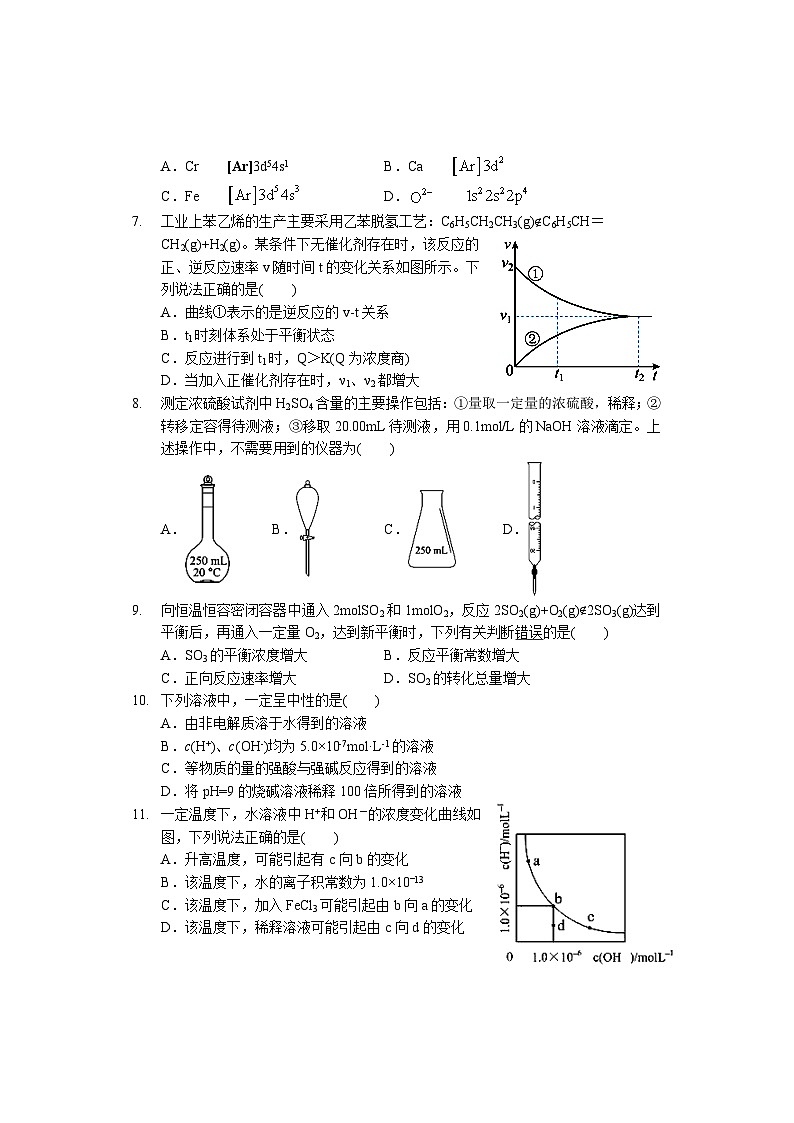
2.下列物质的水溶液不能使酚酞变红的是( )
A.NaOHB.Na2CO3C.KNO3D.NH3
3.已知AgCl的沉淀溶解平衡为AgClsAg+(aq)+Cl-(aq),下列说法中错误的是( )
A.加入水后溶解平衡不移动
B.AgCl饱和溶液中c(Ag+)=Kspml/L
C.用NaCl溶液代替蒸馏水洗涤AgCl沉淀,可以减少沉淀损失
D.反应AgCl+NaBr=AgBr+NaCl易进行,说明溶解度:AgCl>AgBr
4.下列实验能达到目的的是( )
A.装置甲证明醋酸为弱酸
B.装置乙处理Cl2尾气
C.装置丙除去乙醇中少量的水
D.装置丁准确量取一定体积的酸性KMnO4标准溶液
5.反应N2(g)+O2(g)=2NO(g)的能量变化如图所示。已知:断开1mlN2(g)中化学键需吸收946kJ能量,断开1mlO2(g)中化学键需吸收498kJ能量。下列说法正确的是( )
A.N2(g)+O2(g)=2NO(g) △H=-180kJ/ml
B.NO(g)=1/2N2(g)+1/2O2(g) △H=+90kJ/ml
C.断开1mlNO(g)中化学键需要吸收632kJ能量
D.形成1mlNO(g)中化学键可释放90kJ能量
6.下列各基态原子或离子的电子排布式正确的是( )
A.Cr [Ar]3d54s1B.Ca
C.Fe D.
7.工业上苯乙烯的生产主要采用乙苯脱氢工艺:C6H5CH2CH3(g)C6H5CH=CH2(g)+H2(g)。某条件下无催化剂存在时,该反应的正、逆反应速率v随时间t的变化关系如图所示。下列说法正确的是( )
A.曲线①表示的是逆反应的v-t关系
B.t1时刻体系处于平衡状态
C.反应进行到t1时,Q>K(Q为浓度商)
D.当加入正催化剂存在时,ν1、ν2都增大
8.测定浓硫酸试剂中H2SO4含量的主要操作包括:①量取一定量的浓硫酸,稀释;②转移定容得待测液;③移取20.00mL待测液,用0.1ml/L的NaOH溶液滴定。上述操作中,不需要用到的仪器为( )
A.B.C.D.
9.向恒温恒容密闭容器中通入2mlSO2和1mlO2,反应2SO2(g)+O2(g)2SO3(g)达到平衡后,再通入一定量O2,达到新平衡时,下列有关判断错误的是( )
A.SO3的平衡浓度增大B.反应平衡常数增大
C.正向反应速率增大D.SO2的转化总量增大
10.下列溶液中,一定呈中性的是( )
A.由非电解质溶于水得到的溶液
B.c(H+)、c(OH-)均为5.0×10-7ml·L-1的溶液
C.等物质的量的强酸与强碱反应得到的溶液
D.将pH=9的烧碱溶液稀释100倍所得到的溶液
11.一定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是( )
A.升高温度,可能引起有c向b的变化
B.该温度下,水的离子积常数为1.0×10‾13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
12.设NA为阿伏加德罗常数值。关于常温下pH=2的H3PO4溶液,下列说法正确的是( )
A.每升溶液中的H+数目为0.02NA
B.c(H+)=c()+2c()+3c()+c(OH−)
C.加水稀释使电离度增大,溶液pH减小
D.加入NaH2PO4固体,溶液酸性增强
13.短周期元素X、Y、Z、W的原子序数依次增大。W原子的最外层电子数是X与Z原子最外层电子数之和,W简单氢化物r溶于水完全电离。m、p是由这些元素组成的二元化合物,m可做制冷剂,无色气体p遇空气变为红棕色。下列说法正确的是 ( )
A.简单离子半径:W>Z>Y>X
B.Y原子的价电子轨道表示式为
C.r与m可形成离子化合物,其阳离子电子式为
D.一定条件下,m能与Z的单质反应生成p
14.将图1所示装置中的盐桥(琼脂—饱和溶液)换成铜导线与石墨棒连接得到图2所示装置,发现电流计指针仍然有偏转。下列说法正确的是( )
A.图1中,铁棒质量减少,则乙池溶液的质量减少
B.图2丙池中石墨c电极附近减小
C.图1中的石墨电极与图2中丁池石墨b电极的电极反应式相同
D.图2中电流方向为石墨c→铜丝→石墨b→石墨a→电流计
二、非选择题(本4个大题,每空2分,共58分)
15.(1)化学中,酸的电离平衡常数(Ka)是评估酸性强弱的重要依据。几种酸的电离常数(25℃)如下表所示。
①写出HF的电离方程式:________________________________。
②常温下,浓度相同的三种溶液①NaF、②Na2CO3、③CH3COONa,pH由大到小的顺序是_______________________________。
③将过量H2S通入Na2CO3溶液,反应的离子方程式是____________________。
(2)室温下,用0.100 ml/L盐酸溶液滴定20.00mL 0.100 ml/L的氨水溶液,滴定曲线如图所示(忽略溶液体积的变化,①②填“>”、“<”或“=”)。
①a点所示的溶液中c(NH3·H2O)_________c(C1-)。
②b点所示的溶液中c(C1-)_______c()。
③室温下pH=11的氨水与pH=5的NH4Cl溶液中,由水电离出的c(H+)之比为_________。
16.铍的氧化物广泛应用于原子能、航天、电子、陶瓷等领域,是重要的战略物资。利用绿柱石(主要化学成分为(Be3Al2Si6O18,还含有一定量的FeO和Fe2O3)生产BeO的一种工艺流程如下。
回答问题:
(1)Be3Al2Si6O18中Be的化合价为_______。Si原子价层电子排布式为___________。
元素Al与Si中,第一电离能较大的是______________,氮原子和氧原子电负性较大的是______________。
(2)浓硫酸浸取后残渣主要成分是_______(填化学式)。
(3)该流程中能循环使用的物质是_______(填化学式)。
(4)无水BeCl2可用作聚合反应的催化剂。BeO、Cl2与足量C在600~800℃制备BeCl2的化学方程式为________________________________________。
(5)沉铍时,将pH从8.0提高到9.0,则铍的损失降低至原来的_______%。
17.含硫化合物是实验室和工业上的常用化学品。
请回答:
(1)实验室可用铜与浓硫酸反应制备少量SO2:
Cu(s)+2H2SO4(l)=CuSO4(s)+SO2(g)+2H2O(l)ΔH=-11.9kJ·ml-1。
判断该反应的自发性并说明理由______________________________________。
(2)已知2SO2(g)+O22SO3(g)ΔH=-198kJ·ml-1。850K时,在恒容密闭反应器中充入一定量的SO2和O2,10分钟反应达到平衡后测得SO2、O2和SO3的浓度分别为6.0×10-3ml·L-1、8.0×10-3ml·L-1和4.4×10-2ml·L-1。
①反应开始到第10分钟,SO3反应速率为_______。
②该温度下反应的平衡常数为_______。
③平衡时SO2的转化率为_______。
(3)工业上主要采用接触法用含硫矿石制备硫酸。其主要工艺是焙烧、炉气精制、用钒做催化剂将SO2氧化成SO3、吸收等。结合本大题的信息,完成下题。
①下列说法正确的是_______。
a.须采用高温高压的反应条件使SO2氧化为SO3
b.通入过量的空气可以提高含硫矿石和SO2的转化率
c.进入接触室之前的气流无需净化处理
②在焙烧前要将硫铁矿粉碎,这样做的目的是_____________________________。
(4)将FeSO4置入抽空的刚性容器中,升高温度发生分解反应:
2FeSO4(s)Fe2O3(s)+SO2(g)+SO3(g)(Ⅰ)。平衡时P(SO3)-T的关系如下图所示。660K时,该反应的平衡总压P(总)_______kPa。Kp(I)随反应温度升高而_______(填“增大”“减小”或“不变”)。
18.氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
完成下列填空:
(1)写出电解饱和食盐水的离子方程式。______________。
(2)离子交换膜的作用除了能得到纯度更高的氢氧化钠溶液外,还可以__________。
(3)精制饱和食盐水从图中________位置补充,氢氧化钠溶液从图中______________位置流出。(选填“a”、“b”、“c”或“d”)
(4)氢气是很有前景的新能源,氢氧燃料电池的能量转化率高。下图是氢氧燃料碱性电池装置图,电解质溶液为氢氧化钾溶液,写出负极的电极反应式_____________。
(5)氯碱工业制得的化工产品KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。
写出该反应的化学方程式____________________________。
(6)ClO2是高效的消毒杀菌剂,消毒反应原理是高价氯还原为-1价的氯离子。现有1mlClO2,其杀菌能力相当于______________ L标况下Cl2 的杀菌能力(杀菌能力仅按得电子的物质的量计)。
华容县2023-2024学年度第一学期期末监测
高二化学参考答案及评分标准
一、选择题(每小题3分,共42分)
15.BCAAC6-10.ADBBB11-14.CBDD
二、非选择题(4个大题,每空2分,共58分)
15、(12分)
(1) ①HFF-+H+
② ②>③>①
③H2S+=HCO eq \(,3)+HS-
(2)①< ②= ③1:106
16、(16分)
(1)+2 3s23p2 Si O
(2)SiO2
(3)(NH4)2SO4
(4)BeO+Cl2+C=CO+BeCl2
(5)1
17、(16分)
(1)不同温度下都能自发,是因为ΔH<0,ΔS> 或 能自发,因为ΔG=ΔH-TΔS<0
(2)①4.4×103ml/(L·min) ②6.7×103ml·L1 ③88%
(3)①b ②增大表面接触面积,提高反应物的转化率
(4)3 增大
18、(14分)
(1)2H2O +2Cl- eq \(\s\up 2(电解),=)Cl2↑+2OH- + H2↑
(2)避免Cl2与H2反应发生爆炸(合理即给分)
(3)a; d
(4)H2 + 2OH- 2e- = 2 H2O
(5)2KClO3+ 2H2SO4+ H2C2O4= 2ClO2↑+2CO2↑+2KHSO4+2H2O
(6)56弱酸
HF
CH3COOH
H2CO3
H2S
电离平衡常数
Ka=7.2×10-4
Ka=1.75×10-5
Ka1=4.30×10-7
Ka2=5.61×10-11
Ka1=9.1×10-8 Ka2=1.1×10-12
湖南省岳阳市六校联考2023-2024学年高二上学期期末化学试题(Word版附解析): 这是一份湖南省岳阳市六校联考2023-2024学年高二上学期期末化学试题(Word版附解析),文件包含湖南省岳阳市六校联考2023-2024学年高二上学期期末考试化学试题原卷版docx、湖南省岳阳市六校联考2023-2024学年高二上学期期末考试化学试题Word版含解析docx等2份试卷配套教学资源,其中试卷共23页, 欢迎下载使用。
湖南省岳阳市六校联考2023-2024学年高二上学期期末教学质量监测化学试题(PDF版含答案): 这是一份湖南省岳阳市六校联考2023-2024学年高二上学期期末教学质量监测化学试题(PDF版含答案),文件包含高二化学试卷pdf、高二化学参考答案docx等2份试卷配套教学资源,其中试卷共7页, 欢迎下载使用。
湖南省岳阳市2023-2024学年高一上学期1月期末质量监测化学试题(PDF版附答案): 这是一份湖南省岳阳市2023-2024学年高一上学期1月期末质量监测化学试题(PDF版附答案),共9页。












