

辽宁省部分高中2023-2024学年高三上学期期中考试化学试题含答案
展开本试卷满分100分,考试用时75分钟。
注意事项:
1.答题前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
4.本试卷主要考试内容:H1 C12 N14 O16 Na23 Mg24 Al27 S32 Cl35.5 Fe56 Cu64 Ce140
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.明·宋应星《天工开物》中记载:“凡海滨石山傍水处,咸浪积压,生出蛎房,闽中曰蚝房。……凡燔蛎灰者,执椎与凿,濡足取来,……叠煤架火燔成,与前石灰共法。粘砌城墙、桥梁,调和桐油造舟,功皆相同。”下列有关描述中正确的是( )
A.“蛎房”的主要成分是氧化钙
B.古人用“蚝房”煅烧制成的石灰可用作建筑材料
C.“桐油”是一种优良的植物油,从物质分类角度来看属于纯净物
D.“蚝房”受热分解的反应属于放热的非氧化还原反应
2.下列有关化学用语正确的是( )
A.聚丙烯的结构简式:
B.核外有a个电子、b个中子,M的原子符号:
C.的电子式:
D.乙酸的结构式:
3.工业上制备下列物质的生产流程合理的是( )
A.工业制硫酸:
B.由NaCl制漂白粉:饱和食盐水漂白粉
C.从海水中提取镁:海水
D.工业合成硝酸:
4.下列实验方案能达到实验目的(或所得结论正确)的是( )
A.用玻璃棒䓣取NaClO溶液点在pH试纸上测NaClO溶液的pH
B.用湿润的淀粉-KI试纸区分溴蒸气与二氧化氮气体
C.向溶液中通入,验证非金属性:
D.向某溶液中滴入NaOH溶液并加热,产生使湿润红色石苝试纸变蓝的气体,则该溶液一定是铵盐溶液
5.氯元素的化合价与部分物质类别的对应关系如图所示,据图判断下列说法错误的是( )
A.c在光照条件下很容易分解
B.b不是酸性氧化物,因为它没有对应的含氧酸
C.图中a、b、c、d、e五种物质中均含有共价键,且c、d、e属于电解质
D.将a通入NaOH溶液中,已知生成NaCl、NaClO和d的混合物,若与之比为,则氧化剂与还原剂的物质的量之比为
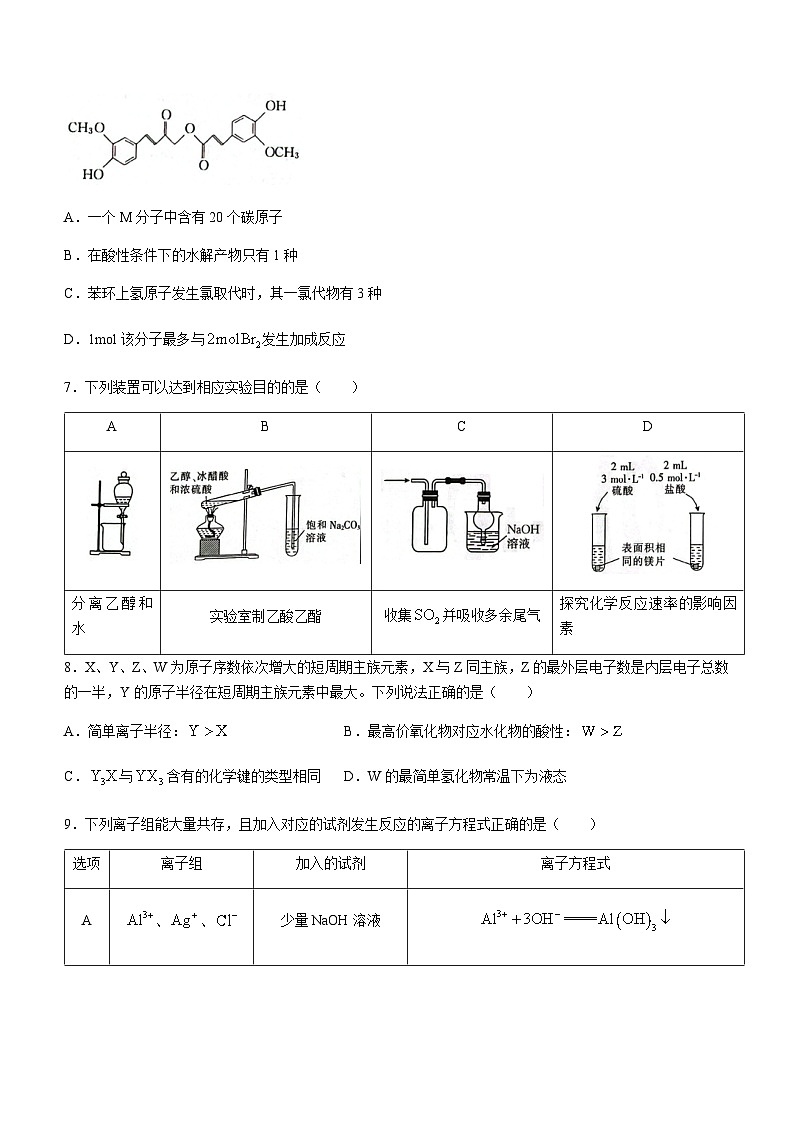
6.从中草药中提取的M的结构简式如图。关于M的说法正确的是( )
A.一个M分子中含有20个碳原子
B.在酸性条件下的水解产物只有1种
C.苯环上氢原子发生氯取代时,其一氯代物有3种
D.1ml该分子最多与发生加成反应
7.下列装置可以达到相应实验目的的是( )
8.X、Y、Z、W为原子序数依次增大的短周期主族元素,X与Z同主族,Z的最外层电子数是内层电子总数的一半,Y的原子半径在短周期主族元素中最大。下列说法正确的是( )
A.简单离子半径:B.最高价氧化物对应水化物的酸性:
C.与含有的化学键的类型相同D.W的最简单氢化物常温下为液态
9.下列离子组能大量共存,且加入对应的试剂发生反应的离子方程式正确的是( )
10.以、炭粉、氯化钙等为原料,采用下列流程可制备粉状(一种压电材料)。
已知:①“焙烧”后固体产物有、易溶于水的BaS和微溶于水的CaS;
②“沉淀”步骤中加入的试剂适量,反应生成。
下列叙述错误的是( )
A.“焙烧”时炭粉作还原剂,氧化剂与氧化产物的物质的量之比为
B.“滤渣1”的主要成分是CaS和炭粉
C.“沉淀”反应的化学方程式为
D.流程中涉及了过滤操作,实验室中完成该操作所需的玻璃仪器有漏斗、烧杯和玻璃棒
11.如图所示,利用电化学原理可同时吸收处理和NO。下列说法正确的是( )
已知是一种弱酸,不考虑与水的反应及能量损耗。
A.b极为直流电源的负极
B.阳极区电极反应为
C.理论上,在相同条件下,该装置吸收的和NO的体积比为
D.电路中若有2ml电子转移,则被吸收的气体体积为44.8L
12.一种用氢气制备双氧水的反应机理如图所示(按①②③的反应顺序进行)。下列有关说法正确的是( )
A.HCl和中存在的化学链类型完全相同
B.和HCl均为该反应的催化剂
C.反应①中每消耗,转移2ml电子
D.整个反应过程只涉及氧化还原反应
13.某固体混合物可能含有Al、、、、、NaCl中的一种或几种,现对该混合物做如图实验,所得现象和有关数据如图(气体体积均已换算成标准状况下的体积)。下列说法错误的是( )
A.“步骤①”中发生了反应
B.“步骤②”和“步骤③”中反应消耗的的物质的量之比大于
C.混合物中一定含有Al、、、NaCl,不含有
D.混合物中一定不含有,可能含有NaCl和
14.工业上利用和在催化剂的作用下合成,发生如下反应: 。现于一定条件下向2L的密闭容器中充入一定量的和发生反应,测得在不同压强下平衡体系中的转化率随温度的变化情况如图所示。下列说法正确的是( )
A.,
B.在、条件下,的过程中,正、逆反应速率之间的关系:
C.a、b、c三点对应的平衡常数、、的大小关系是
D.的过程,正反应速率变小,逆反应速率变大
15.常温下,用调节浊液的pH,测得在通入的过程中,体系中(X代表或)与的关系如图所示。下列说法正确的是( )
已知:为微溶于水,溶于盐酸,不溶于氢氟酸、乙醇和丙酮的固体。
A.
B.随着HCl的加入,溶解度逐渐减小
C.p点对应的溶液中
D.m、n点时的溶液中均存在
二、非选择题:本题共4小题,共55分。
16.(14分)我国化学家侯德榜创立了中国人自己的制碱工艺一一侯氏制碱法(联合制碱法),为我国乃至世界的制碱工业做出了巨大贡献。以粗盐为原料的工业生产工艺流程图如图:
已知:“流程Ⅱ”中反应为。请回答下列问题:
(1)“流程Ⅰ”是对原料粗盐进行提纯的过程,其中试剂1为__________(填化学式,下同)溶液,试剂2为__________溶液。
(2)“流程Ⅱ”中向滤液1中先通入,再通入,顺序__________(填“能”或“不能”)颠倒,理由是__________。
(3)“流程Ⅲ”中灼烧的产物中可循环利用的物质为__________(填化学式)。
(4)某化学兴趣小组利用下列装置在实验室模拟侯氏制碱法制纯碱。
支管a的作用是__________,雾化装置的优点有__________。
(5)制得的纯碱中只含有氯化钠杂质,现取产品样品25g,将其放入干净的烧杯中,加入200g水,使其完全溶解。向所得溶液中慢慢加入溶质质量分数为14.6%的稀盐酸,烧杯中溶液的质量与加入盐酸的质是关系曲线如图所示。(设全部逸出,且只有气体逸出)
①该产品样品中,含碳酸钠的质量为__________。
②A点时,所得不饱和溶液中溶质质量分数为__________(计算结果精确至0.1%)。
17.(13分)亚硝酰氯(NOCl,熔点为-64.5℃,沸点为-5.5℃)是一种红褐色液体或黄色气体,遇水反应生成一种氢化物和两种氧化物,可用于合成清洁剂、触媒剂及中间体等。某学习小组在实验室中用和NO制备NOCl。请回答下列问题:
(1)原料气NO和的制备。
图1
(1)图1中盛有碱石灰的仪器名称是__________。实验室制备NO的反应的离子方程式为__________。
(2)实验室制备可选择图1中的装置__________(填标号);制备并收集干燥的的装置连接顺序:__________(按气流方向,用小写字母表示)。
(2)利用制得的NO和制备亚硝酰氯(NOCl),装置如图2所示。
图2
①装置Ⅰ、Ⅱ除可进一步干燥外,另一个作用是__________。
②装置Ⅳ的作用是__________;若无装置Ⅴ,则装置Ⅳ中NOCl可能发生反应的化学方程式为__________。
18.(15分)汽车尾气中含有、CO,排气管内的催化转化器可实现将污染性气体转化为和。
(1)已知:①
②
③
则与反应生成和的热化学方程式为__________。该反应在__________(填“高温”或“低温”)下可自发进行。
(2)的反应历程如图1(图中所有物质均为气态)。
图1
该反应的决速步骤是反应__________(填对应序号);中间产物的化学式为__________。
(3)利用图2装置可测定汽车尾气中CO的含量,电解质为氧化钇()和氧化钠,该电池中可以在固体介质NASICON(固熔体)内自由移动。
图2
工作时,多孔电极a为__________极,多孔电极b处发生的电极反应为__________。
(4)一定温度下,起始时向2L的恒容密闭容器中充入、,仅发生反应,起始气体总压强为180kPa,20min时反应达到平衡,此时气体总压强为起始压强的。
①内,__________,NO转化率=__________(保留三位有效数字)%。
②此温度下,该反应的平衡常数__________(是用平衡分压代替平衡浓度计算的平衡常数)。
19.(13分)稀土元素是国家战略资源,目前我国稀土提炼技术处于世界领先地位。某课题组以废显示屏玻璃碴(含较多的、、FeO、及少量其他可溶于酸的物质)为原料,设计如图流程回收稀土元素铈,实现资源再利用。
已知:不溶于稀硫酸,也不溶于NaOH溶液。
回答下列问题:
(1)为提高“酸溶”的速率,可采取的措施是__________(填一种);可用于检验“滤液1”中含有的,中铁元素的化合价为__________价。
(2)获得晶体的“一系列操作”包含蒸发浓缩、冷却结晶、过滤、洗涤、常温晾干,则晶体的溶解度随温度的变化关系为__________。
(3)“滤渣2”中主要成分的化学式为__________;“反应3”中的作用与“反应1”中的作用__________(填“相同”或“不相同”)。
(4)“反应4”的离子方程式为__________。
(5)可用作净水剂,其净水原理是__________(用离子方程式表示)。等物质的量浓度的下列三种溶液中,浓度由小到大的顺序是__________(用标号表示)。
①溶液;②溶液;③溶液
(6)取上述流程中得到的产品0.640g,加稀硫酸溶解后,用标准溶液滴定至终点时(铈被还原为),消耗标准溶液的体积为25.00mL,则测得该产品中Ce元素的质量分数约为__________(保留三位有效数字)。
高三化学考试参考答案
1.B【解析】本题主要考查化学与传统文化,侧重考查学生对基础知识的认知能力。“蛎房”经过煅烧后得到氧化钙,A项错误;“桐油”是一种优良的植物油,为脂肪酸甘油三酯混合物,C项错误;碳酸钙受热分解属于吸热的非氧化还原反应,D项错误。
2.A【解析】本题主要考查化学用语,侧重考查学生对基础知识的认知能力。对应的原子符号应为,B项错误;中氢原子与氧原子间的化学键都是单键,C项错误;乙酸分子式为,D项错误。
3.A【解析】本题主要考查物质的工业制备流程,侧重考查学生对基础知识的认知能力。用石灰乳与氯气反应制漂白粉,B项不符合题意;工业上通过电解熔融氯化镁制镁单质,C项不符合题意;工业合成硝酸是将氨气转化成一氧化氮,一氧化氮再转化为二氧化氮,最后转化为硝酸,D项不符合题意。
4.C【解析】本题主要考查实验方案与实验目的,侧重考查学生对基础知识的认知能力。NaClO溶液具有漂白性,需用pH计测量该溶液的pH,A项不符合题意;溴蒸气或二氧化氮气体都具有氧化性,能将碘化钾中的碘氧化成碘单质,能使淀粉溶液变蓝,则湿润的淀粉-KI试纸不能鉴别溴蒸气与二氧化氮气体,B项不符合题意;该溶液也可能是氨水,D项不符合题意。
5.B【解析】本题主要考查氯元素的化合价与部分物质类别的对应关系,侧重考查学生对基础知识的认知能力。b为,是酸性氧化物,B项错误。
6.D【解析】本题主要考查有机物的性质,侧重考查学生对基础知识的认知能力。1个M分子中含有21个碳原子,A项错误;酸性条件下M的水解产物有2种,B项错误;苯环上有6种等效氢,苯环上氢原子发生氯取代时,其一氯代物有6种,C项错误。
7.C【解析】本题主要考查化学实验,侧重考查学生对化学实验的设计能力和理解能力。乙醇能与水互溶,A项不符合题意;实验室制乙酸乙酯时,为了防止发生倒吸,导管不能插入饱和碳酸钠溶液中,B项不符合题意;酸种类不同,且浓度也不同,两个变量不同,不能探究反应速率的影响因素,D项不符合题意。
8.B【解析】本题主要考查元素推断与元素周期律,侧重考查学生对基础知识的理解能力。根据题意可推出X为N,Y为Na,Z为P,W为S或Cl。的半径小于的,A项错误;只含离子键,含离子键和共价键,C项错误;常温下,HCl、都为气态,D项错误。
9.D【解析】本题主要考查离子反应,侧重考查学生对基础知识的理解能力。与不能大量共存,A项不符合题意;酸性条件下,不仅与会发生离子反应,同时与也会发生离子反应,B项不符合题意;酸性条件下,与不能大量共存,C项不符合题意。
10.A【解析】本题主要考查的制备流程,侧重考查学生对基础知识的理解能力。“焙烧”步骤中C的化合价从0价升高到+2价,中S的化合价从+6价降到-2价,因此炭粉作还原剂,作氧化剂,CO是氧化产物,根据得失电子守恒,氧化剂与氧化产物的物质的量之比为,A项符合题意。
11.C【解析】本题主要考查电化学原理,侧重考查学生对基础知识的理解能力。由图可知,与直流电源b极相连的电极为电解池的阳极,则b极为直流电源的正极,A项错误;酸性条件下吸收池中流出的在阴极得电子发生还原反应生成,阴极区的电极反应为,B项错误;阳极区的电极反应为,吸收池中发生反应:,由得失电子数目守恒可知,若不考虑任何损耗,相同条件下,该装置吸收的和NO的体积比为,C项正确;没有指出气体所处状态,D项错误。
12.C【解析】本题主要考查一种用氢气制备双氧水的反应机理,侧重考查学生对基础知识的理解能力。HCl分子中只存在极性共价键,分子中既存在极性共价键,又存在非极性共价键,A项错误;由图中信息可知HCl在①中作为产物,在③中作为反应物,则HCl为中间产物,不作催化剂,B项错误;由图可知③中不存在价态变化,为非氧化还原反应,D项错误。
13.D【解析】本题主要考查物质组成分析,侧重考查学生对基础知识的理解能力。加过量NaOH浓溶液后加热,产生白色沉淀11.6g,久置无明显变化,判断沉淀为,混合物中含有(质量为19g),不含;“步骤①”产生标准状况下22.4L(1ml)气体经过碱石灰后体积不变,经过浓硫酸后剩余13.44L(0.6ml)气体,故“步骤①”产生的气体为氢气和氨气,依据,可推出混合物中含0.4ml铝单质(质量为10.8g),含(质量为);“步骤②”最多得到31.2g白色沉淀[,物质的量为0.4ml],说明混合物中不含;由质量守恒得知混合物中还含有NaCl,质量为。故D项符合题意。
14.B【解析】本题主要考查化学平衡,侧重考查学生对基础知识的理解能力。依图,反应温度升高,CO的平衡转化率降低,可知,该反应的正反应为熵减反应,压强增大,CO的平衡转化率升高,可知,A项错误;a、b、c三点对应的平衡常数、、的大小关系是,项错误;由图可知的过程改变的条件为升高温度,则正、逆反应速率都增大,D项错误。
15.D【解析】本题主要考查难溶电解质的溶解平衡,侧重考查学生对基础知识的理解能力。HF的电离平衡常数,纵坐标相当于,随着变大,变大,变小,则表示的变化情况,表示的变化情况,根据m、n两点的数据,得,A项错误;随着HCl的加入,溶解平衡正向移动,溶解度增大,B项错误;p点时,又根据组成可知,溶液中存在,故p点时,C项错误。
16.(1)(1分);(1分)
(2)不能(1分);氨气在溶液中的溶解度较大,二氧化碳的溶解度较小,先通氨气使溶液呈碱性后再通二氧化碳,有利于析出更多的(2分)
(3)(多写“”不扣分,2分)
(4)平衡滴液漏斗与锥形瓶中的压强,便于稀盐酸顺利滴下(1分);使氨盐水雾化,能增大氨盐与的接触面积,提高的产率(2分)
(5)①21.2g(2分)
②8.6%(2分)
【解析】本题主要考查碳酸钠的制备,考查学生对基础知识的综合运用能力。
(5)①由图像可知,当滴入质量分数为14.6%的稀盐酸至图中A点时(与稀盐酸反应先得到,再与稀盐酸反应放出气体),加入的稀盐酸恰好与碳酸钠反应,可推出A点时对应消耗14.6%的稀盐酸的质量为100g。根据,样品中碳酸钠的物质的量为,则碳酸钠的质量为。
(2)A点时,溶液中的溶质为NaCl,根据钠元素守恒,生成的NaCl的物质的量为,溶液中NaCl的质量为,放出二氧化碳的质量为,溶液的总质量为,溶液中溶质(NaCl)的质量分数为。
17.(1)①球形干燥管(2分);(2分)
②AB(2分);fgcbdej(h)(2分)
(2)①通过观察气泡调节气体的流速(或其他合理答案,1分)
②冷却并收集液态NOCl(2分);(2分)
【解析】本题主要考查化学实验,考查学生对化学实验的理解能力和设计能力。
(1)②制得的氯气中含有氯化氢及水蒸气,所以需要利用饱和食盐水除去氯化氢后再用浓硫酸进行干燥,然后再根据氯气的密度比空气大的性质,用向上排空气法收集,氯气是有毒气体,需要进行尾气处理,可以用碱石灰作吸收剂,故装置连接顺序为afgcbdej(h)。
(2)①通过观察洗气瓶中气泡的快慢,调节气体的流速,以达到最佳反应比,提高原料的利用率,减少有害气体的排放。
②已知NOCl沸点为-5.5℃,遇水易水解,所以可用冰盐冷却收集液体NOCl。装有无水的干燥管Ⅴ防止水蒸气进入装置Ⅳ中使NOCl变质,NOCl与水反应生成盐酸、一氧化氮和二氧化氮,反应的化学方程式为。
18.(1) (2分);低温(1分)
(2)①(1分);、(2分)
(3)负(1分);(2分)
(4)①0.0025(2分);66.7(2分)
②(2分)
【解析】本题主要考查化学反应原理有关知识,考查学生对化学反应原理的理解能力和综合运用能力。
(4)①反应达到平衡时气体总压强为150kPa。设内生成的的物质的量为。
n(起始)/ml0.30.300
n(转化)/mlx
x
根据题意:,。
则,NO转化率。
(2)平衡时气体总物质的量为0.5ml,则。
19.(1)适当升高酸溶的温度(或其他合理答案,1分);+3(1分)
(2)溶解度随温度的升高而增大(1分)
(3)(1分);不相同(1分)
(4)(2分)
(5)(2分);(2)<(1)<(3)(2分)
(6)54.7%或0.547(2分)
【解析】本题主要考查以废显示屏玻璃碴为原料回收稀土元素铈,考查学生对元素化合物知识的综合运用能力。
(3)“反应3”中加入稀硫酸和溶液,发生反应的离子方程式为。
(4)“滤液2”中含,向其中加入NaOH溶液,并通入,转化为,反应的离子方程式为。
(6)依计量关系:,即:
1ml1ml
0.0025ml
,所以,产品中Ce元素的质量分数为。A
B
C
D
分离乙醇和水
实验室制乙酸乙酯
收集并吸收多余尾气
探究化学反应速率的影响因素
选项
离子组
加入的试剂
离子方程式
A
、、
少量NaOH溶液
B
、、
少量溶液
C
、、
少量溶液
D
、、
足量铁粉
辽宁省沈阳市部分高中2023-2024学年高三上学期1月教学质量监测(一)化学试题含答案: 这是一份辽宁省沈阳市部分高中2023-2024学年高三上学期1月教学质量监测(一)化学试题含答案,共15页。试卷主要包含了考试结束后,考生将答题卡交回,下列离子方程式中书写正确的是,下列说法中错误的是等内容,欢迎下载使用。
辽宁省部分高中2023-2024学年高三上学期期末考试化学试题含答案: 这是一份辽宁省部分高中2023-2024学年高三上学期期末考试化学试题含答案,共13页。试卷主要包含了下列化学用语或表述正确的是,下列关于工业生产的说法错误的是,3%的浓硫酸吸收SO3制备硫酸,下列说法正确的是等内容,欢迎下载使用。
30,辽宁省沈阳市部分高中2023-2024学年高三上学期教学质量监测(一)化学试题: 这是一份30,辽宁省沈阳市部分高中2023-2024学年高三上学期教学质量监测(一)化学试题,共12页。试卷主要包含了考试结束后,考生将答题卡交回,下列离子方程式中书写正确的是,下列说法中错误的是等内容,欢迎下载使用。












