

常见的酸和碱---江苏三年(2021-2023)中考化学模拟题分类汇编
展开A.石榴花捣碎出汁后可提取红色染料
B.加酸性物质有利于红色素浸染布料
C.石榴花中红色染料受热有利于上色
D.古法制石榴裙不宜与碱性物质接触
2.(2023•天宁区校级模拟)一瓶未开封的浓盐酸,部分标签如图所示。下列说法正确的是( )
A.可加热浓缩成98%的浓盐酸
B.整瓶含有185gHCl溶质
C.可加水稀释成5%的稀盐酸
D.打开瓶盖冒出白色烟雾
3.(2022•南京一模)某兴趣小组同学将pH传感器分别插入三只盛有相同体积蒸馏水的烧杯中,打开磁力搅拌器,同时采集数据,再向三只烧杯中同时分别加入适量的柠檬酸、氯化钠、氢氧化钠三种固体。实验数据如图所示,下列说法不正确的是( )
A.①表示氢氧化钠溶于水,说明OH﹣浓度越大pH越大
B.②表示氯化钠溶于水,pH=7说明溶液中无自由移动离子
C.③表示柠檬酸溶于水,说明H+浓度越大pH越小
D.柠檬酸溶液和氢氧化钠能发生中和反应
4.(2021•昆山市二模)某校化学小组在利用硫酸和氢氧化钠溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图象,如图所示.下列说法中,正确的是( )
A.图中c点所示溶液呈碱性,此时氢氧化钠溶液过量
B.图中a点所示溶液中,含有的溶质是Na2SO4和H2SO4
C.由a点到b点的pH变化过程证明酸和碱发生了中和反应
D.该实验是将氢氧化钠溶液逐滴滴入到盛有硫酸的烧杯中
5.(2023•广陵区校级一模)某位病人体检时检测出的体液pH如下,其中酸性最强的是( )
A.血液:7.45B.胃液:1.0C.胆汁:6.9D.尿液:5.4
6.(2023•邗江区四模)下列溶液的pH<7的是( )
A.白醋B.纯碱溶液C.氯化钠溶液D.蔗糖溶液
7.(2022•无锡一模)有关如图试剂的描述正确的是( )
A.该试剂可使纸张炭化
B.该试剂可用作干燥剂
C.溶质与溶剂的质量比是37:100
D.打开该试剂瓶,瓶口会出现白雾
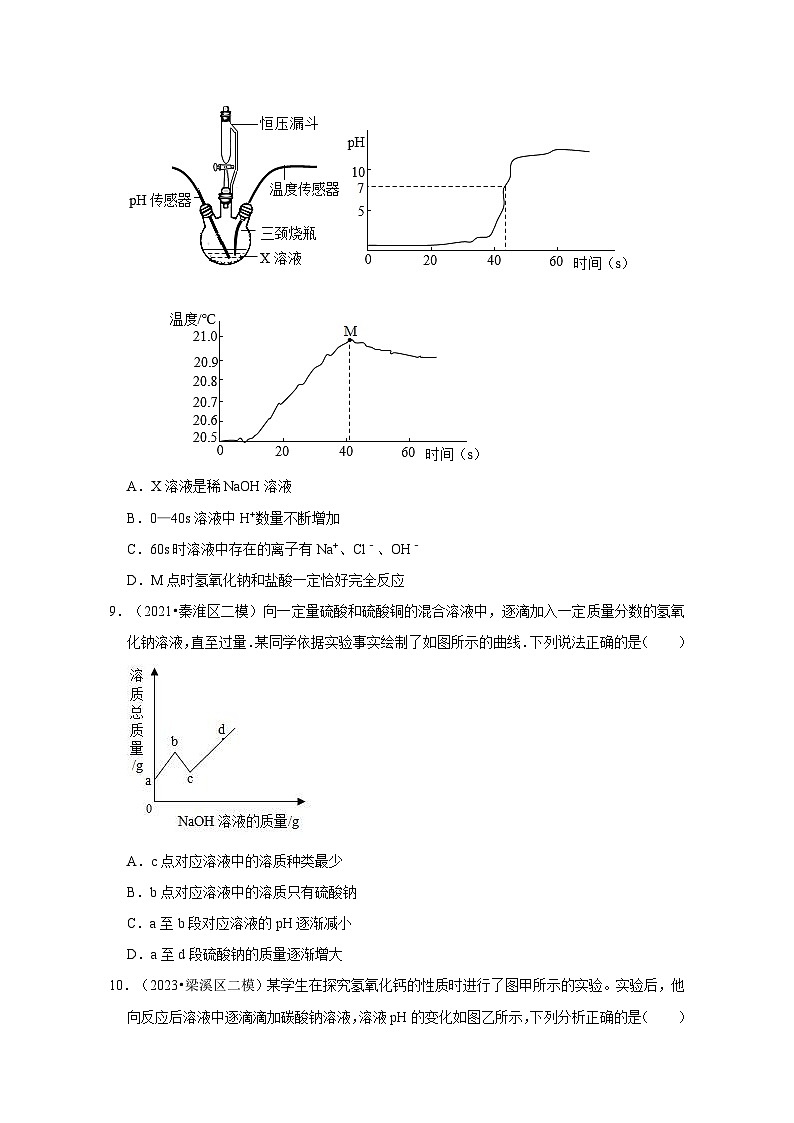
8.(2023•天宁区校级二模)实验小组借助传感器对稀NaOH溶液与稀盐酸的反应进行研究。三颈烧瓶中盛放溶液X,用恒压漏斗匀速滴加另一种溶液,并用磁力投拌器不断搅拌。实验装置和测定结果如图。下列说法正确的是( )
A.X溶液是稀NaOH溶液
B.0—40s溶液中H+数量不断增加
C.60s时溶液中存在的离子有Na+、Cl﹣、OH﹣
D.M点时氢氧化钠和盐酸一定恰好完全反应
9.(2021•秦淮区二模)向一定量硫酸和硫酸铜的混合溶液中,逐滴加入一定质量分数的氢氧化钠溶液,直至过量.某同学依据实验事实绘制了如图所示的曲线.下列说法正确的是( )
A.c点对应溶液中的溶质种类最少
B.b点对应溶液中的溶质只有硫酸钠
C.a至b段对应溶液的pH逐渐减小
D.a至d段硫酸钠的质量逐渐增大
10.(2023•梁溪区二模)某学生在探究氢氧化钙的性质时进行了图甲所示的实验。实验后,他向反应后溶液中逐滴滴加碳酸钠溶液,溶液pH的变化如图乙所示,下列分析正确的是( )
A.进行甲实验后,试管中溶液颜色呈红色
B.图乙中d﹣m段同时发生多个化学反应
C.图乙中m﹣n段pH不发生变化的原因是碱性物质被酸消耗
D.图乙中n点之后溶液中的溶质有Na2CO3和NaCl
11.(2023•梁溪区校级二模)电导率是衡量溶液导电能力大小的物理量,在相同条件下,电导率与离子浓度(单位体积内的离子数)成正比,利用数据传感技术测定溶液电导率可辅助探究复分解反应。对如图所示实验分析不正确的是( )
A.P点时溶液中的阳离子有Na+、H+
B.M到N时,氢氧化钠溶液过量,溶液呈碱性
C.P到M电导率减小是因为溶液中离子数量逐渐减少
D.N点时溶液中的离子数大于P点
12.(2021•虎丘区校级一模)溶液的碱性强弱跟溶液中OH﹣的数量有关。一定体积的溶液中OH﹣数量越多,则溶液碱性越强。100mL 10%的NaOH溶液(密度为1.1g/cm3)与100mL 10%的KOH溶液(密度也为1.1g/cm3)相比较,碱性更强的是( )
A.NaOHB.KOHC.一样强D.无法比较
13.(2022•南通模拟)向某硫酸和硫酸铜的混合溶液中加入某浓度的氢氧化钠溶液,产生沉淀的质量与加入氢氧化钠溶液的质量关系如图所示。下列说法错误的是( )
A.a点溶液中滴入紫色石蕊试液变红
B.bc段(不含b点)反应的化学方程为CuSO4+2NaOH═Cu(OH)2↓+Na2SO4
C.整个变化过程中硫酸根离子数目没有改变
D.d点溶液中含有两种溶质
14.(2022•常熟市校级二模)中和反应在工农业生产和日常生活中有广泛的用途,下列应用一定与中和反应原理无关的是( )
A.服用含Al(OH)3的药物治疗胃酸过量
B.使用熟石灰改良酸性土壤
C.用熟石灰和硫酸铜配制波尔多液
D.用氢氧化钠溶液洗涤石油产品中的残余硫酸
15.(2023•玄武区一模)某兴趣小组取三份相同体积相同浓度的氢氧化钠溶液,分别滴入两滴无色酚酞溶液,再以相同的速度同时滴加不同浓度的盐酸,得到溶液的pH随时间变化的曲线如图所示。下列说法正确的是( )
A.在a、b、c三种曲线所示的实验中,所用盐酸的浓度由大到小的顺序为c>b>a
B.在a曲线所示的实验中,图中A点所示溶液中,所含的溶质只有NaOH
C.在a、b、c三种曲线所示的实验中,溶液红色最先褪去的是c
D.在a、b、c三种曲线所示的实验中,20min时溶液的酸性由强到弱的顺序是a>b>c
16.(2023•润州区二模)烧杯中盛有4.0gMgO,向其中遂滴滴加100.0g稀硫酸,然后再在溶液中滴加Ba(OH)2溶液,产生沉淀的质量与滴加的溶液质量关系如图所示。下列说法正确的是( )
A.a点对应的溶液中有1种溶质
B.b点对应的固体中有Mg(OH)2和BaSO4
C.m=2.33
D.H2SO4在原溶液中的溶质质量分数为11.78%
17.(2023•建邺区校级二模)中和反应是一类重要的化学反应,兴趣小组利用图1研究稀盐酸与氢氧化钠溶液反应的过程,并用pH和电导率传感器测定反应过程中pH和电导率的变化(如图2和图3)下列说法正确的是( )
A.图1中滴加的a溶液为稀盐酸
B.图2中b→c能证明稀盐酸和氢氧化钠溶液发生了化学反应
C.图2中d→e所示溶液中的NaCl的质量不断增加
D.图3中90s之前电导离下降是因为溶液中的离子数量逐渐减少
18.(2021•太仓市模拟)将一定量的氢氧化钠溶液与稀盐酸混合,二者恰好完全反应的微观示意图如图。由此分析下列说法正确的是( )
A.反应前后阴、阳离子的总数目不变
B.反应前后溶剂质量不变
C.反应后溶液呈中性
D.反应前后元素种类发生了变化
19.(2023•京口区校级模拟)烧杯中盛有8.0gCuO,向其中逐滴滴加100.0g稀硫酸,然后再在溶液中滴加Ba(OH)2溶液,产生沉淀的质量与滴加的溶液质量关系如图所示。下列说法正确的是( )
A.a点对应的溶液中有2种溶质
B.b点对应的固体中有Cu(OH)2和BaSO4
C.H2SO4在原溶液中的溶质质量分数为14.7%
D.m=37.76
20.(2023•高新区校级二模)溶液的酸碱性也会影响难溶物的溶解性,下列难溶物在一定量水中的溶解量会随pH降低而增加的是( )
A.AuB.AgClC.BaSO4D.Mg(OH)2
二.填空题(共3小题)
21.(2023•淮阴区二模)2022年北京冬奥会是一届绿色奥运、科技奥运、人文奥运,真是惊艳世界!
(1)冬奥会火炬“飞扬”采用氢气作燃料,体现了绿色奥运的理念,关闭火炬的燃气开关,使火炬熄灭,采用的灭火原理是 ;
(2)冬奥会速滑场馆“冰丝带”采用的是CO2跨临界直冷制冰。
①对CO2气体加压、降温,可得到干冰,从构成物质微粒角度分析,该过程主要改变的是分子的 (填“种类”或“间隔”)。
②捕集、利用和封存是实现碳中和的一种途径。如图是利用氢氧化钠溶液吸收CO2的部分转化关系图。
反应Ⅰ的化学方程式为 ,该转化中可以循环利用的物质是 (填化学式)。
22.(2023•姑苏区校级一模)硫酸是初中常用的化学试剂。
(1)①现将100mL溶质质量分数为98%的浓硫酸(密度为1.84g•mL﹣1)和500mL蒸馏水混合,充分搅拌后,得到稀硫酸的溶质质量分数为 (结果精确到0.1%)。
②如果少量浓硫酸沾到皮肤或衣物上,必须迅速用 ,再涂上碳酸氢钠溶液(3%~5%)。碳酸氢钠与硫酸反应的化学方程式为 。
(2)①Ba(OH)2溶液中有较多能自由移动的阳离子是 (填离子符号)。
②分别用pH和溶液电导率(表示溶液传导电流的能力)传感器对Ba(OH)2溶液与稀硫酸反应进行探究,测定结果见图1和图2。下列说法中正确的是 (填字母)。
A.由如图1可知,实验是向稀Ba(OH)2溶液中滴入稀硫酸
B.图2中0s~6s,说明溶液中有带电离子
C.如图2中6s~30s,电导率下降是因为带电离子的数目减少
D.M点和N点均表示Ba(OH)2和H2SO4恰好完全反应
23.(2023•江宁区二模)通过物质的共性和差异性认识物质是学习化学的一种思路与方法。
Ⅰ.图1以稀盐酸为例的反应关系体现了酸的化学性质。
(1)反应①中石蕊溶液变为 色。
(2)从微观角度分析,反应③的实质是 。
(3)反应⑤的化学方程式为 。
(4)Na2CO3溶液不仅能和稀盐酸反应,还能和其他酸以及某些碱或盐发生复分解反应。
下列物质中能和Na2CO3溶液发生复分解反应且产生沉淀的是 (填字母)。
A.BaCl2溶液
B.H2SO4溶液
C.Ca(OH)2溶液
D.KNO3溶液
Ⅱ.基于微观视角探究酸化学性质的相似性和差异性。
(1)分别向稀盐酸和稀硫酸加入经打磨的镁条,都会迅速产生大量气泡,从微观角度分析产生相同现象的原因是:稀盐酸和稀硫酸中都含有 (填符号)。
(2)分别向稀盐酸和稀硫酸加入Ba(NO3)2溶液,可观察到稀硫酸中出现白色沉淀,有关反应的化学方程式为 ,而稀盐酸中没有出现浑浊。从微观角度分析二者性质差异的原因是 。
(3)某物质溶于水时解离情况如图2所示,预测下列物质中能与该溶液发生化学反应的有 (填字母)。
A.NaHCO3溶液
B.锌粒
C.KOH溶液
D.BaCl2溶液
Ⅲ.向某浓度Na2CO3溶液中逐滴加入稀盐酸时,溶液中含碳元素的3种微粒数随盐酸体积的变化情况如图所示(CO2因逸出而忽略)。
(1)图中OB段反应的化学方程式为 。
(2)图中A点所示溶液中的溶质有 (写化学式)。
三.实验题(共2小题)
24.(2023•惠山区校级三模)某化学兴趣小组对盐酸和氢氧化钠溶液发生的中和反应进行“可视化”探究,设计并完成以下实验(实验装置中夹持仪器已略去)。
【实验一】借助指示剂的颜色变化来判断。实验操作如图所示。
(1)证明中和反应发生的现象是 ;写出该反应的化学方程式 。
【实验二】借助数字传感器,进行数据分析判断。用数字传感器测量稀盐酸与氢氧化钠溶液的反应,pH变化曲线和温度变化曲线如图所示。
(2)根据pH变化曲线,证明氢氧化钠溶液和盐酸反应的依据是 。根据温度变化曲线可知,该反应 (填“放热”或“吸热”)。M最接近的数据是 。(填“6”、“7”、“12”或“16”)
25.(2023•溧阳市一模)酸碱中和反应是初中阶段重要的一类反应,请你参与一起探究。
【实验一】从能量变化角度探究酸和碱的反应
某小组同学测量盐酸与氢氧化钠溶液反应过程中温度的变化,观察到溶液温度升高,因此,得出两者能反应的结论。有同学认为此结论不够严谨,为此他在室温下设计了以下实验:
①10mL、20%的盐酸与10mL蒸馏水混合,测量溶液温度的变化。
②10mL、20%的氢氧化钠溶液与10mL蒸馏水混合,测量溶液温度的变化。
③10mL、20%的盐酸与10mL、20%的氢氧化钠溶液混合,测量溶液温度的变化。
用数字化实验技术测得3个实验中溶液温度随时间变化的关系如图所示。
(1)由如图可知,盐酸、氢氧化钠溶液稀释时均 (填“放热”或“吸热”)。
(2)从微观角度分析,此中和反应的温度变化主要是由于 (填离子符号)两种离子反应生成水,放出热量的缘故,由此说明氢氧化钠和盐酸发生了中和反应。
(3)在10mL溶质质量分数为10%NaOH溶液(密度为1.1g/mL)加入溶质质量分数为5%的盐酸(密度为1.0g/mL)的体积 mL(结果保留整数),就能使反应后溶液的pH等于7。
【实验二】从溶液电导率变化角度探究酸和碱的反应
小组同学根据如图进行相应实验操作,利用电导率传感器测定反应过程中溶液的电导率变化如图所示。已知:溶液电导率大小与溶液离子浓度成正比。
(4)如图也能说明氢氧化钠和盐酸发生了中和反应,写出图中试管中发生反应的化学方程式 。
(5)据图可确定NaOH与HCl恰好完全反应的点是 (选填:“a”、“b”、“c”或“d”)。
(6)图中d点所示溶液中含有的离子有 (填离子符号)。
江苏中考三年(2021-2023)化学模拟题分类汇编---常见的酸和碱
参考答案与试题解析
一.选择题(共20小题)
1.(2023•天宁区校级模拟)唐代流行服饰石榴裙因其颜色类似石榴花的红色而得名,古法染色工艺记载:“取石榴之花,入白细杵之,得厚汁,加之以醋或乌梅汁,以之染布,不可加热,尽赤,可为石榴裙也”。下列说法不正确的是( )
A.石榴花捣碎出汁后可提取红色染料
B.加酸性物质有利于红色素浸染布料
C.石榴花中红色染料受热有利于上色
D.古法制石榴裙不宜与碱性物质接触
【考点】酸的化学性质.
【专题】常见的酸 酸的通性.
【答案】C
【分析】根据题意,唐代流行服饰石榴裙因其颜色类似石榴花的红色而得名,古法染色工艺记载:“取石榴之花,入白细杵之,得厚汁,加之以醋或乌梅汁,以之染布,不可加热,尽赤,可为石榴裙也”,结合现象内容进行分析判断。
【解答】解:A、唐代流行服饰石榴裙因其颜色类似石榴花的红色而得名,石榴花捣碎出汁后可提取红色染料,故选项说法正确。
B、取石榴之花,入白细杵之,得厚汁,加之以醋或乌梅汁,以之染布,则加酸性物质有利于红色素浸染布料,故选项说法正确。
C、不可加热,尽赤,则石榴花中红色染料受热不有利于上色,故选项说法错误。
D、加之以醋或乌梅汁,以之染布,则古法制石榴裙的显酸性,不宜与碱性物质接触,故选项说法正确。
故选:C。
【点评】本题难度不大,理解题意、了解酸的化学性质等是正确解答本题的关键。
2.(2023•天宁区校级模拟)一瓶未开封的浓盐酸,部分标签如图所示。下列说法正确的是( )
A.可加热浓缩成98%的浓盐酸
B.整瓶含有185gHCl溶质
C.可加水稀释成5%的稀盐酸
D.打开瓶盖冒出白色烟雾
【考点】酸的物理性质及用途;用水稀释改变浓度的方法;有关溶质质量分数的简单计算.
【专题】常见的酸 酸的通性.
【答案】C
【分析】根据已有的浓盐酸的知识结合标签内容进行分析解答即可。
【解答】解:A、浓盐酸中的溶质是氯化氢气体,加热则氯化氢气体会逸出,故不能加热浓缩成98%的浓盐酸,故A错误;
B、整瓶含有500mL×1.18g•mL﹣1×37%=218.3g溶质,不是185g溶质,故B错误;
C、37%的浓盐酸可加水稀释成5%的稀盐酸,故C正确;
D、打开瓶盖冒出白雾,不是烟,故D错误;
故选:C。
【点评】加强对物质性质的掌握是正确解答本题的关键。
3.(2022•南京一模)某兴趣小组同学将pH传感器分别插入三只盛有相同体积蒸馏水的烧杯中,打开磁力搅拌器,同时采集数据,再向三只烧杯中同时分别加入适量的柠檬酸、氯化钠、氢氧化钠三种固体。实验数据如图所示,下列说法不正确的是( )
A.①表示氢氧化钠溶于水,说明OH﹣浓度越大pH越大
B.②表示氯化钠溶于水,pH=7说明溶液中无自由移动离子
C.③表示柠檬酸溶于水,说明H+浓度越大pH越小
D.柠檬酸溶液和氢氧化钠能发生中和反应
【考点】中和反应及其应用;溶液的酸碱性与pH的关系.
【专题】常见的酸 酸的通性.
【答案】B
【分析】A、根据溶液的pH>7,且逐渐的增大,则溶液呈碱性进行分析;
B、根据pH=7,则溶液一直呈中性,烧杯中加入的物质为NaCl进行分析;
C、根据溶液的pH<7,且逐渐的减小,则溶液呈酸性,进行分析;
D、根据柠檬酸溶液含有H+,氢氧化钠溶液中含有OH﹣,则两溶液混合后能发生中和反应进行分析。
【解答】解:A.曲线①可知溶液的pH>7,且逐渐的增大,则溶液呈碱性,向烧杯中加入的物质为NaOH,碱溶液中OH﹣浓度越大,碱性越强,pH越大,故A正确;
B.曲线②溶液可知的pH=7,则溶液一直呈中性,烧杯中加入的物质为NaCl,NaCl的溶液中含有自由移动的Na+、Cl﹣,故B错误;
C.曲线③可知溶液的pH<7,且逐渐的减小,则溶液呈酸性,向烧杯中加入的物质为柠檬酸,酸溶液中H+浓度越大,酸性越强,pH越小,故C正确;
D.柠檬酸溶液含有H+,氢氧化钠溶液中含有OH﹣,则两溶液混合后能发生中和反应,故D正确。
故选:B。
【点评】本题主要考查中和反应及其应用等,注意完成此题,可以从题干中抽取有用的信息,结合已有的知识进行解题。
4.(2021•昆山市二模)某校化学小组在利用硫酸和氢氧化钠溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图象,如图所示.下列说法中,正确的是( )
A.图中c点所示溶液呈碱性,此时氢氧化钠溶液过量
B.图中a点所示溶液中,含有的溶质是Na2SO4和H2SO4
C.由a点到b点的pH变化过程证明酸和碱发生了中和反应
D.该实验是将氢氧化钠溶液逐滴滴入到盛有硫酸的烧杯中
【考点】中和反应及其应用;溶液的酸碱性与pH的关系.
【专题】常见的酸 酸的通性;常见的碱 碱的通性.
【答案】C
【分析】A.根据c点的pH小于7,溶液显酸性,据此进行分析判断.
B.根据a点的pH大于7,溶液显碱性,据此进行分析判断.
C.根据由a到b点的pH值的变化是从大于7逐渐的减小到等于7,进行分析解答.
D.根据图象中pH值的变化是从大于7逐渐的减小到小于7,进行分析解答.
【解答】解:A.c点的pH小于7,溶液显酸性,故错误;
B.a点的pH大于7,溶液显碱性,溶液中的溶质是硫酸钠和氢氧化钠,故错误;
C.由a到b点的pH值的变化是从大于7逐渐的减小到等于7,可以说明酸和碱发生了中和反应,故正确。
D.由图象可知,pH值是开始时大于7逐渐的减小到7然后小于7,可知原溶液显碱性,然后不断的加入酸性溶液,使pH减小,说明是把稀盐酸滴加到氢氧化钠溶液中,故错误。
故选:C。
【点评】本题难度不是很大,主要考查了中和反应及其应用,掌握溶液的酸碱性和溶液pH大小之间的关系、从数形结合的角度理解中和反应是正确解答本题的关键.
5.(2023•广陵区校级一模)某位病人体检时检测出的体液pH如下,其中酸性最强的是( )
A.血液:7.45B.胃液:1.0C.胆汁:6.9D.尿液:5.4
【考点】溶液的酸碱性与pH的关系.
【专题】常见的酸 酸的通性.
【答案】B
【分析】根据溶液的pH<7时,溶液呈酸性,pH越小,酸性越强分析。
【解答】解:溶液的pH<7时,溶液呈酸性,pH越小,酸性越强,则胃液的pH=1.0,酸性最强,血液的pH>7,呈碱性。
故选:B。
【点评】本题主要考查溶液的pH<7时,溶液呈酸性,pH越小,酸性越强等,注意完成此题,可以从题干中抽取有用的信息,结合已有的知识进行。
6.(2023•邗江区四模)下列溶液的pH<7的是( )
A.白醋B.纯碱溶液C.氯化钠溶液D.蔗糖溶液
【考点】溶液的酸碱性与pH的关系.
【专题】常见的酸 酸的通性.
【答案】A
【分析】根据溶液的酸碱性来分析,当溶液呈中性时,其pH等于7;当溶液显酸性时,其pH小于7;当溶液显碱性时,其pH大于7。
【解答】解:A、白醋是醋酸的水溶液,溶液显酸性,pH<7,符合题意;
B、纯碱(碳酸钠)溶液显碱性,pH>7,不符合题意;
C、氯化钠溶液呈中性,pH=7,不符合题意;
D、蔗糖溶液呈中性,pH=7,不符合题意;
故选:A。
【点评】本题难度不大,掌握溶液的酸碱性和溶液pH大小之间的关系是顺利解题的关键。
7.(2022•无锡一模)有关如图试剂的描述正确的是( )
A.该试剂可使纸张炭化
B.该试剂可用作干燥剂
C.溶质与溶剂的质量比是37:100
D.打开该试剂瓶,瓶口会出现白雾
【考点】酸的物理性质及用途;溶液、溶质和溶剂的相互关系与判断;溶质的质量分数.
【专题】常见的酸 酸的通性.
【答案】D
【分析】根据图示可知该试剂是37%的浓盐酸,据此分析。
【解答】解:A、盐酸不具有脱水性,不能使纸张碳化,说法错误,故该选项不符合题意;
B、盐酸不具有吸水性,不能做干燥剂,说法错误,故该选项不符合题意;
C、37%的浓盐酸中溶质与溶剂的质量比是37:(100﹣37)=37:63,说法错误,故该选项不符合题意;
D、盐酸易挥发,打开该试剂瓶,瓶口会出现白雾,说法正确,故该选项不符合题意。
故选:D。
【点评】本题主要考查了酸的物理性质及用途以及溶液、溶质和溶剂的相互关系与判断、溶质的质量分数,加强对常见酸的性质的掌握是正确解答本题的关键。
8.(2023•天宁区校级二模)实验小组借助传感器对稀NaOH溶液与稀盐酸的反应进行研究。三颈烧瓶中盛放溶液X,用恒压漏斗匀速滴加另一种溶液,并用磁力投拌器不断搅拌。实验装置和测定结果如图。下列说法正确的是( )
A.X溶液是稀NaOH溶液
B.0—40s溶液中H+数量不断增加
C.60s时溶液中存在的离子有Na+、Cl﹣、OH﹣
D.M点时氢氧化钠和盐酸一定恰好完全反应
【考点】中和反应及其应用.
【专题】常见的酸 酸的通性.
【答案】C
【分析】A、根据该溶液pH是小于7显酸性的,随时间逐渐增大的最后pH大于7,进行分析;
B、根据0—40s时pH不断增大进行分析;
C、根据60s时溶液pH大于10进行分析;
D、根据M点时对应时间为40s,此时溶液pH还小于7进行分析。
【解答】解:A、由pH图像可知溶液pH是小于7显酸性的,随时间逐渐增大的最后pH大于7,故是将稀NaOH溶液滴入稀盐酸,X溶液是稀盐酸,故A不正确;
B、由图可知,0—40s时pH不断增大,说明随着不断滴入稀NaOH溶液,溶液中H+数量不断减少,故B不正确;
C、60s时溶液pH大于10,说明碱已经过量,此时溶液中存在的离子有Na+、Cl﹣、OH﹣,故C正确;
D、M点时对应时间为40s,此时溶液pH还小于7,说明氢氧化钠和盐酸还没完全反应,盐酸还有剩余,故D不正确;
故选:C。
【点评】本题主要考查中和反应及其应用等,注意完成此题,可以从题干中抽取有用的信息,结合已有的知识进行解题。
9.(2021•秦淮区二模)向一定量硫酸和硫酸铜的混合溶液中,逐滴加入一定质量分数的氢氧化钠溶液,直至过量.某同学依据实验事实绘制了如图所示的曲线.下列说法正确的是( )
A.c点对应溶液中的溶质种类最少
B.b点对应溶液中的溶质只有硫酸钠
C.a至b段对应溶液的pH逐渐减小
D.a至d段硫酸钠的质量逐渐增大
【考点】碱的化学性质;溶液的酸碱性与pH的关系.
【专题】常见的碱 碱的通性.
【答案】A
【分析】向一定量硫酸和硫酸铜的混合溶液中,逐滴加入一定质量分数的氢氧化钠溶液,直至过量,此过程在氢氧化钠先和硫酸反应,然后和硫酸铜反应,据此分析.
【解答】解:向一定量硫酸和硫酸铜的混合溶液中,逐滴加入一定质量分数的氢氧化钠溶液,直至过量,此过程在氢氧化钠先和硫酸反应,然后和硫酸铜反应。
A、c点时硫酸铜恰好完全反应,此时对应溶液中的溶质只有硫酸钠,溶质种类最少,故说法正确;
B、b点时硫酸恰好完全反应,此时对应溶液中的溶质为硫酸钠和硫酸铜,故说法错误;
C、a至b段是氢氧化钠中和硫酸,对应溶液的pH逐渐增大,故说法错误;
D、a至c段硫酸钠的质量逐渐增大,c到d端硫酸钠质量不再增加,故说法错误。
故选:A。
【点评】解答本题的关键是要理解图象的物理意义和所代表的反应的反应原理和相关物质的定量反应关系,难度不大.
10.(2023•梁溪区二模)某学生在探究氢氧化钙的性质时进行了图甲所示的实验。实验后,他向反应后溶液中逐滴滴加碳酸钠溶液,溶液pH的变化如图乙所示,下列分析正确的是( )
A.进行甲实验后,试管中溶液颜色呈红色
B.图乙中d﹣m段同时发生多个化学反应
C.图乙中m﹣n段pH不发生变化的原因是碱性物质被酸消耗
D.图乙中n点之后溶液中的溶质有Na2CO3和NaCl
【考点】碱的化学性质;溶液的酸碱性与pH的关系.
【专题】常见的碱 碱的通性.
【答案】D
【分析】根据盐酸和氯化钙溶液中加入碳酸钠,碳酸钠先和盐酸反应,再和氯化钙反应,结合题给图进行分析。
【解答】解:A、酚酞遇碱性溶液变红色,遇酸性中性溶液不变色,进行甲实验后,盐酸和氢氧化钙反应生成氯化钙,且盐酸过量,试管中溶液颜色由红色变为无色,故A错误;
B、pH大于7呈碱性,pH=7呈中性,pH小于7呈酸性,由图可知溶液由酸性变为中性,d﹣m段反应为试管中过量的盐酸和碳酸钠反应,故B错误;
C、m﹣n段pH=7,反应为碳酸钠和氯化钙反应生成碳酸钙沉淀的反应,故C错误;
D、图乙中则n点之后溶液中的溶质有氯化钠和过量的碳酸钠,故D正确。
故选:D。
【点评】本题是酸和盐的混合溶液与另一种盐反应先后顺序问题,有一点难度,要先按顺序写出方程式。
11.(2023•梁溪区校级二模)电导率是衡量溶液导电能力大小的物理量,在相同条件下,电导率与离子浓度(单位体积内的离子数)成正比,利用数据传感技术测定溶液电导率可辅助探究复分解反应。对如图所示实验分析不正确的是( )
A.P点时溶液中的阳离子有Na+、H+
B.M到N时,氢氧化钠溶液过量,溶液呈碱性
C.P到M电导率减小是因为溶液中离子数量逐渐减少
D.N点时溶液中的离子数大于P点
【考点】溶液的导电性及其原理分析.
【专题】化学反应的基本类型和能量变化.
【答案】C
【分析】A、根据M点电导率最小,则说明此时恰好反应,则P点时表示加入的氢氧化钠还未将盐酸完全反应进行分析。
B、根据M点时溶液的电导率最小,即溶液中离子浓度最小进行分析。
C、根据P到M,离子数目没有减少进行分析。
D、根据N点时溶液的电导率与P点时相同,进行分析。
【解答】解:A.M点电导率最小,则说明此时恰好反应,则P点时表示加入的氢氧化钠还未将盐酸完全反应,则P点的溶质为氯化钠和氯化氢,溶液中的阳离子为钠离子和氢离子,故A正确;
B.M点时溶液的电导率最小,即溶液中离子浓度最小,即NaOH溶液与稀盐酸恰好完全反应,M到N时,氢氧化钠溶液过量,溶液呈碱性,故B正确;
C.P到M,离子数目没有减少,只是溶液体积增大,离子浓度减小,因此电导率减小,故C不正确;
D.N点时溶液的电导率与P点时相同,但是N点时溶液的体积大于P点时溶液的体积,说明N点时溶液中的离子数大于P点,故D正确。
故选:C。
【点评】本题主要考查复分解反应的条件与实质等,注意完成此题,可以从题干中抽取有用的信息,结合已有的知识进行解题。
12.(2021•虎丘区校级一模)溶液的碱性强弱跟溶液中OH﹣的数量有关。一定体积的溶液中OH﹣数量越多,则溶液碱性越强。100mL 10%的NaOH溶液(密度为1.1g/cm3)与100mL 10%的KOH溶液(密度也为1.1g/cm3)相比较,碱性更强的是( )
A.NaOHB.KOHC.一样强D.无法比较
【考点】溶液的酸碱性测定.
【专题】结合课本知识的信息.
【答案】A
【分析】要比较溶液的碱性强弱,就要比较等体积的10%的NaOH溶液与10%的KOH溶液中OH﹣数量。根据一定体积的溶液中OH﹣数量越多溶液碱性越强,判断10%的NaOH溶液与10%的KOH溶液碱性的强弱关系。
【解答】解:100mL10%的NaOH溶液中所含OH﹣数量=(100mL×1.1g/cm3×10%)××100%=4.675
100mL10%的KOH溶液中所含OH﹣数量=(100mL×1.1g/cm3×10%)××100%=3.339由于4.675>3.339,所以,10%的NaOH溶液的碱性比10%的KOH溶液的碱性强;由以上计算可知,A正确,B、C、D错误。
故选:A。
【点评】在计算溶液中的OH﹣的数量时,把NaOH、KOH中的氢氧根看成一个整体(或一种元素),可计算其中氢氧根离子的质量分数。
13.(2022•南通模拟)向某硫酸和硫酸铜的混合溶液中加入某浓度的氢氧化钠溶液,产生沉淀的质量与加入氢氧化钠溶液的质量关系如图所示。下列说法错误的是( )
A.a点溶液中滴入紫色石蕊试液变红
B.bc段(不含b点)反应的化学方程为CuSO4+2NaOH═Cu(OH)2↓+Na2SO4
C.整个变化过程中硫酸根离子数目没有改变
D.d点溶液中含有两种溶质
【考点】碱的化学性质.
【专题】常见的碱 碱的通性.
【答案】D
【分析】根据向某硫酸和硫酸铜的混合溶液中加入某浓度的氢氧化钠溶液,产生沉淀的质量与加入氢氧化钠溶液的质量关系图,一开始没有产生沉淀,说明是先与硫酸反应,再与硫酸铜反应,进行分析判断。
【解答】解:A、a点时发生的是氢氧化钠与硫酸的反应,硫酸有剩余,显酸性,溶液中滴入紫色石蕊试液变红,故选项说法正确。
B、bc段(不含b点)反应的化学方程为CuSO4+2NaOH═Cu(OH)2↓+Na2SO4,故选项说法正确。
C、硫酸与氢氧化钠反应生成硫酸钠和水,硫酸铜与氢氧化钠反应生成氢氧化铜沉淀和硫酸钠,整个变化过程中硫酸根离子数目没有改变,故选项说法正确。
D、d点氢氧化钠与硫酸铜恰好完全反应,溶液中含有硫酸钠一种溶质,故选项说法错误。
故选:D。
【点评】本题难度不大,明确图象一开始没有产生沉淀的含义是正确解答本题的关键。
14.(2022•常熟市校级二模)中和反应在工农业生产和日常生活中有广泛的用途,下列应用一定与中和反应原理无关的是( )
A.服用含Al(OH)3的药物治疗胃酸过量
B.使用熟石灰改良酸性土壤
C.用熟石灰和硫酸铜配制波尔多液
D.用氢氧化钠溶液洗涤石油产品中的残余硫酸
【考点】中和反应及其应用;酸碱盐的应用.
【专题】课本知识同类信息;化学与生活.
【答案】C
【分析】中和反应就是酸和碱的反应,可以从中和反应的实质进行分析,根据选项给出的物质类别即可作出判断.
【解答】解:A、氢氧化铝属于碱,胃酸的成分主要是盐酸,属于酸和碱的反应,故A与中和反应原理有关;
B、熟石灰为氢氧化钙,属于碱,用于改良酸性土壤属于酸和碱的反应,故B与中和反应原理有关;
C、熟石灰为氢氧化钙,属于碱,硫酸铜属于盐,氢氧化钙与硫酸铜的反应不是中和反应,故C与中和反应原理无关;
D、氢氧化钠属于碱,硫酸属于酸,氢氧化钠与硫酸的反应属于中和反应,故D与中和反应原理有关,
故选:C。
【点评】本题考查了中和反应的实质,可以从中和反应的定义进行分析,因此在平时的学习中熟练掌握有关的定义对于完成概念型习题有很大的帮助.
15.(2023•玄武区一模)某兴趣小组取三份相同体积相同浓度的氢氧化钠溶液,分别滴入两滴无色酚酞溶液,再以相同的速度同时滴加不同浓度的盐酸,得到溶液的pH随时间变化的曲线如图所示。下列说法正确的是( )
A.在a、b、c三种曲线所示的实验中,所用盐酸的浓度由大到小的顺序为c>b>a
B.在a曲线所示的实验中,图中A点所示溶液中,所含的溶质只有NaOH
C.在a、b、c三种曲线所示的实验中,溶液红色最先褪去的是c
D.在a、b、c三种曲线所示的实验中,20min时溶液的酸性由强到弱的顺序是a>b>c
【考点】溶液的酸碱性与pH的关系.
【专题】常见的酸 酸的通性.
【答案】D
【分析】A、根据溶液pH的变化情况来分析;
B、根据溶液的pH判断其中的溶质;
C、根据pH曲线来分析;
D、根据pH与酸碱性的关系来分析。
【解答】解:A、在a、b、c三种曲线所示的实验中,所用盐酸的浓度由大到小的顺序为a>b>c(反应需要时间依次增大),说法错误;
B、在a曲线所示的实验中,图中A点所示溶液的pH大于7,说明氢氧化钠有剩余,则其中所含的溶质有NaCl和NaOH,说法错误;
C、在a、b、c三种曲线所示的实验中,所用盐酸的浓度由大到小的顺序为a>b>c(反应需要时间依次增大),溶液红色最先褪去的是a(浓度最大),说法错误;
D、在a、b、c三种曲线所示的实验中,20min时溶液的酸性由强到弱的顺序是a>b>c,因为此时三种溶液的pH:a<b<c,pH越小,溶液的酸性越强,说法正确。
故选:D。
【点评】本题难度不是很大,主要考查了中和反应及其应用,掌握溶液的酸碱性和溶液pH大小之间的关系、从数形结合的角度理解中和反应是正确解答本题的关键。
16.(2023•润州区二模)烧杯中盛有4.0gMgO,向其中遂滴滴加100.0g稀硫酸,然后再在溶液中滴加Ba(OH)2溶液,产生沉淀的质量与滴加的溶液质量关系如图所示。下列说法正确的是( )
A.a点对应的溶液中有1种溶质
B.b点对应的固体中有Mg(OH)2和BaSO4
C.m=2.33
D.H2SO4在原溶液中的溶质质量分数为11.78%
【考点】碱的化学性质;根据化学反应方程式的计算;有关溶质质量分数的简单计算.
【专题】常见的碱 碱的通性.
【答案】C
【分析】A、根据氧化镁能与硫酸反应生成硫酸镁和水,进行分析。
B、根据氢氧化钡先与过量的硫酸反应生成硫酸钡沉淀和水,后与硫酸镁反应生成氢氧化镁沉淀和硫酸钡沉淀,进行分析。
C、根据化学方程式的计算,进行分析。
D、根据化学反应,物质之间的关系,进行分析。
【解答】解:A、烧杯中含有氧化镁,氧化镁能与硫酸反应生成硫酸镁和水,而a点时表示所加稀硫酸已过量,则溶液中的溶质为硫酸镁和硫酸两种溶质,故A不正确;
B、滴加氢氧化钡,氢氧化钡先与过量的硫酸反应生成硫酸钡沉淀和水,后与硫酸镁反应生成氢氧化镁沉淀和硫酸钡沉淀,则b点时对应的固体只有硫酸钡,故B不正确;
C、设氧化镁与硫酸反应时,生成的硫酸镁的质量为x,则:
MgO+H2SO4=MgSO4+H2O
40 120
4.0g x
解得x=12g
设硫酸镁和氢氧化钡反应时,生成的氢氧化镁和硫酸钡的沉淀分别为y、z,则:
、
解得y=5.8g、z=23.3g
则m的质量为31.43g﹣5.8g﹣23.3g=2.33g,故C正确;
D、由于生成的硫酸钡的沉淀为31.43g﹣5.8g=25.63g,设硫酸溶液中溶质质量为a,则
解得a=10.78g,
则H2SO4在原溶液中的溶质质量分数为,故D不正确。
故选:C。
【点评】本题主要考查碱的化学性质等,注意完成此题,可以从题干中抽取有用的信息,结合已有的知识进行解题。
17.(2023•建邺区校级二模)中和反应是一类重要的化学反应,兴趣小组利用图1研究稀盐酸与氢氧化钠溶液反应的过程,并用pH和电导率传感器测定反应过程中pH和电导率的变化(如图2和图3)下列说法正确的是( )
A.图1中滴加的a溶液为稀盐酸
B.图2中b→c能证明稀盐酸和氢氧化钠溶液发生了化学反应
C.图2中d→e所示溶液中的NaCl的质量不断增加
D.图3中90s之前电导离下降是因为溶液中的离子数量逐渐减少
【考点】中和反应及其应用;溶液的酸碱性与pH的关系.
【专题】常见的酸 酸的通性.
【答案】A
【分析】A、根据图像中pH的变化是从大于7逐渐减小到小于7,进行分析判断。
B、根据b→c,溶液放入pH逐渐减小,但是仍然是大于7,进行分析判断。
C、根据d点溶液的pH等于7,进行分析判断。
D、根据图3中90s时电导率最低,进行分析判断。
【解答】解:A、由图像可知,pH是开始时大于7逐渐减小到7然后小于7,可知原溶液显碱性,然后不断的加入酸性溶液,使pH减小,说明是把稀盐酸滴加到氢氧化钠溶液中,即图1中滴加的a溶液为稀盐酸,故选项说法正确。
B、图2中b→c,溶液放入pH逐渐减小,但是仍然是大于7,溶液的pH减小无法证明稀盐酸和氢氧化钠溶液发生了化学反应,可能是加入稀盐酸后,氢氧化钠溶液被稀释的原因,故选项说法错误。
C、图2中d点溶液的pH等于7,稀盐酸和氢氧化钠恰好完全反应;c→d所示溶液中,是恰好完全反应后继续滴加稀盐酸,稀盐酸过量,此阶段氯化钠的质量不会增加,故选项说法错误。
D、图3中90s时电导率最低,表示氢氧化钠与盐酸恰好完全反应;90s之前,为氢氧化钠和稀盐酸反应生成氯化钠和水,有水生成,离子的浓度减小,电导率下降,不是因为离子的数量减少,故选项说法错误。
故选:A。
【点评】本题难度不是很大,主要考查了中和反应及其应用,掌握溶液的酸碱性和溶液pH大小之间的关系、从数形结合的角度理解中和反应是正确解答本题的关键。
18.(2021•太仓市模拟)将一定量的氢氧化钠溶液与稀盐酸混合,二者恰好完全反应的微观示意图如图。由此分析下列说法正确的是( )
A.反应前后阴、阳离子的总数目不变
B.反应前后溶剂质量不变
C.反应后溶液呈中性
D.反应前后元素种类发生了变化
【考点】中和反应及其应用.
【专题】元素与化合物;常见的酸 酸的通性.
【答案】C
【分析】由将一定量的氢氧化钠溶液与稀盐酸混合,二者恰好完全反应的微观示意图,可以看出,反应的实质是氢离子和氢氧根离子结合生成水分子,进行分析判断。
【解答】解:A、由二者恰好完全反应的微观示意图,可以看出,反应的实质是氢离子和氢氧根离子结合生成水分子,反应前后阴、阳离子的总数目减少,故选项说法错误。
B、由二者恰好完全反应的微观示意图,可以看出,反应的实质是氢离子和氢氧根离子结合生成水分子,反应后溶剂质量增加,故选项说法错误。
C、由二者恰好完全反应的微观示意图,可以看出,反应的实质是氢离子和氢氧根离子结合生成水分子,反应后溶液为氯化钠溶液,呈中性,故选项说法正确。
D、化学反应前后元素种类不变,故选项说法错误。
故选:C。
【点评】本题难度不大,掌握中和反应的实质(氢离子和氢氧根离子结合生成水分子)是正确解答本题的关键。
19.(2023•京口区校级模拟)烧杯中盛有8.0gCuO,向其中逐滴滴加100.0g稀硫酸,然后再在溶液中滴加Ba(OH)2溶液,产生沉淀的质量与滴加的溶液质量关系如图所示。下列说法正确的是( )
A.a点对应的溶液中有2种溶质
B.b点对应的固体中有Cu(OH)2和BaSO4
C.H2SO4在原溶液中的溶质质量分数为14.7%
D.m=37.76
【考点】碱的化学性质;根据化学反应方程式的计算;有关溶质质量分数的简单计算.
【专题】常见的碱 碱的通性.
【答案】D
【分析】根据氧化铜和硫酸反应生成硫酸铜和水,硫酸根离子和钡离子反应生成不溶于酸的硫酸钡沉淀,氢氧根离子和铜离子反应生成溶于酸的氢氧化铜沉淀,然后结合图象中的数据进行分析计算。
【解答】解:A、氧化铜与稀硫酸反应生成硫酸铜和水,a点不溶固体的质量为零,氧化铜有剩余,a点对应溶液中有硫酸铜1种溶质,故A错误;
B、b点是剩余的硫酸的与氢氧化钡反应生成硫酸钡和水,且到c点时硫酸才被消耗完毕,因此b点只发生硫酸与氢氧化钡的反应,此时固体为硫酸钡,故B错误;
C、与氧化铜反应硫酸质量为z。
CuO+H2SO4=CuSO4+H2O
80 98
8g z
=
z=9.8g
另外剩余硫酸与氢氧化钡反应,生成了4.66g硫酸钡,设此时消耗硫酸质量为w。
H2SO4+Ba(OH)2=BaSO4↓+2H2O
98 233
w 4.66g
=
w=1.96g
所以硫酸质量=1.96g+9.8g=11.76g,硫酸质量分数=×100%=11.76%,故C错误;
D、设生成硫酸铜质量为n,硫酸铜与氢氧化钡反应生成硫酸钡的质量为x,生成氢氧化镁质量为y。
CuO+H2SO4=CuSO4+H2O
80 160
8g n
=
n=16g
CuSO4+Ba(OH)2=BaSO4↓+Cu(OH)2↓
160 233 98
16g x y
=
x=23.3g
=
y=9.8g
所以此时m=23.3g+9.8g+4.66g=37.76g,故D正确。
故选:D。
【点评】本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。
20.(2023•高新区校级二模)溶液的酸碱性也会影响难溶物的溶解性,下列难溶物在一定量水中的溶解量会随pH降低而增加的是( )
A.AuB.AgClC.BaSO4D.Mg(OH)2
【考点】溶液的酸碱性与pH的关系.
【专题】常见的酸 酸的通性.
【答案】D
【分析】根据题意,难溶物在一定量水中的溶解量会随pH降低而增加,即随着酸性的增强,难溶物能溶解在酸性溶液中,进行分析判断。
【解答】解:A、Au难溶于水,也不溶于酸,溶解量不会随pH降低而改变,故选项错误。
B、AgCl难溶于水,也不溶于酸,溶解量不会随pH降低而改变,故选项错误。
C、BaSO4难溶于水,也不溶于酸,溶解量不会随pH降低而改变,故选项错误。
D、Mg(OH)2难溶于水,但溶于酸,在一定量水中的溶解量会随着pH降低而增加,故选项正确。
故选:D。
【点评】本题难度不大,明确难溶物在一定量水中的溶解量会随pH降低而增加的条件是正确解答本题的关键。
二.填空题(共3小题)
21.(2023•淮阴区二模)2022年北京冬奥会是一届绿色奥运、科技奥运、人文奥运,真是惊艳世界!
(1)冬奥会火炬“飞扬”采用氢气作燃料,体现了绿色奥运的理念,关闭火炬的燃气开关,使火炬熄灭,采用的灭火原理是 撤离可燃物,与火源隔离 ;
(2)冬奥会速滑场馆“冰丝带”采用的是CO2跨临界直冷制冰。
①对CO2气体加压、降温,可得到干冰,从构成物质微粒角度分析,该过程主要改变的是分子的 间隔 (填“种类”或“间隔”)。
②捕集、利用和封存是实现碳中和的一种途径。如图是利用氢氧化钠溶液吸收CO2的部分转化关系图。
反应Ⅰ的化学方程式为 CO2+2NaOH=Na2CO3+H2O ,该转化中可以循环利用的物质是 NaOH (填化学式)。
【考点】碱的化学性质;分子的定义与分子的特性;灭火的原理和方法.
【专题】化学与能源;常见的碱 碱的通性.
【答案】(1)撤离可燃物,与火源隔离。
(2)间隔;CO2+2NaOH=Na2CO3+H2O;NaOH。
【分析】(1)燃烧的条件:可燃物,可燃物与氧气接触,温度达到可燃物的着火点,三者必须同时具备,缺一不可。 (1)微观粒子之间有间隔。
氢氧化钠和二氧化碳反应生成碳酸钠和水。
【解答】解:(1)关闭火炬的燃气开关,使火炬熄灭,采用的灭火原理是撤离可燃物,与火源隔离;
(2)①对CO2气体加压、降温,可得到干冰,状态改变,主要改变的是分子的间隔,没有生成新物质,分子种类不变;
②反应I是氢氧化钠和二氧化碳反应生成碳酸钠和水,反应的化学方程式为:CO2+2NaOH=Na2CO3+H2O;反应I中氢氧化钠参加反应,反应Ⅱ中碳酸钠和氢氧化钙反应生成碳酸钙和氢氧化钠,故该转化中可以循环利用的物质是氢氧化钠,化学式为NaOH。
故答案为:(1)撤离可燃物,与火源隔离。
(2)间隔;CO2+2NaOH=Na2CO3+H2O;NaOH。
【点评】灭火的方法有:移走可燃物,隔绝氧气,降低温度到可燃物的着火点以下。
22.(2023•姑苏区校级一模)硫酸是初中常用的化学试剂。
(1)①现将100mL溶质质量分数为98%的浓硫酸(密度为1.84g•mL﹣1)和500mL蒸馏水混合,充分搅拌后,得到稀硫酸的溶质质量分数为 26.4% (结果精确到0.1%)。
②如果少量浓硫酸沾到皮肤或衣物上,必须迅速用 大量水冲洗 ,再涂上碳酸氢钠溶液(3%~5%)。碳酸氢钠与硫酸反应的化学方程式为 2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑ 。
(2)①Ba(OH)2溶液中有较多能自由移动的阳离子是 Ba2+ (填离子符号)。
②分别用pH和溶液电导率(表示溶液传导电流的能力)传感器对Ba(OH)2溶液与稀硫酸反应进行探究,测定结果见图1和图2。下列说法中正确的是 ABC (填字母)。
A.由如图1可知,实验是向稀Ba(OH)2溶液中滴入稀硫酸
B.图2中0s~6s,说明溶液中有带电离子
C.如图2中6s~30s,电导率下降是因为带电离子的数目减少
D.M点和N点均表示Ba(OH)2和H2SO4恰好完全反应
【考点】中和反应及其应用;溶液的酸碱性与pH的关系;书写化学方程式、文字表达式、电离方程式;有关溶质质量分数的简单计算.
【专题】常见的酸 酸的通性.
【答案】(1)①26.4%;
②大量水冲洗;2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑;
(2)①Ba2+;
②ABC。
【分析】(1)根据溶液在加水稀释过程中溶质的质量不变,如果少量浓硫酸沾到皮肤或衣物上,必须迅速用大量水冲洗,再涂上碳酸氢钠溶液进行分析;
(2)根据Ba(OH)2溶液中有较多能自由移动的阳离子是钡离子,pH是开始时大于7逐渐减小到7然后小于7,可知原溶液显碱性,然后不断的加入酸性溶液,使pH减小,溶液电导率表示溶液传导电流的能力,硫酸和氢氧化钡溶液反应生成硫酸钡沉淀和水,进行分析。
【解答】解:(1)①溶液在加水稀释过程中溶质的质量不变,则有:稀硫酸的溶质质量分数=;
②如果少量浓硫酸沾到皮肤或衣物上,必须迅速用大量水冲洗,再涂上碳酸氢钠溶液(3%~5%)。碳酸氢钠与硫酸反应生成硫酸钠、水和二氧化碳,反应的化学方程式为:2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑;
(2)①Ba(OH)2溶液中有较多能自由移动的阳离子是钡离子,其离子符号为Ba2+;
②A、由图像可知,pH是开始时大于7逐渐减小到7然后小于7,可知原溶液显碱性,然后不断的加入酸性溶液,使pH减小,说明向稀Ba(OH)2溶液中滴入稀硫酸,说法正确;
B、溶液电导率表示溶液传导电流的能力,图2中0s~6s,电导率几乎不变,说明溶液中有带电离子,说法正确;
C、图2中6s~30s,电导率下降是因为带电离子的数目减少,说法正确;
D、硫酸和氢氧化钡溶液反应生成硫酸钡沉淀和水,恰好完全反应时溶液的pH=7,溶液的电导率为0,N点不能表示Ba(OH)2和H2SO4恰好完全反应,说法错误。
故选ABC。
故答案为:(1)①26.4%;
②大量水冲洗;2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑;
(2)①Ba2+;
②ABC。
【点评】本题主要考查中和反应及其应用等,注意完成此题,可以从题干中抽取有用的信息,结合已有的知识进行解题。
23.(2023•江宁区二模)通过物质的共性和差异性认识物质是学习化学的一种思路与方法。
Ⅰ.图1以稀盐酸为例的反应关系体现了酸的化学性质。
(1)反应①中石蕊溶液变为 红 色。
(2)从微观角度分析,反应③的实质是 氢离子和氢氧根离子结合成水分子 。
(3)反应⑤的化学方程式为 Fe2O3+6HCl=2FeCl3+3H2O 。
(4)Na2CO3溶液不仅能和稀盐酸反应,还能和其他酸以及某些碱或盐发生复分解反应。
下列物质中能和Na2CO3溶液发生复分解反应且产生沉淀的是 AC (填字母)。
A.BaCl2溶液
B.H2SO4溶液
C.Ca(OH)2溶液
D.KNO3溶液
Ⅱ.基于微观视角探究酸化学性质的相似性和差异性。
(1)分别向稀盐酸和稀硫酸加入经打磨的镁条,都会迅速产生大量气泡,从微观角度分析产生相同现象的原因是:稀盐酸和稀硫酸中都含有 H+ (填符号)。
(2)分别向稀盐酸和稀硫酸加入Ba(NO3)2溶液,可观察到稀硫酸中出现白色沉淀,有关反应的化学方程式为 H2SO4+Ba(NO3)2=BaSO4↓+2HNO3 ,而稀盐酸中没有出现浑浊。从微观角度分析二者性质差异的原因是 酸根离子不同 。
(3)某物质溶于水时解离情况如图2所示,预测下列物质中能与该溶液发生化学反应的有 ABCD (填字母)。
A.NaHCO3溶液
B.锌粒
C.KOH溶液
D.BaCl2溶液
Ⅲ.向某浓度Na2CO3溶液中逐滴加入稀盐酸时,溶液中含碳元素的3种微粒数随盐酸体积的变化情况如图所示(CO2因逸出而忽略)。
(1)图中OB段反应的化学方程式为 Na2CO3+HCl=NaHCO3+NaCl 。
(2)图中A点所示溶液中的溶质有 Na2CO3、NaHCO3、NaCl (写化学式)。
【考点】酸的化学性质.
【专题】常见的酸 酸的通性.
【答案】Ⅰ、(1)红;
(2)氢离子和氢氧根离子结合成水分子;
(3)Fe2O3+6HCl=2FeCl3+3H2O;
(4)AC;
Ⅱ、(1)H+;
(2)H2SO4+Ba(NO3)2=BaSO4↓+2HNO3;酸根离子不同;
(3)ABCD;
Ⅲ、(1)Na2CO3+HCl=NaHCO3+NaCl;
(2)Na2CO3、NaHCO3、NaCl;
【分析】Ⅰ、(1)根据盐酸能使紫色石蕊溶液变红来分析解答;
(2)根据氢氧化钠溶液与稀盐酸反应的实质来分析解答;
(3)根据稀盐酸与氧化铁反应生成氯化铁和水来分析解答;
(4)根据复分解的概念和有沉淀生成来分析判断;
Ⅱ、(1)根据酸溶液中都有氢离子来分析解答;
(2)根据稀硫酸和Ba(NO3)2溶液反应生成硫酸钡沉淀和硝酸来分析解答;根据酸根离子不同来分析解答;
(3)根据硫酸氢钠水溶液中有钠离子、氢离子、硫酸根离子,所以该溶液同时具备三种离子的性质来分析解答;
Ⅲ、(1)根据图中OB段碳酸氢根离子逐渐增多,碳酸根离子逐渐减少,发生的反应为碳酸钠和稀盐酸反应生成碳酸氢钠和氯化钠来分析解答;
(2)根据图中A点是部分碳酸钠和盐酸反应生成碳酸氢钠和氯化钠来分析解答。
【解答】解:Ⅰ、(1)盐酸能使紫色石蕊溶液变红,故反应①中石蕊溶液变为红色;
(2)氢氧化钠溶液与稀盐酸反应生成氯化钠和水,从微观角度分析,反应的实质是氢离子和氢氧根离子结合成水分子;
(3)反应⑤是稀盐酸与氧化铁反应生成氯化铁和水,故反应⑤的化学方程式为Fe2O3+6HCl=2FeCl3+3H2O;
(4)A、BaCl2溶液和Na2CO3溶液反应生成碳酸钡沉淀和氯化钠,且该反应符合两种化合物互相交换成分生成另外两种化合物的反应,属于复分解反应且有沉淀生成,故A符合题意;
B、H2SO4溶液和Na2CO3溶液反应生成硫酸钠、二氧化碳和水,属于复分解反应,但无沉淀生成,故B不符合题意;
C、Ca(OH)2溶液和Na2CO3溶液反应生成碳酸钙沉淀和氢氧化钠,且该反应符合两种化合物互相交换成分生成另外两种化合物的反应,属于复分解反应且有沉淀生成,故C符合题意;
D、KNO3溶液和Na2CO3溶液不反应,故D不符合题意;
故选:AC。
Ⅱ、(1)分别向稀盐酸和稀硫酸加入经打磨的镁条,都会迅速产生大量气泡,从微观角度分析产生相同现象的原因是:稀盐酸和稀硫酸中都含有H+;
(2)稀硫酸和Ba(NO3)2溶液反应生成硫酸钡沉淀和硝酸,反应的化学方程式为H2SO4+Ba(NO3)2=BaSO4↓+2HNO3,稀硫酸中出现白色沉淀,而稀盐酸中没有出现浑浊,从微观角度分析二者性质差异的原因是酸根离子不同;
(3)硫酸氢钠水溶液中有钠离子、氢离子、硫酸根离子,所以该溶液同时具备三种离子的性质;
A、NaHCO3溶液碳酸氢根离子能与氢离子结合生成二氧化碳和水,则NaHCO3溶液能与该溶液反应,故A符合题意;
B、锌粒能与氢离子反应生成氢气,则锌粒能与该溶液反应,故B符合题意;
C、KOH溶液中的氢氧根离子能与氢离子结合生成水,则氢氧化钾能与该溶液反应,故C符合题意;
D.BaCl2溶液中的钡离子能与硫酸根离子结合生成硫酸钡沉淀,则BaCl2溶液能与该溶液反应,故D符合题意;
故选:ABCD。
Ⅲ、(1)图中OB段碳酸氢根离子逐渐增多,碳酸根离子逐渐减少,则发生的反应为碳酸钠和稀盐酸反应生成碳酸氢钠和氯化钠,反应的化学方程式为Na2CO3+HCl=NaHCO3+NaCl;
(2)图中A点是部分碳酸钠和盐酸反应生成碳酸氢钠和氯化钠,故此时溶液中的溶质是Na2CO3、NaHCO3、NaCl。
故答案为:Ⅰ、(1)红;
(2)氢离子和氢氧根离子结合成水分子;
(3)Fe2O3+6HCl=2FeCl3+3H2O;
(4)AC;
Ⅱ、(1)H+;
(2)H2SO4+Ba(NO3)2=BaSO4↓+2HNO3;酸根离子不同;
(3)ABCD;
Ⅲ、(1)Na2CO3+HCl=NaHCO3+NaCl;
(2)Na2CO3、NaHCO3、NaCl;
【点评】本题难度不是很大,主要考查了酸的性质,熟练掌握酸的化学性质是正确解答本题的关键。
三.实验题(共2小题)
24.(2023•惠山区校级三模)某化学兴趣小组对盐酸和氢氧化钠溶液发生的中和反应进行“可视化”探究,设计并完成以下实验(实验装置中夹持仪器已略去)。
【实验一】借助指示剂的颜色变化来判断。实验操作如图所示。
(1)证明中和反应发生的现象是 溶液由红色变成无色 ;写出该反应的化学方程式 HCl+NaOH=NaCl+H2O 。
【实验二】借助数字传感器,进行数据分析判断。用数字传感器测量稀盐酸与氢氧化钠溶液的反应,pH变化曲线和温度变化曲线如图所示。
(2)根据pH变化曲线,证明氢氧化钠溶液和盐酸反应的依据是 稀盐酸的体积为12mL时,溶液的pH=7或稀盐酸的体积>12mL,pH<7 。根据温度变化曲线可知,该反应 放热 (填“放热”或“吸热”)。M最接近的数据是 12 。(填“6”、“7”、“12”或“16”)
【考点】中和反应及其应用;溶液的酸碱性与pH的关系.
【专题】常见的酸 酸的通性.
【答案】(1)溶液由红色变成无色;HCl+NaOH=NaCl+H2O;
(2)稀盐酸的体积为12mL时,溶液的pH=7或稀盐酸的体积>12mL,pH<7;放热;12。
【分析】(1)根据指示剂的变色以及盐酸和氢氧化钠反应生成氯化钠和水分析;
(2)根据pH变化曲线、温度变化曲线分析。
【解答】解:(1)氢氧化钠溶液显碱性,使酚酞变红,加入稀盐酸,盐酸和氢氧化钠反应生成氯化钠和水,溶液由红色变为无色,说明反应发生;化学方程式为:HCl+NaOH=NaCl+H2O;
(2)根据pH变化曲线,氢氧化钠溶液显碱性,pH>7,加入稀盐酸的体积为12mL时,溶液的pH=7或稀盐酸的体积>12mL,pH<7,能证明氢氧化钠溶液和盐酸反应;根据温度变化曲线可知,该反应放热;加入稀盐酸的体积为MmL时,温度最高,说明氢氧化钠溶液和盐酸恰好完全反应,根据pH变化曲线,恰好完全反应时,稀盐酸的体积为12mL,所以M=12。
故答案为:(1)溶液由红色变成无色;HCl+NaOH=NaCl+H2O;
(2)稀盐酸的体积为12mL时,溶液的pH=7或稀盐酸的体积>12mL,pH<7;放热;12。
【点评】在解此类题时,首先要将题中的知识认知透,然后结合学过的知识进行解答。
25.(2023•溧阳市一模)酸碱中和反应是初中阶段重要的一类反应,请你参与一起探究。
【实验一】从能量变化角度探究酸和碱的反应
某小组同学测量盐酸与氢氧化钠溶液反应过程中温度的变化,观察到溶液温度升高,因此,得出两者能反应的结论。有同学认为此结论不够严谨,为此他在室温下设计了以下实验:
①10mL、20%的盐酸与10mL蒸馏水混合,测量溶液温度的变化。
②10mL、20%的氢氧化钠溶液与10mL蒸馏水混合,测量溶液温度的变化。
③10mL、20%的盐酸与10mL、20%的氢氧化钠溶液混合,测量溶液温度的变化。
用数字化实验技术测得3个实验中溶液温度随时间变化的关系如图所示。
(1)由如图可知,盐酸、氢氧化钠溶液稀释时均 放热 (填“放热”或“吸热”)。
(2)从微观角度分析,此中和反应的温度变化主要是由于 H+、OH﹣ (填离子符号)两种离子反应生成水,放出热量的缘故,由此说明氢氧化钠和盐酸发生了中和反应。
(3)在10mL溶质质量分数为10%NaOH溶液(密度为1.1g/mL)加入溶质质量分数为5%的盐酸(密度为1.0g/mL)的体积 20 mL(结果保留整数),就能使反应后溶液的pH等于7。
【实验二】从溶液电导率变化角度探究酸和碱的反应
小组同学根据如图进行相应实验操作,利用电导率传感器测定反应过程中溶液的电导率变化如图所示。已知:溶液电导率大小与溶液离子浓度成正比。
(4)如图也能说明氢氧化钠和盐酸发生了中和反应,写出图中试管中发生反应的化学方程式 NaOH+HCl=NaCl+H2O 。
(5)据图可确定NaOH与HCl恰好完全反应的点是 c (选填:“a”、“b”、“c”或“d”)。
(6)图中d点所示溶液中含有的离子有 Na+、Cl﹣、OH﹣ (填离子符号)。
【考点】中和反应及其应用.
【专题】常见的酸 酸的通性.
【答案】(1)放热;
(2)H+、OH﹣;
(3)20;
(4)NaOH+HCl=NaCl+H2O;
(5)c;
(6)Na+、Cl﹣、OH﹣。
【分析】(1)根据图像信息进行分析;
(2)根据中和反应的实质是氢离子和氢氧根离子反应生成了水分子进行分析;
(3)根据氢氧化钠和盐酸反应生成氯化钠和水,以及题中的数据进行分析;
(4)根据氢氧化钠和盐酸反应生成氯化钠和水进行分析;
(5)根据酸碱中和后溶液的电导率进行分析;
(6)根据图3中电导率的变化,说明溶液中的离子发生了变化,以及d点的导电率进行分析。
【解答】解:(1)由图1可知,盐酸、氢氧化钠溶液稀释时均放热;故答案为:放热;
(2)中和反应的实质是氢离子和氢氧根离子反应生成了水分子,从微观角度分析,此中和反应的温度变化主要是由于H+、OH﹣两种离子反应放出热量的缘故,由此说明氢氧化钠和盐酸发生了中和反应;故答案为:H+、OH﹣;
(3)10mL溶质质量分数为10%NaOH溶液(密度为1.1g/mL)中溶质的质量为10mL×1.1g/mL×10%=1.1g,设需要盐酸的体积为x。
NaOH+HCl=NaCl+H2O
40 36.5
1.1g x×1g/mL×5%
x≈20mL
在10mL溶质质量分数为10%NaOH溶液(密度为1.1g/mL)加入溶质质量分数为5%的盐酸(密度为1.0g/mL)的体积20mL,就能使反应后溶液的pH等于7;
故答案为:20;
(4)试管中的反应是氢氧化钠和盐酸反应生成氯化钠和水,化学方程式为NaOH+HCl=NaCl+H2O;故答案为:NaOH+HCl=NaCl+H2O;
(5)NaOH与HCl恰好完全反应时,溶液的电导率最低,即c点;故答案为:c;
(6)图中d点所示溶液中含有氯化钠和过量的氢氧化钠,则含有的离子有钠离子、氯离子和氢氧根离子;故答案为:Na+、Cl﹣、OH﹣。
【点评】合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础
空气 氧气---江苏三年(2021-2023)中考化学模拟题分类汇编: 这是一份空气 氧气---江苏三年(2021-2023)中考化学模拟题分类汇编,共42页。
化学与能源---江苏三年(2021-2023)中考化学模拟题分类汇编: 这是一份化学与能源---江苏三年(2021-2023)中考化学模拟题分类汇编,共39页。
常见的酸和碱---陕西三年(2021-2023)中考化学模拟题分类汇编: 这是一份常见的酸和碱---陕西三年(2021-2023)中考化学模拟题分类汇编,共41页。












