

高中化学苏教版 (2019)选择性必修1专题1 化学反应与能量第一单元 化学反应的热效应课后作业题
展开一、单选题
1.2021年5月15日,我国火星探测器“天问一号”成功着陆火星。据介绍,该火星车除装有光电转换效率较高的4块太阳电池板外,在其顶部还装有一个像双筒望远镜样子的设备,叫作集热窗,它可以直接吸收太阳能,然后利用一种叫作正十一烷的物质储存能量。白天,火星温度升高,这种物质吸热融化,到了晚上温度下降,这种物质在凝固的过程中释放热能。从上述资料中不能直接得出的结论是
A.“4块太阳电池板”可将光能转换成电能
B.“集热窗”可将光能转化成化学能储存在化学物质中
C.物质的融化和凝固伴随着能量的变化
D.“天问一号”的动力来源主要是太阳能和氢氧燃料电池
2.下列说法正确的是
A.焓变是指1ml物质参加反应时的能量变化
B.当反应放热时△H>0,反应吸热时△H<0
C.在加热条件下发生的反应均为吸热反应
D.一个化学反应中,当反应物能量大于生成物能量时△H为“﹣”
3.下列变化中属于吸热的化学反应的是
①液态水汽化 ②将胆矾加热变为白色粉末 ③浓硫酸稀释 ④氯酸钾分解制氧气 ⑤生石灰跟水反应生成熟石灰
A.①②B.②③C.①④⑤D.②④
4.下列关于反应热的表述正确的是
A.当△H<0时,表示该反应为吸热反应
B.需要加热才能进行的反应是吸热反应
C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关
D.1mlNaOH分别和1mlCH3COOH、1mlHNO3反应放出的热量:CH3COOH
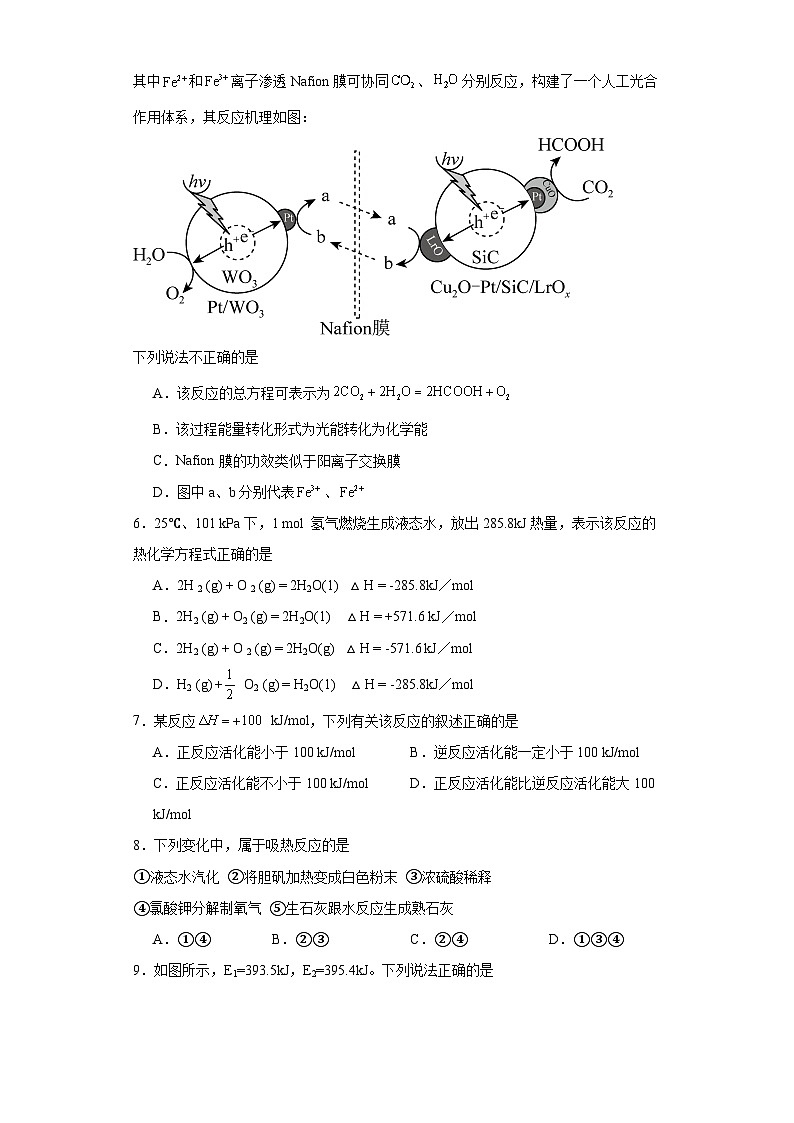
下列说法不正确的是
A.该反应的总方程可表示为
B.该过程能量转化形式为光能转化为化学能
C.Nafin膜的功效类似于阳离子交换膜
D.图中a、b分别代表、
6.25℃、101 kPa下,1 ml 氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是
A.2H 2 (g) + O 2 (g) = 2H2O(1) △ H = -285.8kJ/ml
B.2H2 (g) + O2 (g) = 2H2O(1) △ H = +571.6 kJ/ml
C.2H2 (g) + O 2 (g) = 2H2O(g) △ H = -571.6 kJ/ml
D.H2 (g) + O2 (g) = H2O(1) △ H = -285.8kJ/ml
7.某反应 kJ/ml,下列有关该反应的叙述正确的是
A.正反应活化能小于100 kJ/mlB.逆反应活化能一定小于100 kJ/ml
C.正反应活化能不小于100 kJ/mlD.正反应活化能比逆反应活化能大100 kJ/ml
8.下列变化中,属于吸热反应的是
①液态水汽化 ②将胆矾加热变成白色粉末 ③浓硫酸稀释
④氯酸钾分解制氧气 ⑤生石灰跟水反应生成熟石灰
A.①④B.②③C.②④D.①③④
9.如图所示,E1=393.5kJ,E2=395.4kJ。下列说法正确的是
A.石墨转化为金刚石为放热反应
B.石墨与金刚石之间的转化是物理变化
C.石墨的稳定性强于金刚石
D.金刚石和氧气生成二氧化碳的反应放热,1ml金刚石的能量一定大于1ml二氧化碳的能量
10.下列化工生产原理、用途错误的是
①制取粗硅的反应原理:SiO2+CSi+CO2↑
②工业上一般以硫磺或其他含硫矿物(硫铁矿)为原料制备硫酸
③炼铁高炉中所发生的反应均是放热的,故无需加热
④可以用电解熔融氯化镁的方法来制取镁
⑤工业上冶炼Ag:2Ag2O4Ag+O2↑
A.①③B.①④C.②③D.④⑤
二、填空题
11.如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10mL盐酸于试管中,试回答下列问题:
(1)实验中观察到的现象是 。
(2)产生上述现象的原因是 。
(3)写出有关反应的离子方程式: ;反应中转移了0.04ml电子时;标准状况下产生多少 mL的H2;生成的MgCl2物质的量浓度为 。(溶液体积保持不变)
(4)由实验推知,镁片和盐酸的总能量 (填“大于”、“小于”或“等于”)MgCl2溶液和H2的总能量;此反应为 (填放热反应或者吸热反应)。
12.能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率。请回答下列问题。
(1)氢气在O2中燃烧的反应是 (填“放”或“吸”)热反应,这是由于反应物的总能量 (填“大于”、“小于”或“等于”)生成物的总能量。
(2)从化学反应的本质角度来看,氢气的燃烧是由于断裂反应物中的化学键吸收的总能量 (填“大于”、“小于”或“等于”)形成产物的化学键放出的总能量。已知破坏1 ml H—H键、1 ml O=O键、1 ml H—O键时分别需要吸收a kJ、b kJ、c kJ的能量。则2 ml H2(g)和1 ml O2(g)转化为2 ml H2O(g)时放出的热量为 。
13.回答下列问题:
(1)火箭发射时可用肼(,液态)作燃料,液态肼与反应生成和水蒸气。有关该反应的能量变化曲线如图所示,写出该反应的热化学方程式: 。
(2)液态肼可与氧化剂反应生成和水蒸气。已知:
①
②
③
写出液态肼和反应生成和水蒸气的热化学方程式: 。
14.写出下列反应的热化学方程式:
(1)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101KPa下,已知该反应每消耗1mlCuCl(s),放热44.4kJ,该反应的热化学方程式是 。
(2)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:
在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式: 。
(3)化合物AX3和单质X2在一定条件下反应可生成化合物AX5.已知AX3的熔点和沸点分别为-93.6℃和76℃,AX5的熔点为167℃。室温时AX3与气体X2反应生成lmlAX5,放出热量123.8kJ。该反应的热化学方程式为 。
15.焓与焓变
(1)焓(H):是一个与内能有关的 。
(2)焓变(△H):在恒压下,化学反应过程中 的热量称为该反应的焓变。常用单位kJ/ml或kJ·ml-1.
(3)反应热与焓变的关系
在 条件下进行的化学反应的反应热等于反应的 ,因此常用 表示反应热。
(4)焓变与吸热反应和放热反应的关系
①放热反应:反应体系向环境 能量,反应体系的焓 ,ΔH为负值,即ΔH<0。
②吸热反应:反应体系从环境中 能量,反应体系的焓 ,ΔH为正值,即ΔH>0。
16.在25℃、101kPa的条件下。
(1)由,当生成时,要 (填“吸收”或“放出”)436kJ的能量;由,当断裂中的共价键时,要 (填“吸收”或“放出”)243kJ的能量。
(2)对于反应,测得生成时,反应过程中放出183kJ的热量,则断开1ml H—Cl键所需的能量是 kJ。
(3)两个反应:a.,b.。这两个反应的能量转化方式主要是 能转化为 能。
17.请根据要求书写出方程式。
(1)NO2与水形成酸雨的化学方程式为 。
(2)1754年,Briestly用硵砂(主要成分NH4Cl)和熟石灰共热制得了氨,化学反应方程式为 。
(3)可利用CH4等气体除去烟气中的氮氧化物,生成物为可参与大气循环的气体,请写出CH4与NO反应的化学方程式 。
(4)卫星发射时可用液态肼(N2H4)作燃料,16gN2H4(l)在氧气(g)中燃烧,生成氮气(g)和水蒸气,共放出255kJ热量。请写出该反应的热化学方程式 。
18.写出下列反应的热化学方程式
(1)1ml(g)在中完全燃烧生成和液态水,放出1299.6kJ的热量 。
(2)23g(l)在中完全燃烧生成和液态水,放出683.4kJ的热量 。
19.已知H—H键的键能为436 kJ·ml-1,Cl—Cl键的键能为243 kJ·ml-1,H—Cl键的键能为431 kJ·ml-1,则H2(g) +Cl2(g)=2HCl(g)的反应热为 。
20.下表中的数据是破坏1 ml物质中的化学键所消耗的能量(kJ):
(1)下列物质本身具有的能量最低的是( )
A.H2B.Cl2C.Br2D.I2
(2)下列氢化物中,最稳定的是( )
A.HClB.HBrC.HI
(3)X2+H2=2HX(X代表Cl、Br、I)的反应是吸热反应还是放热反应? 。
(4)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是 。
三、实验探究题
21.现有A、B、C、D、E五种物质,并存在如下转化关系,其中E 为黑色粉末。
I、利用右图所示的实验装置进行C 与水的反应,回答下列有关问题:
(1)在实验前首先 如何操作 将分液漏斗中的水滴入试管,然后:
①在导管口处进行适当操作,观察现象。
②观察烧杯中的现象为: 。根据所观察现象可得到的两个结论是 、 。
③写出试管中反应的化学方程式 。
(2) 已知水与C 反应生成D及另一种化合物F,在通常状况下,足量F的稀溶液与含溶质为1ml 的稀盐酸完全反应时放出a kJ的热量,请写出该反应的热化学方程式 。
II.在加热条件下,某无氧酸(含有A 中的一种元素) 的浓溶液与E 反应,生成单质气体X。为检验X 的性质,设计如下图所示实验装置:
(1)请写出此实验中制备单质气体X 的离子反应方程式 。
(2)实验过程中,观察到装置III中品红试纸的红色褪去,并未观察到“无明显变化”这一预期现象。为了达到这一预期现象,你认为应该如何改进? 。
(3)实验结束后,装置IV中可观察到现象是 ,若滴加两滴胶头滴管中的试剂,观察到溶液呈红色,胶头滴管中的试剂为: 。
22.为了探究化学能与热能的转化,某实验小组设计了如图所示三套实验装置:
(1)上述3个装置中,不能用于探究“镁与稀盐酸反应是吸热反应还是放热反应”的是 (选填“I”、“II”或“III”)。:
(2)某同学选用装置I进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡溶液与稀硫酸,U形管中可观察到的现象是 ,说明该反应属于 (选填“吸热”或“放热”)反应。
(3)为探究固体M溶于水的热效应,选择装置II进行实验(在甲试管中进行)。
①若M为钠,则实验过程中烧杯中可观察到的现象是 。
②若观察到烧杯里产生气泡,则说明M溶于水 (选填“一定是放热反应”、“一定是吸热反应”或“可能是放热反应”);
③若实验过程中观察到烧杯里的导管内形成一段水柱,则M可能是 。
(4)至少有两种实验方法能证明超氧化钾与水的反应(4KO2+2H2O=4KOH+3O2↑)是放热反应还是吸热反应。
方法①:选择上述装置 进行实验;
方法②:取适量超氧化钾粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到棉花燃烧,则说明该反应是 (选填“吸热”或“放热”)反应。
23.如图是某同学设计的放热反应的观察装置,其实验操作步骤如下:
①按图所示将实验装置连接好;
②在U形管内加入少量红墨水(或品红溶液),
打开T形管活塞,使U形管内两边的液面处于同一水平面,再关闭T形管活塞;
③在盛有1.0g氧化钙的小试管里滴入2mL左右的蒸馏水,观察现象。
试回答:
(1)实验前必须进行的一步实验操作是 。
(2)实验中观察到的现象是 。
(3)若该实验中CaO换成NaCl,实验还能否观察到相同现象? 。(填“能”或“否”)
物质
Cl2
Br2
I2
HCl
HBr
HI
H2
能量(kJ)
243
193
151
431
366
298
436
参考答案:
1.D
【详解】A.“4块太阳电池板”可吸收光能,将光能转换成电能,A正确;
B.集热窗可以直接吸收太阳能,然后利用一种叫作正十一烷的物质储存能量,这说明“集热窗”可将光能转化成化学能储存在化学物质中,B正确;
C.物质的融化吸热,凝固放热,因此都伴随着能量的变化,C正确;
D.根据已知信息无法得出“天问一号”的动力来源主要是太阳能和氢氧燃料电池这一结论,D错误;
答案选D。
2.D
【详解】A.焓变与反应物的状态、反应物的物质的量、反应温度及压强有关,反应物的量越多则焓变值越大,A错误;
B.当反应放热时ΔH<0,反应吸热时ΔH>0,B错误;
C.反应的焓变与反应的条件是否加热没有直接关系,加热条件下发生的反应不一定是吸热反应,C错误;
D.一个化学反应中,当反应物的总能量大于生成物的总能量时,反应放热,ΔH为负值,反之是吸热,ΔH为正值,D正确;
答案选D。
3.D
【详解】①液态水汽化是吸热过程,不是化学反应,故不选①;
②将胆矾(CuSO4 ∙ 5H2O)加热,发生分解反应,大多数的分解反应是吸热反应,故选②;
③浓硫酸稀释放出大量的热,为放热过程,故不选③;
④氯酸钾分解制氧气 ,是分解反应,需要吸收热量,属于吸热反应,故选④;
⑤生石灰与水反应放出大量热,属于放热反应,故不选⑤;
故正确序号为②④。综上所述,本题正确答案为D。
【点睛】注意液态水汽化是吸热过程,不是吸热反应。
4.D
【详解】A.当△H<0时,表示该反应为放热反应,A错误;
B.需要加热才能进行的反应不一定是吸热反应,例如木炭燃烧,B错误;
C.反应热的大小与反应物所具有的能量和生成物所具有的能量有关,C错误;
D.醋酸电离吸热,则1mlNaOH分别和1mlCH3COOH、1mlHNO3反应放出的热量:CH3COOH
5.D
【详解】A.据图可知,初始反应物有H2O和CO2,最终产物为HCOOH和O2,根据电子守恒和元素守恒可得总反应为,A项正确;
B.据图可知该反应在光照的条件下进行反应,将光能转化为化学能,B项正确;
C.和离子渗透Nafin膜可协同、分别反应,Nafin膜可允许阳离子通过,其功效类似于阳离子交换膜,C项正确;
D.H2O失电子后转化为O2,所以b得电子被还原转化为a,则a为Fe2+、b为Fe3+,D项错误;
答案选D。
6.D
【详解】放出热量说明反应热△H<0,2g氢气燃烧生成液态水,放出285.8kJ热量,说明消耗1mlH2,放出285.8 kJ/ml;
A.2mlH2生成2ml液体水,放出的热量为,A错误;
B.2mlH2生成2ml液体水,为放热反应,B错误;
C.2mlH2生成2ml气态水,放出的热量大于571.6kJ/ml,C错误;
D.1mlH2生成1ml气态水,放出的热量285.8kJ/ml,D正确;
故选项D正确。
7.D
【详解】A.反应热=正反应活化能-逆反应活化能,该反应的反应热为+100 kJ/ml,则正反应活化能大于100kJ/ml,A项错误;
B.根据A选项分析,逆反应活化能可能小于100kJ/ml,B项错误;
C.正反应活化能大于100kJ/ml,C项错误;
D.题中焓为正值,正反应活化能比逆反应活化能大,D项正确;
答案选D。
8.C
【详解】①液态水汽化,即水由液态到气态需要吸热,但是物理变化过程,故①错误;②胆矾加热失去结晶水变成白色粉末,需要吸热,故②正确;③浓硫酸稀释放出大量的热,故③错误;④氯酸钾分解需要吸热,故④正确;⑤生石灰跟水反应生成熟石灰会放出大量的热,故⑤错误;故选C。
【点晴】本题考查学生常见的放热反应和吸热反应。常见的吸热反应有:大部分分解反应,NH4Cl固体与Ba(OH)2•8H2O固体的反应,炭与二氧化碳反应生成一氧化碳,炭与水蒸气的反应,一些物质的溶解(如硝酸铵的溶解),弱电解质的电离,水解反应等;常见的放热反应:燃烧反应、中和反应、物质的缓慢氧化、金属与水或酸反应、部分化合反应。
9.C
【分析】由图得:①C(S,石墨)+O2(g)=CO2(g)△H=-393.5kJ•ml-1
②C(S,金刚石)+O2(g)=CO2(g)△H=-395.4kJ•ml-1,
利用盖斯定律将①-②可得:C(S,石墨)=C(S,金刚石)△H=+1.9kJ•ml-1,则
【详解】A.根据分析可知,C(s,石墨)=C(s,金刚石)△H=+1.9kJ•ml-1,为吸热反应,故A错误;
B.石墨转化为金刚石有新物质生成,是发生的化学反应,属于化学变化,故B错误;
C.金刚石能量大于石墨的总能量,物质的量能量越大越不稳定,则石墨比金刚石稳定,故C正确;
D.金刚石和氧气生成二氧化碳的反应放热,1ml金刚石和1ml氧气的总能量大于1ml二氧化碳的能量,但是1ml金刚石的能量不一定大于1ml二氧化碳的能量,故D错误;
故选:C。
10.A
【详解】①制取粗硅的反应原理: SiO2+CSi+CO↑,故错误;
②工业上一般以硫磺或其他含硫矿物(硫铁矿)为原料制备硫酸,故正确;
③反应热与是否加热无关,高炉炼铁应在加热条件下进行,故错误;
④镁的性质活泼,常用电解熔融氯化镁的方法来制取镁,故正确;
⑤银的性质稳定,通常用热分解氧化物的方法制取,工业上冶炼Ag:2Ag2O4Ag+O2↑,故正确;
故答案选A。
11. 镁片上有大量气泡产生,镁片逐渐溶解,烧杯中溶液变浑浊 镁与盐酸反应产生氢气,该反应为放热反应,Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体 448 2.0ml/L 大于 放热反应
【详解】(1)、(2)镁是活泼金属,能与稀盐酸发生反应,在镁片上产生大量气泡,即产生氢气,随着反应的进行,镁片逐渐溶解,该反应放出大量的热,而饱和石灰水随着温度的升高,溶解度逐渐减小,逐渐有Ca(OH)2晶析析出,所以烧杯中溶液变浑浊;
(3)该反应的离子的方程式为;反应中转移了0. 04ml电子时,即生成0.02mlH2,标准状况下产生448mL的H2;生成的MgCl2物质的量浓度为;
(4)由实验可知,该反应为放热反应,反应物的总能量大于生成物的总能量,所以镁片溶液和盐酸的总能量大于MgCl2和H2的总能量。
12.(1) 放 大于
(2) 小于 (4c−2a−b) kJ
【详解】(1)燃烧反应都是放热反应,所以氢气的燃烧反应是放热反应,根据能量守恒定律,放热反应是反应物的总能量大于生成物的总能量;故答案为放,大于。
(2)化学反应的本质是旧化学键的断裂和新化学键的形成,放热反应的本质是断裂反应物中的化学键吸收的总能量小于形成产物的化学键放出的总能量;氢气燃烧放热,所以2mlH2(g)和1mlO2(g)转化为2mlH2O(g)时的热化学方程式为:2H2(g)+O2(g)═2H2O(g)△H=反应物的键能和-生成物的键能和=-(2a+b-4c)kJ/ml,故放出的热量为(4c-2a-b)kJ,故答案为小于,(4c-2a-b)kJ。
13.(1)
(2)
【详解】(1)肼燃烧为放热反应,,由题图可知,1ml肼燃烧的,故热化学方程式为;
(2)和反应生成和的焓变,可根据题给热化学方程式运用盖斯定律进行计算。由可得。
14.(1)4CuCl(s)+O2(g)=2CuCl2(s)+2CuO(s) ∆H=-177.6kJ·ml-1
(2)SiCl4(g)+2H2(g)Si(s)+4HCl(g) ∆H=-0.025akJ·ml-1
(3)AX3(l)+X2(g)AX5(s) ΔH=-123.8kJ·ml-1
【详解】(1)生成的黑色物质是氧化铜,反应的化学方程式为:4CuCl(s)+O2(g)=2CuCl2(s)+2CuO(s),因为该反应每消耗1mlCuCl(s),放热44.4kJ,则该反应的∆H=-4×44.4kJ·ml-1=-177.6kJ·ml-1,即热化学方程式是4CuCl(s)+O2(g)=2CuCl2(s)+2CuO(s) ∆H=-177.6kJ·ml-1;
(2)该反应的化学方程式为SiCl4(g)+2H2(g)Si(s)+4HCl(g),因为生成1.12kg纯Si需要吸收akJ的热量,则生成1ml(28g)纯硅需要吸收热量==0.025akJ,所以∆H=-0.025akJ·ml-1,热化学方程式为SiCl4(g)+2H2(g)Si(s)+4HCl(g) ∆H=-0.025akJ·ml-1;
(3)根据AX3、AX5的熔沸点知AX3为液态、AX5为固体,化学方程式为AX3(l)+X2(g)AX5(s),因为生成lmlAX5,放出热量123.8kJ,所以∆H=-123.8kJ·ml-1,热化学方程式为AX3(l)+X2(g)AX5(s) ΔH=-123.8kJ·ml-1。
15.(1)物理量
(2)吸收或释放
(3) 等压 焓变 ΔH
(4) 释放 减小 吸收 增大
【详解】(1)焓(H):是一个与内能有关的物理量。故答案为:物理量;
(2)焓变(△H):在恒压下,化学反应过程中吸收或释放的热量称为该反应的焓变。常用单位kJ/ml或kJ·ml-1。故答案为:吸收或释放;
(3)在等压条件下进行的化学反应的反应热等于反应的焓变,因此常用ΔH表示反应热。故答案为:等压;焓变;ΔH;
(4)①放热反应:反应体系向环境释放能量,反应体系的焓减小,ΔH为负值,即ΔH<0。故答案为:释放;减小;
②吸热反应:反应体系从环境中吸收能量,反应体系的焓增大,ΔH为正值,即ΔH>0。
故答案为:吸收;增大。
16.(1) 放出 吸收
(2)431
(3) 化学 热
【详解】(1)新键形成放出能量,所以当生成时,要放出436kJ的能量;化学键断裂要吸收能量,所以当断裂中的共价键时,要吸收243kJ的能量。
(2)对于反应,测得生成时,反应过程中放出183kJ的热量,则形成2mlH-Cl键放出的能量是183kJ+436kJ+243kJ=862kJ,所以断开1ml H—Cl键所需的能量是431kJ。
(3)这两个不同条件下的反应都是放热反应,则这两个反应的能量转化方式主要是化学能转化为热能。
17. 3NO2+H2O=2HNO3+NO 2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O CH4+4NO=CO2+2H2O+2N2 N2H4(l)+O2(g)=2H2O(g)+N2(g) ΔH=-510kJ/ml
【详解】(1)NO2与水反应方程式为3NO2+H2O=2HNO3+NO,雨水酸性较强,形成了酸雨;
(2)NH4Cl和熟石灰共热可生成氨气,该反应的化学方程式为:2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O;
(3)可利用CH4等气体除去烟气中的氮氧化物,生成物为可参与大气循环的气体,则反应产物为CO2、H2O、N2,则CH4与NO反应的化学方程式为:CH4+4NO=CO2+2H2O+2N2;
(4)16gN2H4(l)即0.5ml肼在氧气(g)中燃烧,生成氮气(g)和水蒸气,共放出255kJ热量,则1.0ml肼在氧气(g)中燃烧,生成氮气(g)和水蒸气,共放出510kJ热量,该反应的热化学方程式为N2H4(l)+O2(g)=2H2O(g)+N2(g) ΔH=-510kJ/ml。
18.(1)
(2)
【详解】(1)1ml(g)在中完全燃烧生成和液态水,放出1299.6kJ的热量,反应的热化学方程式: 。
(2)23g(l)物质的量为,在中完全燃烧生成和液态水,放出683.4kJ的热量,则反应的热化学方程式: 。
19.△H=-183kJ/ml
【详解】化学反应中,旧键断裂吸收能量,形成新键放出能量,反应H2(g) +Cl2(g)=2HCl(g)中,需要断裂1mlCl-Cl键和1mlH-H键,则吸收能量:436kJ+243kJ=679kJ,生成2mlHCl时需生成1mlH-Cl键,放出2ml×431kJ/ml=862kJ能量,放出的能量高于吸收的能量,所以反应是放热的,放出的能量为862kJ-679kJ=183kJ,即△H=-183kJ/ml。
20.(1)A
(2)A
(3)放热反应
(4)Cl2
【详解】(1)根据表中数据可知,破坏1ml氢气中的化学键所消耗的能量最高,则说明氢气最稳定,具有的能量最低,故选A;
(2)根据表中数据可知,破坏1ml氯化氢中的化学键所消耗的能量最高,则说明HCl最稳定,故选A;
(3)反应X2+H2=2HX的反应热∆H=反应物所含键能之和-生成物所含键能之和,若X代表Cl,则∆H=(243+436-2431)=-183<0,该反应为放热反应,若X代表Br,则∆H=(193+436-2366)=-103<0,该反应为放热反应,若X代表I,则∆H=(151+436-2298)=-9<0,该反应为放热反应,即卤素单质与氢气的化合反应均为放热反应,故答案为:放热反应;
(4)由(3)分析知,消耗1mlH2,放出热量最多的是氯气,即当消耗等物质的量的氢气时,放出热量最多的氯气,故答案为:Cl2。
21. 检查装置的气密性 关闭分液漏斗的活塞,出气导管再按一导管,放入水槽液面下,用手捂大试管,若水槽中产生气泡,松开手导管中形成水柱,说明装置气密性良好 出现浑浊(或“产生白色沉淀”) 反应放热 有氧气生成 2Na2O2+2H2O=4NaOH+O2↑ NaOH (aq) +HCl(aq) = NaCl (aq) + H2O (l) △H=-akJ/ml或H+(aq) + OH-(aq) = H2O (1) △H=-akJ/ml MnO2+4H++2Cl-= Mn2++Cl2↑+2H2O 在装置II、III之间加入一个盛有浓硫酸的洗气瓶 溶液由浅绿色变为黄色 KSCN (合理答案即可)
【详解】E为黑色粉末,图中转化中均作催化剂,利用氯酸钾、过氧化氢在二氧化锰作催化剂条件下制备氧气,可推知固体A为KClO3、B为H2O2,E为MnO2,D为O2,淡黄色固体C能与水反应,C应为Na2O2。
I、(1)在实验前首先检查装置的气密性,关闭分液漏斗的活塞,出气导管再按一导管,放入水槽液面下,用手捂大试管,若水槽中产生气泡,松开手导管中形成水柱,说明装置气密性良好。②烧杯中的现象为:出现浑浊(或“产生白色沉淀”),过氧化钠与水反应生成氢氧化钠与氧气,反应放热,氢氧化钙的溶解度随温度升高而降低。根据所观察现象可得到的两个结论是反应放热、有氧气生成。③试管中反应的化学方程式 2Na2O2+2H2O=4NaOH+O2 ↑ 。(2) 水与C过氧化钠反应生成D氧气及另一种化合物F氢氧化钠,在通常状况下,足量F氢氧化钠的稀溶液与含溶质为1ml 的稀盐酸完全反应时放出a kJ的热量,该反应的热化学方程式NaOH (aq) +HCl(aq) = NaCl (aq) + H2O (l) △H=-akJ/ml或H+ (aq) + OH-(aq) = H2O (1) △H=-akJ/ml;II.在加热条件下,某无氧酸(含有A中的一种元素)的浓溶液与E反应,生成单质气体X,则无氧酸为HCl、X为Cl2,(1)实验中制备单质气体X 的离子反应方程式MnO2+4H++2Cl- = Mn2++Cl2↑+2H2O。(2)实验过程中,观察到装置III中品红试纸的红色褪去,并未观察到“无明显变化”这一预期现象。为了达到这一预期现象,加入装置Ⅲ中的氯气应干燥,应在装置II、Ⅲ之间加入一个盛有浓硫酸的洗气瓶;(3)氯气氧化亚铁离子生成铁离子,装置Ⅳ中可观察到溶液由浅绿色变为黄色;滴加试剂,观察到溶液呈血红色,应滴加KSCN溶液。
点睛:本题考查无机物推断、氯气的性质及制备实验等,注意根据图中淡黄色固体能与水反应,再结合黑色粉末E在转化中均作催化剂,判断应为制备氧气的反应。II.氯气的制备和性质,潮湿的氯气具有漂白性,是难点,应在装置II、Ⅲ之间加入一个盛有浓硫酸的洗气瓶。
22.(1)III
(2) 左端液面降低,右端液面升高 放热
(3) 产生气泡,反应完毕后,冷却至室温,烧杯里的导管内形成一段液柱 可能是放热反应 NH4NO3
(4) I或II 放热
【详解】(1)装置Ⅰ可通过U形管中红墨水液面的变化判断镁与稀盐酸的反应是放热还是吸热,装置Ⅱ可通过烧杯中是否产生气泡判断镁与稀盐酸的反应放热还是吸热,镁与稀盐酸反应产生氢气,氢气进入烧杯产出气泡,故装置Ⅲ不能证明该反应是放热反应还是吸热反应;
(2)氢氧化钡与稀硫酸反应属于中和反应,中和反应都是放热反应,所以锥形瓶中气体受热膨胀,导致U形管左端液柱降低,右端液柱升高,
(3)①若M为钠,钠与水反应生成氢氧化钠和氢气,该反应为放热反应,放热的热量使大试管中温度升高,气体压强增大,所以右边烧杯中有气泡产生,反应完毕后,冷却至室温,烧杯里的导管内形成一段水柱;
②若观察到烧杯里产生气泡,说明M溶于水放出热量,由于放热反应一定属于化学变化,而有热量放出的过程不一定为化学变化,所以不一定属于放热反应,如NaOH溶于水会放出热量,但是不属于放热反应;
③观察到烧杯里的导管内形成一段水柱,说明为吸热过程,铵盐溶于水一般为吸热,故M可以为NH4NO3;
(4)证明超氧化钾与水的反应是放热反应还是吸热反应:方法①:选择上述装置Ⅰ(或Ⅱ)进行实验,Ⅰ装置右边U形管中左端液柱降低,右端液柱升高(或烧杯中导管中有气泡放出),证明该反应为放热反应;
方法②:取适量超氧化钾粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到棉花燃烧,则说明该反应放出大量热,使棉花燃烧,证明该反应是放热反应。
23. 检查装置的气密性 U形管左端液面下降,右端液面上升 否
【详解】(1)气体具有热胀冷缩的性质,根据U形管左右两侧液面的变化判断装置内压强的变化,装置密封性要好,所以实验之前一定要检查装置气密性,故答案为:检查装置气密性;
(2)CaO和水反应放出热量,使大试管中空气膨胀,内部压强增大,U形玻璃管里的红墨水(或品红)会沿开口端上升,而U形管左端液面下降,故答案为:U形管左端液面下降,右端液面上升;
(3)氯化钠和水混合后,没有明显的热效应,试管内气体压强几乎不变,U形管两侧液面不变,故答案为:否。
高中化学人教版 (2019)选择性必修1第一节 反应热巩固练习: 这是一份高中化学人教版 (2019)选择性必修1第一节 反应热巩固练习,共5页。试卷主要包含了 反应热和焓变, 实验步骤及注意事项, 数据处理等内容,欢迎下载使用。
化学选择性必修1第一单元 化学反应的热效应同步测试题: 这是一份化学选择性必修1第一单元 化学反应的热效应同步测试题,共23页。试卷主要包含了单选题,填空题,实验探究题等内容,欢迎下载使用。
高中化学第一单元 化学反应的热效应一课一练: 这是一份高中化学第一单元 化学反应的热效应一课一练,共22页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。













