





人教版 (2019)选择性必修2第三章 晶体结构与性质第三节 金属晶体与离子晶体教学课件ppt
展开1.能结合实例描述离子键的成键特征及其本质,能根据晶格能大小解释和预测同类型离子化合物的某些性质,进一步培养宏观辨识与微观探析的化学核心素养。2.能描述常见类型的离子化合物的晶体结构,能运用模型和有关理论解释不同类型离子化合物的晶胞构成,培养证据推理与模型认知的化学核心素养。
基础落实·必备知识全过关
重难探究·能力素养全提升
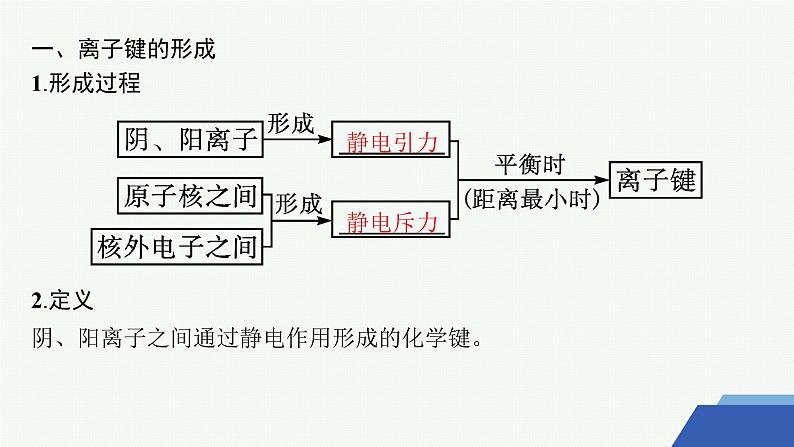
一、离子键的形成1.形成过程2.定义阴、阳离子之间通过静电作用形成的化学键。
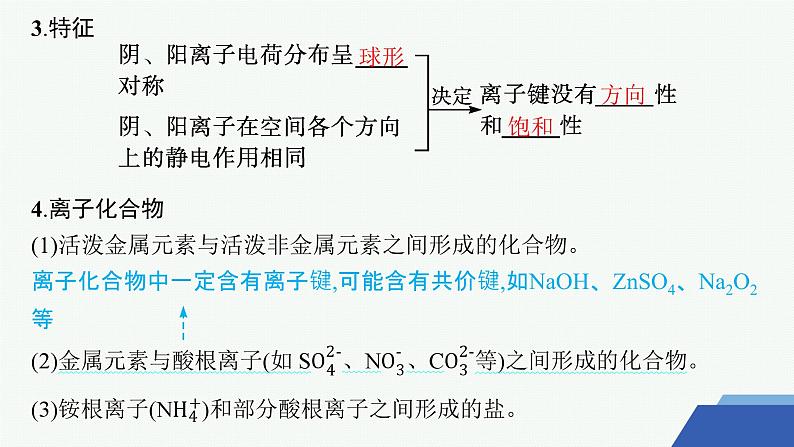
3.特征4.离子化合物(1)活泼金属元素与活泼非金属元素之间形成的化合物。离子化合物中一定含有离子键,可能含有共价键,如NaOH、ZnSO4、Na2O2等
教材阅读 想一想阅读教材“大多数活泼金属的氯化物”一段。思考:金属元素与非金属元素构成的化学键一定是离子键吗?离子化合物中一定含有金属元素吗?
提示 不一定。金属元素与非金属元素构成的化学键不一定是离子键,如AlCl3中的化学键为共价键。不一定。如NH4Cl为离子化合物, 和Cl-之间以离子键结合,该物质中不含有金属元素。
易错辨析 判一判(1)离子键是阴、阳离子之间的静电吸引。( )提示 阴、阳离子之间的静电引力和静电斥力达到平衡时形成离子键。(2)NaOH中只存在离子键。( )提示 NaOH中既存在离子键,又存在共价键。(3)在水溶液中能导电的化合物一定是离子化合物。( )提示 有些共价化合物如HCl、H2SO4,溶于水也可发生电离形成阴、阳离子,可以导电。(4)某化合物在熔融状态下可以导电,说明该化合物中一定含有离子键。( )
二、离子晶体1.定义及结构特点(1)定义:由 按一定方式有规则地排列形成的晶体。 (2)结构特点①构成微粒: 和 ,离子晶体中不存在单个分子,其化学式表示的是 。 ②微粒间的作用力: 。 2.离子晶体的性质(1)熔、沸点较 ,硬度较 。 (2)离子晶体不导电,但 或 后能导电。 (3)大多数离子晶体能溶于水,难溶于有机溶剂。
3.晶格能(U)(1)定义:拆开 离子晶体使之形成气态阴离子和气态阳离子时所 的能量。 (2)影响因素:对于结构相似的离子晶体,离子晶体中离子半径越 ,所带电荷越 ,晶格能越大。 (3)晶格能与晶体物理性质的关系:晶格能越大,离子键稳定性越 ,离子晶体的熔点越 ,硬度越 。
4.典型离子晶体的结构
教材阅读 想一想自学教材“离子晶体”。思考:在NaCl和CsCl两种晶体中,阴、阳离子的个数比都是1∶1,都属于AB型离子晶体,为什么晶体结构不同?
提示 两种离子晶体中阴、阳离子半径的相对大小不同,导致其离子晶体中不同离子周围异电性离子数目的多少不同。
易错辨析 判一判(1)钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。钛酸钡晶体的晶胞结构示意图如图所示,它的化学式是BaTiO3。( )
(2)离子晶体的化学式代表的是真正的分子组成。( )提示 离子晶体中不存在分子,离子晶体的化学式仅代表晶体中阴、阳离子的个数比。(3)离子晶体中只有离子键。( )提示 离子晶体中一定含有离子键,可能含有共价键,如氢氧化钠晶体中既有离子键又有共价键。(4)晶格能越大,离子晶体的熔点越高。( )
探究一 离子键和离子化合物
下图所示为NaCl的形成过程和氯化钠的晶体结构模型:
1.用电子式表示氯化钠的形成过程,在NaCl中钠离子与氯离子之间形成了什么化学键?
提示 。钠离子与氯离子之间形成了离子键。
2.与共价键相比,离子键为什么没有方向性和饱和性?
提示 (1)离子键没有方向性的原因:离子键的实质是静电作用,离子的电荷分布通常被看成是球形对称的,因此一种离子对带异种电荷离子的吸引作用与其所处的方向无关,即相对于共价键而言,离子键是没有方向性的。(2)离子键没有饱和性的原因:在离子化合物中,每个离子周围最邻近的带异性电荷离子数目的多少,取决于阴、阳离子的相对大小。只要空间条件允许,阳离子将吸引尽可能多的阴离子排列在其周围,阴离子也将吸引尽可能多的阳离子排列在其周围,以达到降低体系能量的目的,所以离子键是没有饱和性的。
3.由于离子键没有饱和性,在NaCl晶体中Na+周围的Cl-数目是任意数吗?离Na+最近的Cl-有几个?
提示 Na+周围的Cl-数目不是任意的;有6个。
1.离子键、离子化合物和离子晶体
视角1 离子键1.下列说法正确的是( )A.离子键就是使阴、阳离子结合成化合物的静电引力B.凡是金属元素和非金属元素之间都形成离子键C.含有离子键的化合物一定是离子化合物D.任何离子键的形成过程中必定有电子的得与失
解析 离子键是使阴、阳离子结合成化合物的静电作用,包括静电引力和静电斥力,A错误;金属Al与非金属Cl形成的化合物AlCl3中的化学键为共价键,不是离子键,B错误;含有离子键的化合物一定是离子化合物,C正确;一般来说形成离子键有电子的得失,但也有例外,如NH3与HCl反应生成NH4Cl、饱和溶液中的Na+和Cl-析出NaCl晶体等,D错误。
【变式设问】(1)“熔融状态下能够导电的物质,一定是离子化合物”,这种说法是否正确?
(2)离子键是使阴、阳离子结合成化合物的静电作用,包括静电引力和静电斥力,试以NaCl为例分析NaCl中存在哪些斥力作用。
提示 错误。熔融状态能导电的物质,不一定是离子化合物,如金属单质、合金等。
提示 Na+的原子核和Cl-的原子核均带正电,二者相互排斥;Na+的核外电子和Cl-的核外电子均带负电,二者相互排斥。
2.以下叙述错误的是( )A.钠原子和氯原子作用生成NaCl后,其结构的稳定性增强B.在氯化钠中,除Cl-和Na+的静电吸引作用外,还存在电子与电子、原子核与原子核之间的排斥作用C.Na+和Cl-形成的离子键具有方向性D.钠与氯反应生成氯化钠后,体系能量降低
解析 活泼金属原子和活泼非金属原子之间形成离子化合物,阳离子和阴离子均达到稳定结构,这样体系的能量降低,其结构的稳定性增强,A、D正确;Cl-和Na+之间既有引力也有斥力,B正确;Na+和Cl-形成的离子键不具有方向性,C错误。
视角2 离子化合物3.下列物质属于离子化合物的是( )A.H2SD.C2H6
解析 离子化合物是由阳离子和阴离子构成的化合物。H2S、HNO3、C2H6中没有离子,均为共价化合物,NaCl由钠离子和氯离子构成,属于离子化合物。故本题选C。
4.下列关于离子化合物的叙述正确的是( )A.离子化合物中可能存在共价键B.离子化合物中阳离子一定是金属离子C.离子化合物的水溶液一定能导电D.离子键在形成过程中一定有电子的得失
解析 离子化合物中存在离子键,也可能同时存在共价键,如过氧化钠中含有离子键和共价键,A正确;离子化合物中阳离子不一定是金属离子,如氯化铵中的铵根离子,B错误;溶液导电的原因是存在自由移动的离子,离子化合物的水溶液不一定能导电,如难溶性硫酸钡的溶液几乎不导电,C错误;离子键是阴、阳离子通过静电作用形成的,在形成过程中不涉及电子的得失,在离子形成的过程中涉及电子得失,D错误。
Li2O是离子晶体,广泛用于玻璃、陶瓷、医药生产(制锂盐),也可用于制造氧化锂电池材料、光谱纯试剂等。其晶格能可通过图(a)的Brn-Haber循环计算得到。
1.Li原子的第一电离能为多少kJ·ml-1,O═O键能为多少kJ·ml-1?
2.Li2O晶格能为多少kJ·ml-1?
提示 2 908 kJ·ml-1。晶格能是指拆开1 ml离子晶体生成气态阴、阳离子所吸收的能量,因此Li2O晶格能为2 908 kJ·ml-1。
提示 520 kJ·ml-1,498 kJ·ml-1。锂原子的第一电离能是指1 ml气态锂原子失去1 ml电子变成1 ml气态锂离子所吸收的能量,为 =520 kJ·ml-1,O═O键能是指1 ml氧气分子断键生成气态氧原子所吸收的能量,为249 kJ·ml-1×2=498 kJ·ml-1。
3.Li2O的晶胞如图(b)所示。已知晶胞参数为0.466 5 nm,阿伏加德罗常数的值为NA,则Li2O的密度为多少g·cm-3(列出计算式)?
离子晶体的结构与性质(1)离子晶体的结构
(2)离子晶体的性质①离子晶体无延展性。②离子晶体不导电,但在熔融状态或水溶液中能导电。③离子晶体一般难溶于非极性溶剂(如苯、汽油),而易溶于极性溶剂(如水)。④离子晶体的熔点较高、硬度较大。(3)结构相似离子晶体熔点、硬度的影响因素
视角1 离子晶体的结构和特征1.如图所示,直线交点的圆圈处为NaCl晶胞中Na+或Cl-所处的位置。这两种离子在空间三个互相垂直的方向上都是等距离排列的。(1)请将其中代表Na+的圆圈涂黑(不必考虑体积大小),以完成NaCl晶胞的结构示意图。(2)在晶胞中,每个Na+的周围与它最接近的且距离相等的Na+共有 个。 (3)在NaCl晶胞中正六面体的顶点上、面上、棱上的Na+或Cl-为该晶胞与其相邻的晶胞所共有,一个晶胞中Cl-的个数等于 ;Na+的个数等于 。
(4)设NaCl的摩尔质量为M g·ml-1,食盐晶体的密度为ρ g·cm-3,阿伏加德罗常数为NA,食盐晶体中两个距离最近的钠离子间的距离为 cm。(5)NaCl晶体中不存在分子,但温度达到1 413 ℃时,NaCl晶体形成气体,并以分子形式存在。现有29.25 g NaCl晶体,加热使温度达到1 450 ℃,测得气体体积为5.6 L(已折算为标准状况),则此时氯化钠气体的化学式为 。
解析 (2)从体心(或面心)Na+看,与它最近的且距离相等的Na+共有12个。(3)根据立方结构的特点,可求阴、阳离子的个数。
归纳总结 NaCl晶胞结构的理解在NaCl晶胞中Na+处于晶胞的顶点和面心,构成面心立方晶胞,则Cl-(或Na+)插在立方体的棱心和体心,晶胞中Na+、Cl-位置可互换。在晶胞中Na+和Cl-的配位数均为6,每个Na+(Cl-)周围紧邻(距离最近且相等)的Cl-(Na+)构成正八面体。晶胞中每个Na+(或Cl-)周围最近的Na+(或Cl-)有12个,与面心立方晶胞中一个原子的配位数类似;也可根据晶胞中体心原子进行分析。
2.认真分析NaCl和CsCl的晶体结构,判断下列说法错误的是( )A.NaCl和CsCl都属于AB型的离子晶体B.在NaCl和CsCl的晶胞中含有的Cl-数相同C.NaCl和CsCl晶体中阴、阳离子的配位数分别为6和8D.NaCl和CsCl都属于AB型的离子晶体,但阴、阳离子半径比不相同
解析 由化学式可知NaCl和CsCl都属于AB型的离子晶体,A正确;NaCl晶胞中含有4个Cl-,CsCl晶胞中含有1个Cl-,Cl-数不同,B错误;NaCl晶体中阴、阳离子配位数为6,而CsCl晶体中阴、阳离子配位数为8,C正确;NaCl和CsCl晶体中阴、阳离子配位数不同的主要原因是两种晶体中阴、阳离子半径比不同,D正确。
3.NaF、NaI、MgO均为离子化合物,根据下列数据,这三种化合物的熔点高低顺序是( )
解析 离子晶体的熔点与晶格能的大小有关,而晶格能的大小由离子所带电荷数多少和离子核间距进行判断。离子所带电荷数越多,离子核间距越小,晶格能越大,晶体的熔点越高。
A.①>②>③B.③>①>②C.③>②>①D.②>①>③
4.自然界中的CaF2又称萤石,是一种难溶于水的固体,属于典型的离子晶体。下列一定能说明CaF2是离子晶体的实验是( )A.CaF2难溶于水,其水溶液的导电性极弱B.CaF2的熔、沸点较高,硬度较大C.CaF2固体不导电,但在熔融状态下可以导电D.CaF2在有机溶剂(如苯)中的溶解度极小
解析 离子晶体中含有离子键,离子键在熔融状态下被破坏,电离出自由移动的阴、阳离子,所以离子晶体在熔融状态下能够导电,这是判断某晶体是否为离子晶体的依据。
化学选择性必修2第二单元 离子键 离子晶体课前预习课件ppt: 这是一份化学选择性必修2第二单元 离子键 离子晶体课前预习课件ppt,共27页。PPT课件主要包含了内容索引,自主预习新知导学,合作探究释疑解惑,课堂小结,素养阐释,问题引领,归纳提升,典型例题等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修2第二单元 离子键 离子晶体精品ppt课件: 这是一份高中化学苏教版 (2019)选择性必修2第二单元 离子键 离子晶体精品ppt课件,共13页。PPT课件主要包含了学习目标,离子键的形成等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修2第二单元 离子键 离子晶体完美版ppt课件: 这是一份高中化学苏教版 (2019)选择性必修2第二单元 离子键 离子晶体完美版ppt课件,共60页。PPT课件主要包含了核心素养发展目标,随堂演练知识落实,课时对点练,内容索引,离子键的形成,离子晶体,形成过程,静电引力,静电斥力,静电作用等内容,欢迎下载使用。













