
高中化学第一节 电离平衡随堂练习题
展开一、单选题
1.以NaClO为有效成分的“84”消毒液在抗击新冠疫情的消杀工作中起到了重要作用。某研究小组设计下列实验探究NaClO的性质。(已知电离常数:H2CO3:K1=4.4×10-7,K2=4.7×10-11;HClO:Ka=2.9×10-8)
结合上述实验探究,预测的现象以及解释均正确的是
A.实验①:NaClO溶液呈碱性:ClO-+H2O⇌HClO+OH-
B.实验②:NaClO可用于制得HClO:ClO-+CO2+H2O=2HClO+
C.实验③:NaClO具有氧化性ClO-+2I-+2H+=Cl-+I2+H2O
D.实验④:NaClO具有还原性:ClO-+4Fe3++2H2O=+4Fe2++4H+
2.把0.05 ml NaOH固体,分别加入下列100 mL溶液中,溶液的导电能力变化不大的是
①自来水 ②0.5 ml·L-1盐酸 ③0.5 ml·L-1醋酸 ④0.5 ml·L-1NH4Cl溶液
A.①②B.②④C.③④D.②③
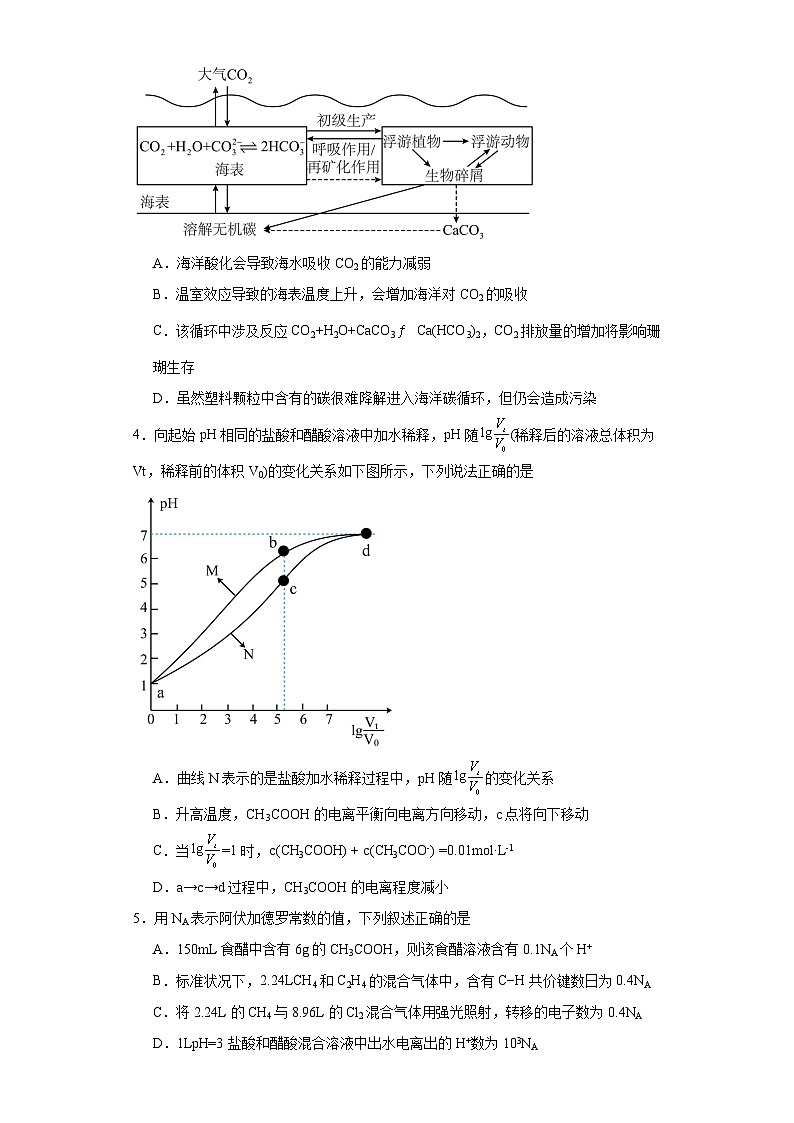
3.海洋碳循环在整个地球气候系统中具有重要地位,下列叙述错误的是
A.海洋酸化会导致海水吸收CO2的能力减弱
B.温室效应导致的海表温度上升,会增加海洋对CO2的吸收
C.该循环中涉及反应CO2+H2O+CaCO3Ca(HCO3)2,CO2排放量的增加将影响珊瑚生存
D.虽然塑料颗粒中含有的碳很难降解进入海洋碳循环,但仍会造成污染
4.向起始pH相同的盐酸和醋酸溶液中加水稀释,pH随(稀释后的溶液总体积为Vt,稀释前的体积V0)的变化关系如下图所示,下列说法正确的是
A.曲线N表示的是盐酸加水稀释过程中,pH随的变化关系
B.升高温度,CH3COOH的电离平衡向电离方向移动,c点将向下移动
C.当=1时,c(CH3COOH) + c(CH3COO-) =0.01ml·L-1
D.a→c→d过程中,CH3COOH的电离程度减小
5.用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.150mL食醋中含有6g的CH3COOH,则该食醋溶液含有0.1NA个H+
B.标准状况下,2.24LCH4和C2H4的混合气体中,含有C−H共价键数日为0.4NA
C.将2.24L的CH4与8.96L的Cl2混合气体用强光照射,转移的电子数为0.4NA
D.1LpH=3盐酸和醋酸混合溶液中出水电离出的H+数为103NA
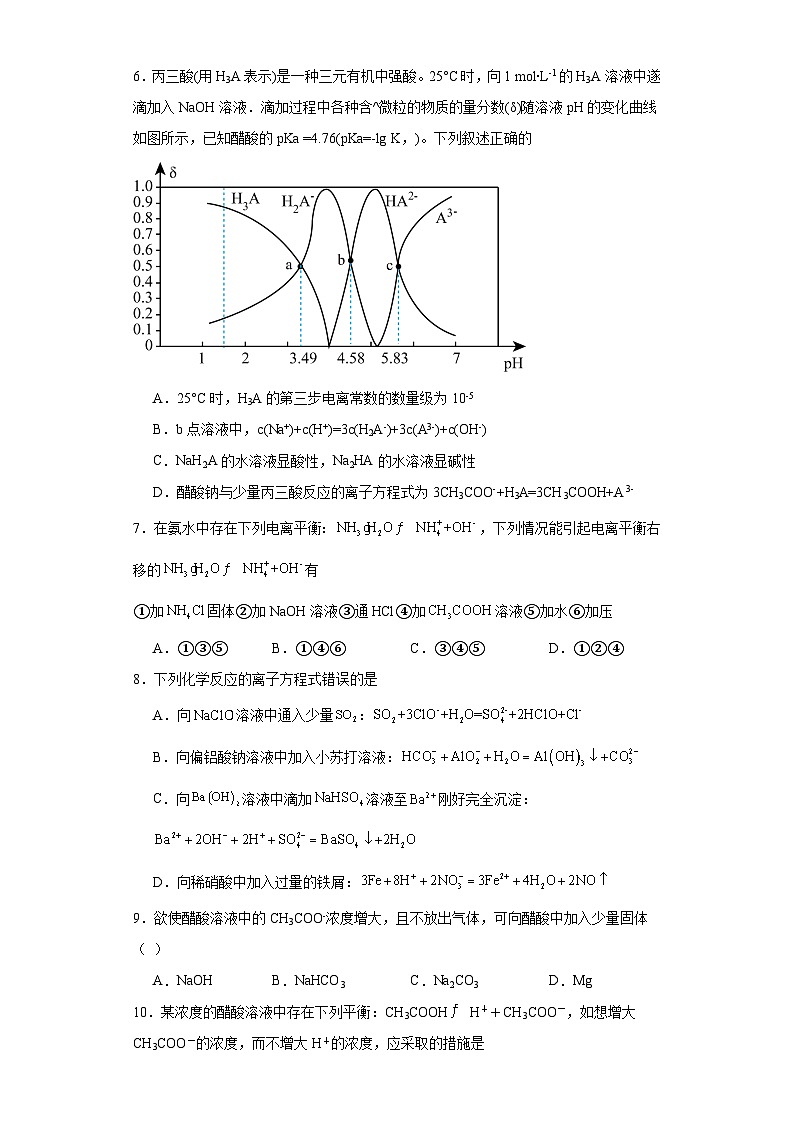
6.丙三酸(用H3A表示)是一种三元有机中强酸。25°C时,向1 ml∙L-1的H3A溶液中遂滴加入NaOH溶液.滴加过程中各种含^微粒的物质的量分数(δ)随溶液pH的变化曲线如图所示,已知醋酸的pKa =4.76(pKa=-lg K,)。下列叙述正确的
A.25°C时,H3A的第三步电离常数的数量级为10-5
B.b点溶液中,c(Na+)+c(H+)=3c(H2A-)+3c(A3-)+c(OH-)
C.NaH2A的水溶液显酸性,Na2HA的水溶液显碱性
D.醋酸钠与少量丙三酸反应的离子方程式为3CH3COO-+H3A=3CH3COOH+A3-
7.在氨水中存在下列电离平衡:,下列情况能引起电离平衡右移的有
①加固体②加NaOH溶液③通HCl④加溶液⑤加水⑥加压
A.①③⑤B.①④⑥C.③④⑤D.①②④
8.下列化学反应的离子方程式错误的是
A.向溶液中通入少量:
B.向偏铝酸钠溶液中加入小苏打溶液:
C.向溶液中滴加溶液至刚好完全沉淀:
D.向稀硝酸中加入过量的铁屑:
9.欲使醋酸溶液中的CH3COO-浓度增大,且不放出气体,可向醋酸中加入少量固体( )
A.NaOHB.NaHCO3C.Na2CO3D.Mg
10.某浓度的醋酸溶液中存在下列平衡:CH3COOHH++CH3COO-,如想增大CH3COO-的浓度,而不增大H+的浓度,应采取的措施是
①加入CH3COONa固体 ②适当升高温度 ③加冰醋酸 ④加入少量NaOH固体
A.①②B.②③C.②④D.①④
二、填空题
11.在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示。请回答:
(1)“O”点导电能力为0,原因是 。
(2)a、b、c三点处,溶液的c(H+)由小到大的顺序为 。
(3)a、b、c三点处,电离程度最大的是 。
(4)若使c点对应的溶液中的c(CH3COO-)增大,则下列措施中,不可行的是 (填标号、下同)。
A.加热 B.加入锌粒 C.加入KOH固体 D.加水 E.加入CH3COONa固体
12.(1)下面所列物质中 ①氯化钾 ②乙醇 ③盐酸 ④Na2O ⑤SO2 ⑥HBr ⑦硫酸氢钠 ⑧一水合氨 ⑨氯气 ⑩冰醋酸
①属于强电解质的是 (填序号,下同) ②属于弱电解质的是
③属于非电解质的是
(2)体积、浓度相等的③和⑩的溶液,加入形状相同且足量的Zn粒,反应速率快的是 (用序号填空);体积、pH相同的③和⑩的溶液,生成氢气体积最多的是 (用序号填空)。
13.乙酰水杨酸是一元弱酸(可用HA表示).在一定温度下, 0.01ml/L 乙酰水杨酸水溶液中,它的电离度为 5.7%,求该酸的电离常数
14.砷为VA族元素,金属冶炼过程产生的含砷有毒废水需处理与检测。
(1)I.已知:As(s)+ H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+O2(g)=H2O(l) ΔH2
2As(s)+ O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH = 。
II.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:
已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq) 2AsS (aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)亚砷酸中砷元素的化合价为 ;砷酸的第一步电离方程式为 。
(2)“一级沉砷”中FeSO4的作用是 ; “二级沉砷”中H2O2与含砷物质反应的化学方程式为 。
III.去除水体中的砷,将As(Ⅲ)转化为As(Ⅴ),也可选用NaClO实现该转化。研究NaClO投加量对As(Ⅲ)氧化率的影响得到如下结果:
已知:投料前水样pH=5.81,0.1ml/LNaClO溶液pH=10.5,溶液中起氧化作用的物质是次氯酸。产生此结果的原因是 。
15.25℃时,三种酸的电离平衡常数如下:回答下列问题:
(1)一般情况下,当温度升高时,电离平衡常数K (填“增大”、“减小”或“不变”)。
(2)下列四种离子结合质子能力最强的是 (填字母)。
a.CO32- b.ClO- c.CH3COO- d.HCO3-
(3)下列反应不能发生的是 (填字母)。
a.CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O b.ClO-+CH3COOH=CH3COO-+HClO
c.CO32-+2HClO=CO2↑+H2O+2ClO- d.2ClO-+CO2+H2O=CO32-+2HClO
(4)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如下图所示。
则HX的电离平衡常数 (填“>”、“=”或“<”,下同)醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+) 醋酸溶液中水电离出来的c(H+);用同浓度的NaOH溶液分别中和上述两种酸溶液,恰好中和时消耗NaOH溶液的体积:醋酸 HX。
16.气态亚硝酸(HNO2或HONO)是大气中的一种污染物。
(1)亚硝酸的电离平衡常数Ka=6.0×10﹣6,其电离方程式为 。
(2)亚硝酸分子中各原子最外层电子均达到稳定结构,其电子式为 。
(3)亚硝酸进入人体可以与二甲胺[(CH3)2NH]迅速反应生成亚硝酸胺[CH3)2N-N=O],亚硝酸胺是最重要的化学致癌物之一。
① 亚硝酸与二甲胺反应生成亚硝酸胺的一种反应机理如下:
HONO+
过程ⅰ和过程ⅱ的反应类型分别为: 、消去反应。
② 上述反应机理的反应过程与能量变化的关系如图:
亚硝酸与二甲胺反应生成亚硝酸胺的反应ΔH 0(填“>”或“<”)。反应难度更大的是过程 (填“ⅰ”或“ⅱ”)。
17.炼金废水中含有络离子[Au(CN)2]-,电离出的CN-有毒,当CN-与H+结合生成HCN时,毒性更强。回答下列问题。
(1)剧毒物HCN的水溶液酸性很弱,写出其电离的方程式: 。
(2)与弱电解质碳酸的电离方式相似,[Au(CN)2]-也存在着两步电离,其一级电离方程式为 。
(3)处理这种废水是在碱性条件下,利用NaClO将CN-氧化为CO和N2,其离子方程式为 。在酸性条件下,ClO-也能氧化CN-,但实际处理废水时却不在酸性条件下进行的主要原因是 。
(4)H2CO3的K1=4.4×10-7、K2=4.7×10-11,HClO的K=3.0×10-8,在NaClO溶液中通入少量的CO2的离子方程式是 。
18.试写出下列物质的电离方程式:
(1)H2CO3
(2)H2S
(3)NaHCO3
(4)NaHSO4
(5)HClO
19.(1)在恒温恒压密闭容器中充入1ml N2和3 ml H2在tl时刻达到平衡状态后,继续充入2 ml NH3,在t2时刻达到平衡状态。画出v(正)和v(逆)随时间t的变化关系
(2)恒温恒容时,下列不能说明合成氨反应达到平衡状态的是
a.容器内N2、H2、NH3的浓度之比为1 : 3 : 2 b.v(N2)(正)=3v(H2)(逆)
c.容器内压强保持不变 d.混合气体的密度保持不变
e.单位时间内断裂6ml N-H键的同时,有3ml H-H形成
(3)将上述制得的的氨气溶于水配成溶液,25℃时,将aml/L的氨水与bml/L盐酸等体积混合,反应后溶液恰好显中性,用a、b表示NH3·H2O的电离平衡常数Kb (写出详细计算过程)
20.室温下,相同体积、相同的氨水和溶液加水稀释时的变化曲线如图所示:
(1)点所在曲线对应的是 。(填溶液名称)
(2)、两点溶液与同一浓度的盐酸完全反应时,消耗盐酸体积: (填“>”或“<”或“=”)。
(3)、、三点溶液导电能力由大到小排序 。
三、实验探究题
21.某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验.
探究乙酸、碳酸和苯酚的酸性强弱关系该校学生设计了下图的实验装置(夹持仪器已略去).
(1)某生检查装置A的气密性时,先关闭止水夹,从左管向U形管内加水,至左管液面高于右管液面,静置一段时间后,若U形管两侧液面差不发生变化,则气密性良好.你认为该生的操作正确与否? (填“正确”或“错误”)大理石与乙酸溶液反应的化学方程式为
(2)装置A中反应产生的气体通入苯酚钠溶液中,实验现象为 反应的离子方程式为
(3)有学生认为(2)中的实验现象不足以证明碳酸的酸性比苯酚强,理由是乙酸有挥发性,挥发出的乙酸也可以和苯酚钠溶液反应,生成苯酚.改进该装置的方法是 证明乙酸为弱酸
(4)现有pH=3的乙酸溶液、蒸馏水、石蕊试液及pH试纸,选用适当的仪器和用品,用最简便的实验方法证明乙酸为弱酸
(5)在相同温度下,测定相同物质的量浓度
a.NaHCO3溶液b.Na2CO3溶液c.CH3COONa溶液d. 溶液
的pH,其pH由大到小排列的顺序为 (填溶液编号)
22.为了证明是弱酸,甲、乙、丙三位同学分别设计以下实验进行探究。
(1)甲同学取一定体积的溶液,滴入2滴紫色石蕊溶液,显红色,再加入固体观察到的现象是 ,则证明为弱酸。
(2)乙同学取未知浓度的溶液,测其为,然后用蒸馏水稀释至。再测其为b,若要认为为弱酸,则a、b应满足的关系是 (用含a的代数式表示)。
(3)丙同学用试纸测得室温下的溶液的为2,则测定为弱酸,由丙同学的实验数据可得室温下的电离平衡常数约为 。
23.连二亚硫酸钠(Na2S2O4),也称为保险粉,Na2S2O4)易溶于水,难溶于甲醇,具有极强的还原性,易被空气氧化,在碱性介质中稳定。工业上常用制备Na2S2O4的方法有I.锌粉法、II.甲酸钠法。
I.实验室模拟锌粉法的装置如图(加热等辅助仪器略去)
反应原理为:
Zn+2SO2=ZnS2O4
ZnS2O4+2NaOH=Zn(OH)2↓+Na2S2O4
(1)连接好装置后,首先要检验装置的气密性,方法为 。
(2)①装置A中分液漏斗中的试剂是 。
A.稀硫酸 B.98%的硫酸 C.70%的硫酸
②装置B中反应结束后,取出混合物进行以下操作,得到Na2S2O4晶体。
操作ii加入NaCl固体的目的是 (用平衡移动原理解释),操作iv洗涤中选用的试剂是 (填“水”或“甲醇”)。
(3)实验室保存新制Na2S2O4晶体的方法是 。
II.实验室模拟甲酸钠法的装置如图(加热等辅助仪器略去)
第一步,在F装置中加入甲酸钠、氢氧化钠、甲醇(溶剂)的混合液;
第二步,向装置F中通入二氧化硫;
第三步,75℃加热一段时间,装置中有晶体析出,并产生大量气体:
第四步,过滤、洗涤、干燥,收集产品。
(4)装置F的名称 ,在其中制备连二亚硫酸钠的离子方程式可表示为 。
(5)已知某温度下,H2SO3的电离常数为K1≈1.5×10-2,K2≈1.0×10-7,H2CO3的电离常数为K1ˊ≈4.4×10-7,K2ˊ≈4.7×10-11。装置G用于吸收未反应完的SO2和反应产生的CO2。该温度下当G溶液中HSO、SO离子浓度相等时,溶液的pH约为 。
(6)甲酸钠法于1968年实现工业化,继而逐渐替代了锌粉法生产连二亚硫酸钠。与锌粉法相比,甲酸钠法的优点在于 。
实验
装置
试剂(少量)
预测可能的现象
①
酚酞
无色溶液最终呈红色
②
CO2
无明显现象
③
淀粉-KI溶液+稀硫酸
无色溶液立即变蓝
④
FeCl3溶液
溶液略呈浅绿色
化学式
CH3COOH
H2CO3
HClO
电离平衡常数
1.8×10-5
K1=4.3×10-7
K2=5.6×10-11
3.0×10-8
参考答案:
1.C
【详解】A.虽然次氯酸根水解使溶液显碱性,但次氯酸根具有强氧化性,指示剂变色后会被漂白,所以溶液最终无色,预测现象错误,故A错误;
B.根据电离平衡常数可知酸性:H2CO3>HClO>HCO,所以二氧化碳与次氯酸钠溶液反应时无法生成碳酸根,故B错误;
C.次氯酸根酸性环境性下可将碘离子氧化成碘单质,根据电子守恒和元素守恒可得离子方程式为ClO-+2I-+2H+=Cl-+I2+H2O,淀粉遇碘变蓝,所以可以观察到无色溶液立即变蓝,故C正确;
D.Fe3+的氧化性不足以将ClO-氧化,不会生成Fe2+,所以溶液不会是浅绿色,故D错误;
故答案为C。
2.B
【详解】导电能力的大小,要比较单位体积内离子浓度的多少。
①因水是极弱的电解质,导电性极弱,加入氢氧化钠后,氢氧化钠是强电解质,完全电离,即NaOH=Na++OH-,溶液中存在大量的钠离子和氢氧根离子,离子浓度增大,导电性增强,故①不符合题意;
②未加氢氧化钠固体,导电的有氯离子和氢离子,加入氢氧化钠后主要是钠离子,氯离子,而参加反应的氢离子正好与钠离子的量相当,所以导电性变化不大,故②符合题意;
③醋酸是弱电解质,部分电离,离子浓度较少,导电性较弱,加入NaOH以后,二者刚好酸碱中和,生成醋酸钠,变为强电解质,完全电离,离子浓度增大,导电能力增强,故③不符合题意;
④氯化铵为强电解质,加入NaOH后生成NaCl仍是强电解质,离子的浓度变化不大,故导电性变化不大,故④符合题意;
由上分析,②④符合题意,B正确;
答案为B。
3.B
【详解】A.海洋酸化导致溶液酸性增加,会抑制海水吸收CO2的能力,故A正确;
B.温度升高,气体的溶解度减小,故海表温度上升,会减小海洋对CO2的吸收,故B错误;
C.该循环中涉及反应CO2+H2O+CaCO3Ca(HCO3)2,CO2排放量的增加导致碳酸钙转化为可溶性碳酸氢钙,会将影响珊瑚生存,故C正确;
D.虽然塑料颗粒中含有的碳很难降解进入海洋碳循环,但仍会造成白色污染,故D正确;
故选B。
4.B
【详解】A.起始pH相同的盐酸和醋酸溶液中加水稀释相同的倍数,盐酸的pH大于醋酸,曲线表示的是盐酸加水稀释过程,A错误;
B.升高温度,的电离平衡向电离方向移动,氢离子浓度增大c点将向下移动,B正确;
C.不知道醋酸的初始浓度,算法错误,C错误;
D.加水稀释过程中的电离程度增大,D错误;
故选B。
5.B
【详解】A.150mL食醋中含有6g的CH3COOH即物质的量为0.1ml,由于醋酸是弱电解质,部分电离,因此该食醋溶液含H+数目小于0.1NA个,故A错误;
B.1个CH4或C2H4都含有4个C−H共价键,标准状况下,2.24LCH4和C2H4的混合气体中即物质的量为0.1ml,含有C−H共价键数日为0.4NA,故B正确;
C.缺少标准状况下,因此2.24L的CH4物质的量无法计算,转移电子数目也无法计算,故C错误;
D.1L pH=3盐酸和醋酸混合溶液中c(H+)=1.0×10−3ml∙L−1,c(OH-)=1.0×10−10ml∙L−1,因此溶液中水电离出的H+浓度为c(H+)水=c(OH-)水=1.0×10−10ml∙L−1,水电离出的H+数目为1.0×10−10NA,故D错误。
综上所述,答案为B。
6.B
【详解】A.根据图中a、b、c三点的可知的一、二、三步电离常数分别为K1=10-3.49、K2=10-4.58、K3=10-5.83,则H3A的第三步电离常数的数量级为10-6,选项A错误;
B.b点溶液中c(H2A-)= c(HA2-),溶液中存在电荷守恒:c(Na+)+c(H+)= c(H2A-)+2 c(HA2-)+3c(A3-)+c(OH-)=3c(H2A-)+3c(A3-)+c(OH-),选项B正确;
C.NaH2A的水解常数和电离常数分别为、10-4.58,以电离为主,溶液显酸性;Na2HA的水解常数和电离常数分别为、10-5.83,也以电离为主,溶液也显酸性;选项C错误;
D.醋酸的PKa=4.76,即Ka=10-4.76,则酸性由强到弱的顺序为H3A>H2A->CH3COOH>HA2-,因此醋酸钠与少量丙三酸反应的离子方程式为2CH3COO-+H3A=2 CH3COOH+ HA2-,选项D错误;
答案选B。
7.C
【详解】①加固体,铵离子浓度增大,平衡左移,不符合;
②加NaOH溶液,氢氧根离子浓度增大,平衡左移,不符合;
③通HCl,消耗氢氧根离子,平衡右移,符合;
④加溶液,消耗氢氧根离子,平衡右移,符合;
⑤加水,稀释促进电离,平衡右移,符合;
⑥加压,对平衡没有影响,不符合;
则C正确;答案选C。
8.C
【详解】A.将少量SO2气体通入足量的NaClO溶液中反应生成硫酸根离子和次氯酸、氯离子,离子反应方程式,A正确;
B.向偏铝酸钠溶液中加入小苏打溶液,碳酸氢根离子和偏铝酸根离子生成氢氧化铝沉淀和碳酸根离子:,B正确;
C.向溶液中滴加溶液至刚好完全沉淀,则氢氧根离子部分和氢离子反应生成水,,C错误;
D.稀硝酸中加入过量的铁屑生成硝酸亚铁和水、NO,离子反应方程式,D正确;
故选C。
9.A
【详解】醋酸溶液中存在电离平衡CH3COOH CH3COO-+H+;
A.加入NaOH,消耗H+,c(H+)减小,平衡正向移动,CH3COO-浓度增大,但不产生气体,选项A符合;
B.加入NaHCO3,消耗H+,反应生成二氧化碳气体,平衡正向移动,CH3COO-浓度增大,选项B不符合;
C.加入Na2CO3消耗H+,反应生成二氧化碳气体,平衡正向移动,CH3COO-浓度增大,选项C不符合;
D.加入Mg消耗H+,反应生成H2,平衡正向移动,CH3COO-浓度增大,选项D不符合;
答案选A。
10.D
【详解】①加入CH3COONa固体,CH3COO-的浓度,平衡CH3COOHH++CH3COO-逆向移动,H+的浓度减小,符合题意;
②适当升高温度,电离平衡CH3COOHH++CH3COO-正向移动,CH3COO-的浓度、H+的浓度均增大,不符合题意;
③加冰醋酸,醋酸浓度增大,电离平衡CH3COOHH++CH3COO-正向移动,CH3COO-的浓度、H+的浓度均增大,不符合题意;
④加入少量NaOH固体,OH-浓度增大,电离平衡CH3COOHH++CH3COO-正向移动,CH3COO-的浓度增大、消耗H+,浓度减小,符合题意;
答案选D。
11. 在“O”点处醋酸未电离,无离子存在 c
(2)c(H+)越大,溶液导电性越强,根据图知,导电性强弱顺序是b>a>c,则c(H+)由小到大的顺序c<a<b;
(3)同一电解质水溶液,其浓度越小,电解质电离程度越大,根据图知,溶液浓度:a>b>c,则电离程度a<b<c,故答案为:c;
(4)A.加热促进醋酸电离,则c(CH3COO-)增大,故A不选;
B.加入锌粒促进醋酸电离,导致溶液中c(CH3COO-)增大,故B不选;
C.加入KOH固体促进醋酸电离,则溶液中c(CH3COO-)增大,故C不选;
D.加水稀释促进醋酸电离,但是醋酸电离程度增大小于溶液体积增大程度,则c(CH3COO-)减小,故D选;
E.加入CH3COONa固体,醋酸钠电离导致溶液中c(CH3COO-)增大,故E不选;
故答案为:D。
12. ①⑥⑦ ⑧⑩ ②⑤ ③ ⑩
【分析】(1)根据强电解质、弱电解质和非电解质的定义和物质类别进行判断;
(2)根据盐酸发生完全电离而醋酸部分电离进行分析解题。
【详解】(1)强电解质是指在水溶液中发生完全电离的电解质,强酸、强碱和大多数盐均为强电解质;弱电解质则是在水溶液中发生部分电离的电解质,弱酸、弱碱和水均为强电解质;而在水溶液和熔融状态下均不能导电的化合物为非电解质,大多数有机物、非金属氧化物属于非电解质,同时注意单质和混合物既不是电解质也不是非电解质,故在①氯化钾 ②乙醇 ③盐酸 ④Na2O ⑤SO2⑥HBr ⑦硫酸氢钠 ⑧一水合氨 ⑨氯气 ⑩冰醋酸等物质中,强电解质的是①⑥⑦,属于弱电解质的是⑧⑩,属于非电解质的是②⑤,故答案为:①⑥⑦;⑧⑩;②⑤;
(2)由于盐酸完全电离,醋酸则是部分电离,故体积、浓度相等的③和⑩的溶液即盐酸和醋酸溶液中c(H+)是盐酸大于醋酸,加入形状相同且足量的Zn粒,故反应速率快的是盐酸③;体积、pH相同的③和⑩的溶液即盐酸和醋酸溶液中c(H+)相等,但是溶质的物质的量浓度是醋酸大于盐酸,生成氢气体积最多的是醋酸⑩,故答案为:③;⑩。
13.3.45×10-5
【详解】0.01ml/L 乙酰水杨酸水溶液中其电离度是5.7%,那么电离的乙酰水杨酸为5.7×10-4ml/L,乙酰水杨酸根(A-)和H+的浓度都是出5.7×10-4ml/L,乙酰水杨酸(HA)的浓度(0.01-5.7×10-4)ml/L,所以电离常数为(5.7×10-4)2/(0.01-5.7×10-4) = 3.45×10-5。
14.(1) 2△H1-3△H2-△H3 +3 H3AsO4H++H2AsO
(2) 沉淀过量的S2-,使As2O3(a)+3S2-(aq)⇌2AsS (aq) 平衡左移,提高沉砷效果 H3AsO3+H2O2=H3AsO4+H2O 起氧化作用的物质是次氯酸,NaClO溶液为碱性,当加入量大时,溶液碱性增强,NaClO溶液浓度增大,水解程度降低,次氯酸不易生成,所以As(Ⅲ)氧化率降低
【解析】(1)
I.①As(s)+ H2(g)+2O2(g)=H3AsO4(s) ΔH1,②H2(g)+ O2(g)=H2O(l) ΔH2,③2As(s)+ O2(g) =As2O5(s) ΔH3,根据盖斯定律,将①×2-②×3-③得:As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =2△H1-3△H2-△H3,故答案为2△H1-3△H2-△H3;
亚砷酸(H3AsO3)中,氧元素化合价为-2价,氢元素化合价为+1价,砷元素化合价设为x,+1×3+x+(-2)×3=0,x=+3;第ⅤA族非金属元素形成最高价含氧酸中磷、砷形成的含氧酸都是弱酸,水溶液中分步电离,电离方程式为:H3AsO4⇌H++H2AsO,故答案为+3;H3AsO4⇌H++H2AsO;
(2)
“一级沉砷”中FeSO4的作用是除去过量的硫离子,As2S3+3S2-⇌2AsS使平衡逆向进行,提高沉砷效果,“二级沉砷”中H2O2与含砷物质发生氧化还原反应,氧化亚砷酸为砷酸;,反应的化学方程式为:H2AsO3+H2O2=H3AsO4+H2O,故答案为沉淀过量的硫离子,使As2S3+3S2-⇌2AsS使平衡逆向进行,提高沉砷效果;H2AsO3+H2O2=H3AsO4+H2O;
III.投料前水样pH=5.81,0.1ml/LNaClO溶液pH=10.5,溶液中起氧化作用的物质是次氯酸.产生此结果的原因是:起氧化作用的物质是次氯酸,NaClO溶液为碱性,当加入量大时,溶液碱性增强,NaClO溶液浓度增大,水解程度降低,次氯酸不易生成,所以As(Ⅲ)氧化率降低,故答案为起氧化作用的物质是次氯酸,NaClO溶液为碱性,当加入量大时,溶液碱性增强,NaClO溶液浓度增大,水解程度降低,次氯酸不易生成,所以As(Ⅲ)氧化率降低。
15. 增大 a cd > > >
【详解】(1)升高温度促进弱电解质的电离,所以当温度升高时,Ka增大;因此本题答案是:增大。
(2)电离平衡常数越大,越易电离,溶液中离子浓度越大,则酸性强弱为:CH3COOH>H2CO3>HClO>HCO3-,酸根离子对应的酸的酸性越强,酸根离子结合氢离子的能力越弱,则四种离子结合质子的能力由大到小的顺序是:CO32->ClO->HCO3->CH3COO-,即a>b>d>c;因此本题答案是:a。
(3)a.CO32-+CH3COOH=CH3COO-+CO2↑+H2O:碳酸的酸性小于CH3COOH,所以CH3COOH能够制取碳酸,该反应能够发生,故a错误;
b.ClO-+CH3COOH=CH3COO-+HClO:CH3COOH的酸性大于HClO,CH3COOH能够制取HClO,该反应能够发生,故b错误;
c.CO32-+HClO=CO2↑+H2O+ClO-:HClO的酸性小于碳酸,该反应无法发生,故c正确;
d.2ClO-+CO2+H2O=CO32-+2HClO:由于酸性H2CO3>HClO>HCO3-,则碳酸与次氯酸根离子反应只能生成碳酸氢根离子,不会生成CO32-,该反应不能发生,故d正确;综上所述,本题答案是:cd。
(4)加水稀释促进弱酸电离,pH相同的不同酸稀释相同的倍数,pH变化大的酸酸性强,变化小的酸酸性弱;酸或碱抑制水电离,酸中氢离子或碱中氢氧根离子浓度越大其抑制水电离程度越大;根据图知,pH相同的醋酸和HX稀释相同的倍数,HX的pH变化大,则HX的酸性大于醋酸,所以HX的电离平衡常数大于醋酸的电离平衡常数;稀释后醋酸中氢离子浓度大于HX,所以醋酸抑制水电离程度大于HX,则HX溶液中水电离出来的c(H+)大于醋酸溶液水电离出来c(H+);pH=2的HX和醋酸,HX的酸性大于醋酸,所以醋酸的浓度大于HX,因此等体积的两种酸,醋酸的量多,因此用同浓度的NaOH溶液分别中和上述两种酸溶液,恰好中和时消耗NaOH溶液的体积:醋酸大于HX;综上所述,本题答案是:> ;> ;>。
【点睛】浓度、体积相同的盐酸和醋酸,溶质的总量相等,但是溶液中的氢离子的量盐酸多,但是同浓度同体积的醋酸和盐酸中和氢氧化钠的能力是完全一样的;氢离子浓度相同、体积相同的盐酸和醋酸,溶液中氢离子的浓度相同,但是溶质的总量醋酸多,但是同体积、pH相同的醋酸和盐酸,中和氢氧化钠的能力醋酸强。
16. HNO2⇌H++NO2- 加成反应 < 过程ⅰ
【分析】(1)由亚硝酸的电离常数的数值可知,它是一种一元弱酸;
(2)亚硝酸属于共价化合物,据此书写电子式;
(3)①亚硝酸分子中含有氮氧双键,过程ⅰ的反应中生成物 氮氧双键消失,变为氮氧单键,过程ⅱ中 中脱去一个羟基和氢原子,形成氮氧双键,结合有机物的反应类型分析;
②根据盖斯定律分析,化学反应的热效应只与起始和终了状态有关,与变化途径无关分析判断;活化能越大,反应进行的越慢,反应难度越大。
【详解】(1)由亚硝酸的电离常数的数值可知,它是一种一元弱酸,在溶液中部分电离,电离方程式为HNO2⇌H++NO2-;
(2)亚硝酸属于共价化合物,分子中各原子最外层电子均达到稳定结构,其电子式为 ;
(3)①亚硝酸分子中含有氮氧双键,过程ⅰ的反应中生成物 氮氧双键消失,变为氮氧单键,可以看作 中的氮氢键断裂,分别加成在亚硝酸分子的氮氧双键两端,可以看作是加成反应,过程ⅱ中 中脱去一个羟基和氢原子,形成氮氧双键,可以看作有机反应中醇羟基的消去反应;
②根据盖斯定律分析,化学反应的热效应只与起始和终了状态有关,与变化途径无关,根据图示,反应物的总能量大于生成物的总能量,该反应属于放热反应,ΔH<0;活化能是指分子从常态转变为容易发生化学反应的活跃状态(过渡态)所需要的能量。活化能越大,反应进行的越慢,反应难度越大,根据图示,过程ⅰ的活化能大于过程ⅱ的活化能,则过程ⅰ的反应难度更大。
17. HCNH++CN- [Au(CN)2]-AuCN+CN- 5ClO-+2CN-+2OH-=2CO+N2+H2O+5Cl- 生成剧毒物HCN,对人体有害 ClO-+CO2+H2O=HClO+HCO
【分析】弱电解质不能完全电离,电离方程式用可逆符号;多元弱酸分步电离,第一步电离相对于第二步电离电离程度大;在配平氧化还原反应时,可以根据得失电子总数相等进行配平;弱酸的电离平衡常数越小,说明结合氢离子能力越强,据此分析解答。
【详解】(1)HCN是弱电解,部分电离,电离方程式:HCNH++CN-,故答案为:HCNH++CN-;
(2)与弱电解质的电离方程式相似,[Au(CN)2]+也存在着两步电离,第一步电离出一个CN-,电离方程式为[Au(CN)2]-AuCN+CN-,故答案为:[Au(CN)2]-AuCN+CN-;
(3)处理这种废水是在碱性条件下,NaClO将CN-氧化为二氧化碳和氮气,碱性条件下生成生成碳酸根离子,根据得失电子守恒配平反应得:5ClO-+2CN-+2OH-=2CO+N2+H2O+5Cl-,在酸性条件下,考虑CN-与氢离子结合,生成极弱的毒性非常强的HCN,故答案为:5ClO-+2CN-+2OH-=2CO+N2+H2O+5Cl-;在酸性条件下CN-与氢离子结合,生成毒性非常强的HCN;
(4)电离平衡常数越小,结合氢离子的能力越强,则在NaClO溶液中通入少量的CO2生成次氯酸和碳酸氢钠,离子方程式为:ClO-+CO2+H2O=HClO+HCO,故答案为:ClO-+CO2+H2O=HClO+HCO。
18.(1)H2CO3H++HCO HCOH++CO
(2)H2SH++HS- HS-H++S2-
(3)NaHCO3=Na++HCO HCOH++CO
(4)NaHSO4=Na++H++SO
(5)HClOH++ClO-
【解析】(1)
H2CO3是一种多元弱酸,故其只能部分电离,且是分步进行的,则电离方程式为:H2CO3H++HCO HCOH++CO,故答案为:H2CO3H++HCO HCOH++CO;
(2)
H2S是一种多元弱酸,故其只能部分电离,且是分步进行的,则电离方程式为:H2SH++HS- HS-H++S2-,故答案为:H2SH++HS- HS-H++S2-;
(3)
NaHCO3是一种弱酸的酸式盐,故其电离方程式为:NaHCO3=Na++HCO HCOH++CO,故答案为:NaHCO3=Na++HCO HCOH++CO;
(4)
NaHSO4是一种强酸的酸式盐,故其电离方程式为:NaHSO4=Na++H++SO,故答案为:NaHSO4=Na++H++SO;
(5)
HClO是一元弱酸,故其电离方程式为:HClOH++ClO-,故答案为:HClOH++ClO-。
19. abde b×10-7/(a-b)
【详解】试题分析:本题考查恒温恒压下的等效平衡规律,化学平衡的标志,电离平衡常数的计算。
(1)tl时刻达到平衡状态后,继续充入2 ml NH3,在恒温恒压容器中,逆反应速率突然变大,正反应速率突然变小,2mlNH3采用一边倒极限换算后为1mlN2和3mlH2,在恒温恒压下达到的平衡与原平衡互为等效平衡,t2达到平衡时υ(正)和υ(逆)与原平衡相等,图象为。
(2)合成氨的反应为N2+3H22NH3。a项,达到平衡时各组分的浓度不再发生变化,但不一定等于化学计量数之比,容器内N2、H2、NH3的浓度之比为1 : 3 : 2时各物质的浓度不一定保持不变,不一定是平衡状态;b项,υ(N2)(正)=3υ(H2)(逆),用N2表示的正反应速率与用H2表示的逆反应速率之比为3:1,不等于化学计量数之比,没有达到平衡状态;c项,恒温恒容时气体的压强与气体物质的量成正比,该反应的正反应为气体分子数减小的反应,建立平衡过程中气体物质的量减小,容器内压强减小,达到平衡时气体物质的量不变,容器内压强不变,容器内压强保持不变能作为平衡的标志;d项,混合气体的密度=,该反应中所有物质都是气体,气体总质量始终不变,恒容容器体积始终不变,混合气体的密度始终不变,混合气体的密度保持不变不能作为平衡的标志;e项,单位时间内断裂6ml N-H键的同时一定有3mlH-H形成,只描述了逆反应,不能作为平衡的标志;答案选abde。
(3)25℃时,氨水与盐酸混合后溶液呈中性,c(H+)=c(OH-)=110-7ml/L;溶液中存在电荷守恒c(NH4+)+c(H+)=c(OH-)+c(Cl-),则c(NH4+)=c(Cl-)=ml/L;根据N原子守恒,溶液中c(NH3·H2O)=ml/L-ml/L=()ml/L,NH3·H2O的电离平衡常数Kb==110-7()= b×10-7/(a-b)。
【点睛】本题第(2)问是判断可逆反应达到化学平衡的标志。判断可逆反应是否达到平衡状态的标志是“逆向相等,变量不变”,“逆向相等”指必须有正反应速率和逆反应速率且两者相等,“变量不变”指可变的物理量不变是平衡的标志,不变的物理量不变不能作为平衡的标志。
20.(1)氢氧化钠
(2)<
(3)b>a=c
【详解】(1)相同体积、相同的氨水和溶液加水稀释,氢氧根浓度都降低,由于氨水又电离,因此加入相同水时,氨水中的氢氧根浓度大于氢氧化钠溶液的氢氧根浓度,氨水的pH值大于氢氧化钠,因此根据图中信息点所在曲线对应的是氢氧化钠;故答案为:氢氧化钠。
(2)、两点溶液,由于氨水的物质的量大于氢氧化钠的物质的量,与同一浓度的盐酸完全反应时,消耗盐酸体积:<;故答案为:<。
(3)b点pH值大,溶液的离子浓度大,导电性强,a、c两点pH值相同,离子浓度相同,导电性相同,因此、、三点溶液导电能力由大到小排序b>a=c;故答案为:b>a=c。
21.(1) 正确 CaCO3+2CH3COOH=Ca(CH3COO)2+CO2↑+H2O
(2) 试管中溶液出现浑浊
(3)在装置A和B之间连一个盛有饱和碳酸氢钠溶液的洗气瓶
(4)用量筒量取一定体积的乙酸溶液,加蒸馏水稀释100倍,用pH试纸测其pH,pH<5,则证明乙酸是弱酸(或其他合理答案)
(5)bdac
【详解】(1)左管液面高于右管液面,静置一段时间后,若U形管两侧液面差不发生变化,说明装置气密性良好,所以该生的操作正确;大理石与乙酸溶液反应生成乙酸钙、二氧化碳和水,则化学方程式为:CaCO3+2CH3COOH=Ca(CH3COO)2+CO2↑+H2O;故答案为正确;CaCO3+2CH3COOH=Ca(CH3COO)2+CO2↑+H2O。
(2)装置A中反应产生的气体为CO2,通入苯酚钠溶液中,生成常温下溶解度较小的苯酚,所以实验现象为:试管中溶液出现浑浊;苯酚钠与CO2、H2O反应生成苯酚和NaHCO3,则反应的离子方程式为:;故答案为试管中溶液出现浑浊;。
(3)为防止挥发出的乙酸与苯酚钠反应,所以应在装置A和B之间连一个吸收乙酸的装置,所以改进该装置的方法是:在装置A和B之间连一个盛有饱和碳酸氢钠溶液的洗气瓶;故答案为在装置A和B之间连一个盛有饱和碳酸氢钠溶液的洗气瓶。
(4)强酸溶液完全电离,弱酸溶液存在电离平衡,加水稀释,电离平衡向右移动,所以证明乙酸为弱酸的最简便的使用方法为:用量筒量取一定体积的乙酸溶液,加蒸馏水稀释100倍,用pH试纸测其pH,pH<5,则证明乙酸是弱酸;故答案为用量筒量取一定体积的乙酸溶液,加蒸馏水稀释100倍,用pH试纸测其pH,pH<5,则证明乙酸是弱酸(或其他合理答案)。
(5)根据盐类水解规律,越弱越水解,对应的酸越弱,水解程度越大,溶液的pH越大,所以pH由大到小排列的顺序为:bdac;故答案为bdac。
22.(1)红色变浅
(2)
(3)
【分析】弱酸HF在水溶液中部分发生电离,存在电离平衡;
【详解】(1)取一定体积的溶液,滴入2滴紫色石蕊溶液,显红色,再加入固体,氟离子浓度变大,促使逆向移动,观察到的现象是红色变浅,则证明为弱酸。
(2)稀释100倍的过程中,平衡正向移动,使得氢离子物质的量增大,使得氢离子大于开始溶液中氢离子浓度的百分之一,故导致;
(3),室温下的溶液的为2,则、,故室温下的电离平衡常数约为。
23. 关闭分液漏斗的旋塞,将C装置中的导管插入烧杯中的水面下,微热烧瓶,导管口有气泡产生,停止加热,导管口形成一段水柱,则气密性良好 C Na2S2O4(s)2Na+(aq)+S2O(aq),加入固体NaC1,增大Na+浓度,平衡左移,促进Na2S2O4析出 甲醇 密封、干燥保存 三颈瓶 OH-+HCOO-+2SO2=S2O+CO2+H2O 7 甲酸钠法工艺操作简单;锌粉法中使用的锌粉价格较高,甲酸钠法的原料价格低;锌粉法废液中锌离子对环境有较大污染,甲酸钠法没有废液产生
【分析】I.由实验室模拟锌粉法的装置可知,装置A为二氧化硫制备装置,将制得的二氧化硫通入到装置B中,二氧化硫与锌反应生成ZnS2O4,待反应完全后,向三颈烧瓶中加入NaOH溶液,生成Na2S2O4和Zn(OH)2;将B中所得化合物过滤,得到Na2S2O4溶液,向溶液中加入固体NaC1,促进Na2S2O4析出,当Na2S2O4完全析出后,过滤、洗涤、干燥制得Na2S2O4晶体;
II.由实验室模拟甲酸钠法的装置可知,装置E为二氧化硫制备装置,将制得的二氧化硫通入到装置B中,碱性条件下,二氧化硫与甲酸钠发生氧化还原反应生成Na2S2O4、二氧化碳和水;将所得混合物过滤、洗涤、干燥制得Na2S2O4晶体。
【详解】(1)连接好装置后,检验装置的气密性的操作为关闭分液漏斗的旋塞,将C装置中的导管插入烧杯中的水面下,微热烧瓶,导管口有气泡产生,停止加热,导管口形成一段水柱,则气密性良好,故答案为:关闭分液漏斗的旋塞,将C装置中的导管插入烧杯中的水面下,微热烧瓶,导管口有气泡产生,停止加热,导管口形成一段水柱,则气密性良好;
(2)①制备二氧化硫时,若选用稀硫酸,二氧化硫易溶于水,不利于二氧化硫气体逸出,若选用98%浓硫酸,溶液中氢离子浓度小,反应速率慢,则为加快反应速率,有利于二氧化硫气体逸出,应选用70%较浓硫酸,C正确,故答案为:C;
②Na2S2O4在溶液中存在如下溶解平衡:Na2S2O4(s)2Na+(aq)+S2O(aq),加入氯化钠固体,溶液中钠离子浓度增大,溶解平衡向左移动,有利于Na2S2O4晶体析出;由Na2S2O4易溶于水,难溶于甲醇可知,为减少Na2S2O4溶于水降低产率,应选用甲醇洗涤,故答案为:Na2S2O4(s)2Na+(aq)+S2O(aq),加入固体NaC1,增大Na+浓度,平衡左移,促进Na2S2O4析出;甲醇;
(3)由Na2S2O4易溶于水,具有极强的还原性,易被空气氧化可知,保存新制Na2S2O4晶体应采用密封、干燥的方法保存,故答案为:密封、干燥保存;
(4)由实验装置图可知,装置F为三颈烧瓶;装置F中发生的反应为碱性条件下,二氧化硫与甲酸钠发生氧化还原反应生成Na2S2O4、二氧化碳和水,反应的离子方程式为OH-+HCOO-+2SO2=S2O+CO2+H2O,故答案为:三颈烧瓶;OH-+HCOO-+2SO2=S2O+CO2+H2O;
(5)由H2SO3的电离常数为K2=可知,该温度下当G溶液中HSO、SO离子浓度相等时,溶液中c(H+)=K2=1.0×10-7ml/L,则溶液pH=7,故答案为:7;
(6)由甲酸钠法和锌粉法的反应原理可知,甲酸钠法的工艺操作比锌粉法简单,锌粉法中使用的锌粉价格较高,甲酸钠法的原料价格低,甲酸钠法的经济效益大,锌粉法废液中锌离子对环境有较大污染,而甲酸钠法没有废液产生,故答案为:甲酸钠法工艺操作简单;锌粉法中使用的锌粉价格较高,甲酸钠法的原料价格低;锌粉法废液中锌离子对环境有较大污染,甲酸钠法没有废液产生。
苏教版 (2019)选择性必修1第一单元 弱电解质的电离平衡同步达标检测题: 这是一份苏教版 (2019)选择性必修1第一单元 弱电解质的电离平衡同步达标检测题,共21页。试卷主要包含了单选题,填空题,实验探究题等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修1第一单元 弱电解质的电离平衡练习: 这是一份高中化学苏教版 (2019)选择性必修1第一单元 弱电解质的电离平衡练习,共24页。试卷主要包含了单选题,填空题,实验探究题等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第四章 化学反应与电能第三节 金属的腐蚀与防护达标测试: 这是一份高中化学人教版 (2019)选择性必修1第四章 化学反应与电能第三节 金属的腐蚀与防护达标测试,共25页。试卷主要包含了单选题,填空题,实验探究题等内容,欢迎下载使用。













