
人教版化学九年级上册同步精品讲义《物质构成的奥秘》全章复习与巩固练习(基础) 知识讲解
展开《物质构成的奥秘》全章复习与巩固(基础)
责编:熊亚军
【学习目标】
1.掌握分子的性质和用粒子的观点解释某些常见的现象。
2.知道分子、原子、离子等是构成物质的微观粒子,知道它们的相互关系及原子的内部结构。
3.能认识并记住一些常见元素的名称和符号,知道元素的简单分类,初步认识元素周期表。
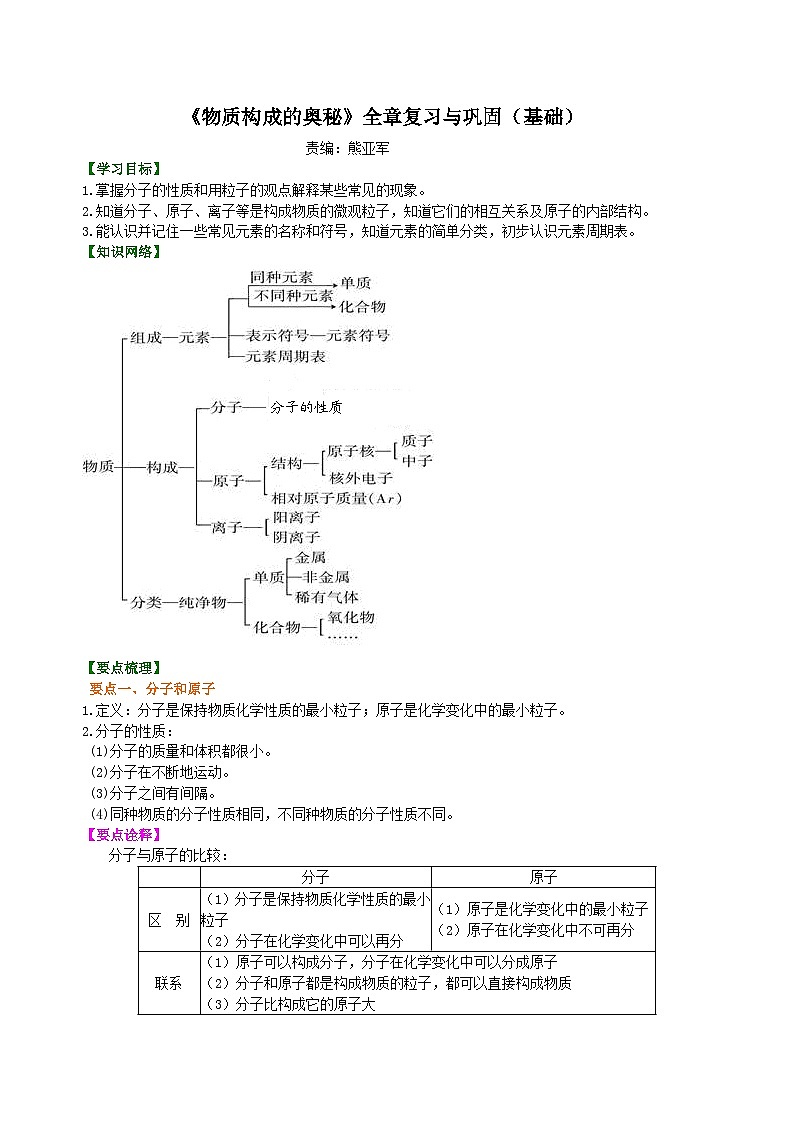
【知识网络】
【要点梳理】
要点一、分子和原子
1.定义:分子是保持物质化学性质的最小粒子;原子是化学变化中的最小粒子。
2.分子的性质:
(1)分子的质量和体积都很小。
(2)分子在不断地运动。
(3)分子之间有间隔。
(4)同种物质的分子性质相同,不同种物质的分子性质不同。
【要点诠释】
分子与原子的比较:
| 分子 | 原子 |
区 别 | (1)分子是保持物质化学性质的最小粒子 (2)分子在化学变化中可以再分 | (1)原子是化学变化中的最小粒子 (2)原子在化学变化中不可再分 |
联系 | (1)原子可以构成分子,分子在化学变化中可以分成原子 (2)分子和原子都是构成物质的粒子,都可以直接构成物质 | |
要点二、从分子的观点理解有关概念
1.物理变化和化学变化:由分子构成的物质,发生物理变化时,分子本身没有发生变化,当物质发生化学变化时,分子本身发生了改变,生成了其他物质的分子。
2.纯净物和混合物:从分子的观点看,由同种分子构成的物质是纯净物;由多种分子构成的物质是混合物。
【要点诠释】
物理变化和化学变化的本质区别在于变化后分子是否发生了改变。
要点三、原子的构成
原子是由居于原子中心带正电的原子核和核外带负电的电子构成,原子核又是由质子和中子构成,质子带正电,中子不带电;原子核所带正电荷(核电荷数)和核外电子所带负电荷相等,但电性相反,所以整个原子不显电性。
【要点诠释】
记住两个等量关系:核电荷数==质子数==核外电子数;相对原子质量≈质子数+中子数。
要点四、元素和元素符号
1.元素:就是具有相同核电荷数(即核内质子数)的一类原子的总称。
2.元素符号书写方法:(1)由一个字母表示的元素符号要大写;(2)由两个字母表示的元素符号,第一个字母大写,第二个字母小写。
【要点诠释】
元素和原子的比较:
| 元素 | 原子 |
概念 | 具有相同核电荷数的一类原子的总称 | 化学变化中的最小粒子 |
区分 | 只讲种类,不讲个数,没有数量多少的意义 | 既讲种类,又讲个数,有数量多少的含义 |
使用范围 | 用于描述物质的宏观组成 | 用于描述物质的微观构成 |
举例 | 水中含有氢元素和氧元素(或水是由氢元素和氧元素组成的) | 一个水分子,是由两个氢原子和一个氧原子构成的 |
要点五、核外电子的分层排布
核外电子是在不同的电子层内运动的,人们又把这种现象叫做核外电子的分层排布。离原子核较近的第一层不超过2个电子,第二层不超过8个电子……最外层不超过8个电子。
【要点诠释】
元素的化学性质主要由最外层电子数决定:
元素分类 | 金属元素 | 非金属元素 | 稀有气体元素 |
最外层电子数 | 较少(一般少于4个) | 较多(一般4~7个) | 8个(氦是2个) |
得失电子倾向 | 易失去最外层电子 | 易得到电子 | 相对稳定、不易得失电子 |
化学性质 | 不稳定 | 不稳定 | 稳定 |
要点六、离子
离子:带电荷的原子(或原子团)叫离子,如Na+、、等。
【要点诠释】
离子和原子的比较:
粒子种类 | 原子 | 离子 | ||
阳离子 | 阴离子 | |||
区 别 | 粒子结构 | 质子数=电子数 | 质子数>电子数 | 质子数<电子数 |
粒子电性 | 不显电性 | 显正电性 | 显负电性 | |
符号 | 用元素符号表示 | 用阳离子符号表示 | 用阴离子符号表示 | |
举 例 | ||||
联 系 | ||||
【典型例题】
类型一、考查分子、原子的概念及性质应用
1.(漳州模拟)下列关于原子的叙述中,不正确的是( )
| A. | 原子可以构成分子 |
| B. | 原子是化学反应中的最小微粒 |
| C. | 原子是由原子核和核外电子构成的 |
| D. | 原子的质量就是相对原子质量 |
【思路点拨】可以根据原子的特征方面以及构成方面进行分析、判断,从而得出正确的结论。
【答案】D
【解析】原子可以结合成分子,故A正确;原子在化学变化中是最小的粒子,不能再分,故B正确;所有的原子都是由原子核与核外电子构成,故C正确;相对原子质量是原子的质量与碳原子质量的比较而得,故D错误;故选D。
【总结升华】学生应熟悉微观粒子的性质,认识在各种形态和变化中微粒的变化是解题的关键。
2.右图中不同的球代表不同元素的原子。
下列说法中错误的是( )
A.反应前后原子种类不变
B.反应后生成了两种新的分子
C.反应类型为化合反应
D.反应前后分子本身发生了改变
【答案】C
【解析】由反应示意图可知:化学反应前后,分子本身发生了改变,生成了其他物质的分子,原子的种类没有变化;此图示为一种物质分解生成两种物质,符合分解反应的定义,不属于化合反应。
【总结升华】正确理解图示的含义是解题的关键。
举一反三:
【变式】下列现象或事实,用分子的相关知识加以解释,其中不正确的是( )
| 现象或事实 | 解释 |
A | 热胀冷缩 | 分子之间间隔随温度改变而改变 |
B | 酒香不怕巷子深 | 分子的质量和体积都很小 |
C | 氧气可供人呼吸,一氧化碳有毒 | 构成物质的分子不同,物质的性质不同 |
D | 水通电后生成氢气和氧气 | 在化学变化中分子可以再分 |
【答案】B
类型二、考查元素、原子和离子
3.在“5. 12汶川大地震”抗震救灾现场,自贡市疾病预防控制中心的防疫人员受到了胡锦涛总书记的接见,当时他们正在喷洒“含氯消毒液”。 “含氯消毒液”中的“氯”在这里指的是 ( )
A.元素 B.原子 C.分子 D.离子
【答案】A
【解析】“含氯消毒液”中的“氯”在这里指的是元素。
【总结升华】利用元素的知识可以解决生活中的很多问题,如食品标签上标明了一些元素的含量,在这里一般是指元素。
4.已知一种锶原子的相对原子质量为88,其质子数是38,则这种锶原子的核外电子数为( )
A.38 B.50 C.88 D.126
【答案】A
【解析】质子数==核外电子数,锶原子质子数为38,核外电子数也是38。
【总结升华】要记住以下等量关系:核电荷数==核内质子数==核外电子数,相对原子质量≈质子数+中子数。
5.下列关于分子、原子、离子的说法中,错误的是( )
A.分子、原子、离子都能构成物质
B.在化学反应过程中,原子的种类、数目均不改变
C.水是由氢、氧两种原子直接构成的
D.物质的热胀冷缩现象是分子间隔的大小随温度而改变的缘故
【答案】C
【解析】水是由水分子构成的,不是由氢氧两种原子直接构成的。
【总结升华】分子、原子、离子都是构成物质的粒子,都可以保持物质的化学性质。在化学变化中,原子的种类、数目和质量都不改变。
6.根据对木炭、硫、铁在氧气中燃烧的实验(如下图所示)的回忆,按要求回答问题。
(1)碳原子的结构示意图为,该原子的核电荷数是 6,最外层上有 4个电子。
(2)硫在氧气中燃烧的现象为 。发出蓝紫色火焰,产生有刺激性气味的气体
(3)做铁丝在氧气中燃烧时,如果没有预先在集气瓶内装少量的水或细沙子,可能产生的后果是 。
集气瓶炸裂(4)在这三个实验中,氧气提供氧,具有 氧化性。
【答案】(1)6 4
(2)发出蓝紫色火焰,产生有刺激性气味的气体
(3)集气瓶炸裂
(4)氧化
【解析】
(1)根据原子的结构示意图,核内质子数为6;根据核电荷数即质子数,则核电荷数为6;距核最远的电子层为最外层,有4个电子。
(2)硫在氧气中燃烧的现象为:发出蓝紫色火焰,产生有刺激性气味的气体。
(3)做铁丝在氧气中燃烧时,要先在集气瓶内装少量的水或细沙,防止生成的高温熔融物炸裂集气瓶底。
(4)在这三个实验中,氧气提供氧,具有氧化性。
【总结升华】在原子中,核电荷数=质子数=核外电子数,原子呈电中性(即不显电性)。
举一反三:
【变式1】(江苏扬州)以下物质由离子构成的是( )
A.蒸馏水 B.氯化钠 C.金刚石 D.氧气
【答案】B
【变式2】某矿泉水标签上印有的主要矿物质成分及含量如下(单位为mg/L):Ca-20、K-3、Zn-0.06等。这里的Ca、K、Zn是指( )
A.原子 B.分子 C.单质 D.元素
【答案】D
【变式3】如图所示是某元素的原子结构示意图,该原子在化学反应中容易 得电子(填“得”或“失”),所形成粒子的符号是 。
Cl-
MgCl2【答案】得 Cl-
【解析】原子最外层电子数是7,所以易得一个电子,形成带一个单位负电荷的氯离子。









