人教版 (2019)必修 第一册第三节 化学键精品巩固练习
展开常见考点
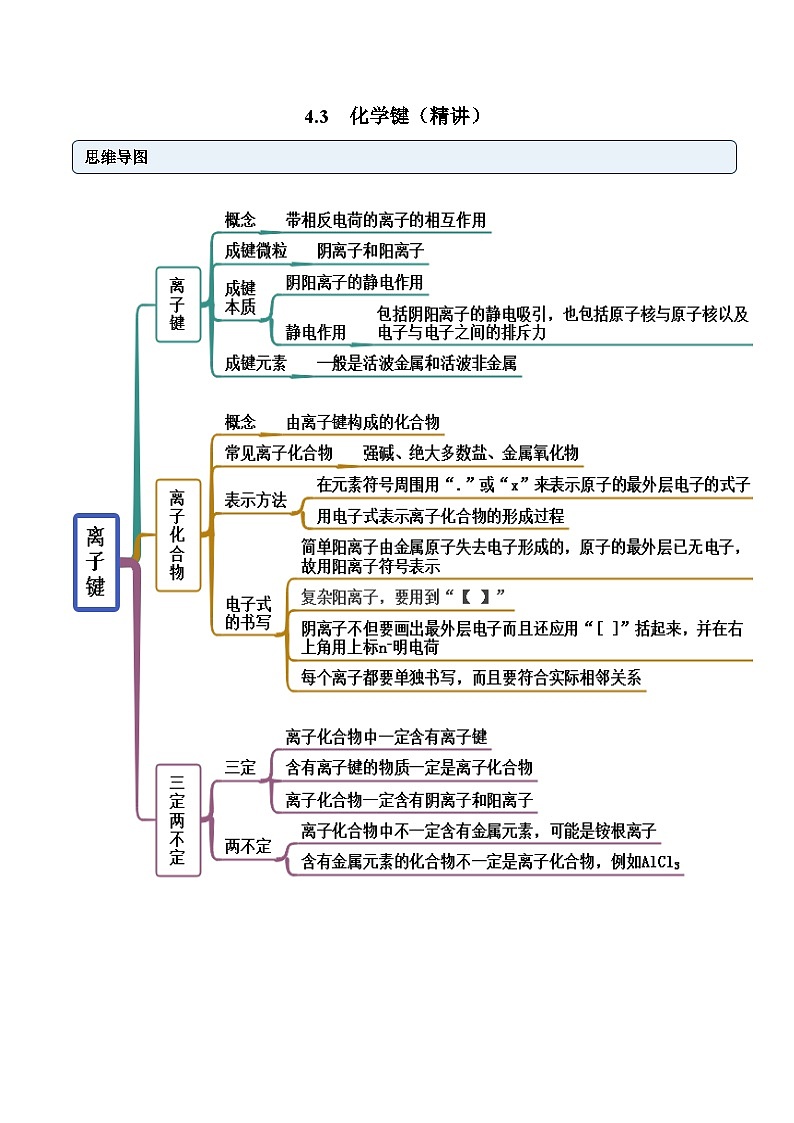
考点一 离子键
【例1-1】下列各数值表示有关元素的原子序数,其所表示的各原子间能形成离子键的是( )
A.10和19B.6和16C.14和8D.11和17
【答案】D
【解析】A.原子序数为10和19的元素为Ne和K,Ne为稀有气体元素,难以形成化合物,A与题意不符;
B.原子序数为6和16的元素为C和S,可形成二硫化碳,共价化合物,B与题意不符;
C.原子序数为14和8的元素为Si和O,都为非金属元素,可形成二氧化硅,为共价化合物,C与题意不符;
D.原子序数为11和17的元素为Na和Cl,能形成氯化钠,为离子化合物,存在离子键,D符合题意;
答案为D。
【例1-2】用电子式表示下列离子化合物的形成过程。
(1)碘化钙:____________。
(2)硫化钠:____________。
(3)氯化钾:____________。
【答案】(1)
【解析】(1)Ca最外层有2个电子,I最外层有7个电子,1个Ca失去最外层的2个电子,被2个I得到,每个I最外层均达到8电子稳定结构,故其形成过程可表示为;
(2)Na最外层有1个电子,S最外层有6个电子,2个Na各失去最外层的1个电子成为 SKIPIF 1 < 0 ,1个S得到2个电子成为 SKIPIF 1 < 0 ,进而通过离子键形成 SKIPIF 1 < 0 ,
其形成过程可表示为;
(3)K最外层有1个电子,Cl最外层有7个电子,二者通过电子得失成为 SKIPIF 1 < 0 和 SKIPIF 1 < 0 ,进而形成离子键,其形成过程可表示为。
【一隅三反】
1.(2022·陕西渭南·高一期末)下列变化过程需要破坏离子键的是
A.氢气液化B.氯化钠熔化C.干冰升华D.氯化氢溶于水
【答案】B
【解析】A.氢气是非金属单质,液化时只需克服分子间作用力,不需要破坏共价键,故A不符合题意;
B.氯化钠是离子化合物,熔化时需要破坏离子键,故B符合题意;
C.干冰是共价化合物,升华时只需克服分子间作用力,不需要破坏共价键,故C不符合题意;
D.氯化氢是共价化合物,溶于水时需要破坏共价键,故D不符合题意;
故选B。
2.(2022·北京房山·高一期末)下列物质中,含离子键的是
A.N2B.CO2C.NaClD.HCl
【答案】C
【解析】离子键一般存在于活泼金属与活泼非金属之间或者铵盐中,所以存在离子键的有NaCl,而其他均为共价键;故选C。
3.下列含有离子键的物质是 SKIPIF 1 < 0 。
A.FeB. SKIPIF 1 < 0 C.HClD.NaCl
【答案】D
【解析】A.Fe是金属单质,只含有金属键,故A不符合题意;
B.二氧化硅中存在的化学键是非金属元素之间形成的共价键,即硅原子和氧原子形成共价键,为共价化合物,故B不符合题意;
C.HCl中存在的化学键是非金属元素之间形成的共价键,即H与Cl形成共价健,为共价化合物,故C不符合题意;
D.氯化钠中存在的化学键是活泼金属和活泼非金属之间形成的离子键,即钠离子与氯离子之间形成的离子键,故D符合题意;
答案为D。
4.请写出电子式
(1)原子的电子式
H____ 、Ca ____、N____、 O____、 Cl____ 、C____ 、 Al____
(2)离子的电子式
①简单阳离子:氢离子____ 钾离子____ 钙离子____
②简单阴离子:氯离子____ 氧离子____
③复杂阴、阳离子:铵根离子____ 氢氧根离子____ 过氧根离子( SKIPIF 1 < 0 )____
(3)离子化合物的电子式
NaCl____ CaO____ CaCl2_____ CaF2 ____ Na2O ____ Na2O2____
【答案】(1) SKIPIF 1 < 0 SKIPIF 1 < 0
① H+ K+ Ca2+ ②
③
(3)
【解析】(1)书写原子的电子式时,一般讲原子的最外层电子写在元素符号的上、下、左、右四个位置上;H、Ca、N、 O、Cl、C、Al电子式分别为: SKIPIF 1 < 0 、 SKIPIF 1 < 0 、、、、、;
(2)①简单阳离子是原子失去最外层电子后形成的,其电子式即为离子符号本身;氢离子、钾离子、钙离子的电子式分别为:H+、K+、Ca2+;
②简单阴离子因为得到电子后最外层一般为8电子结构,书写时要在元素符号周围标出电子,用“[ ]”括上,并在[ ]右上角标明电性和所带电荷数;氯离子、氧离子的电子式分别为:、;
③复杂阴、阳离子中存在共用电子对,要注意H稳定结构最外层2个电子,其他非金属元素稳定结构一般最外层为8电子,复杂阴、阳离子用“[ ]”括上,并在[ ]右上角标明电性和所带电荷数;铵根离子、氢氧根离子、过氧根离子( SKIPIF 1 < 0 )的电子式分别为:、、;
离子化合物电子式的书写,是将阴阳离子(阳离子在前,阴离子在后)拼在一起;对于不同价态的离子,也按其绝对值,遵照“大值在中间、小值在周边”的原则书写;NaCl、CaO、CaCl2、CaF2、Na2O、Na2O2电子式分别为:、、、、、。
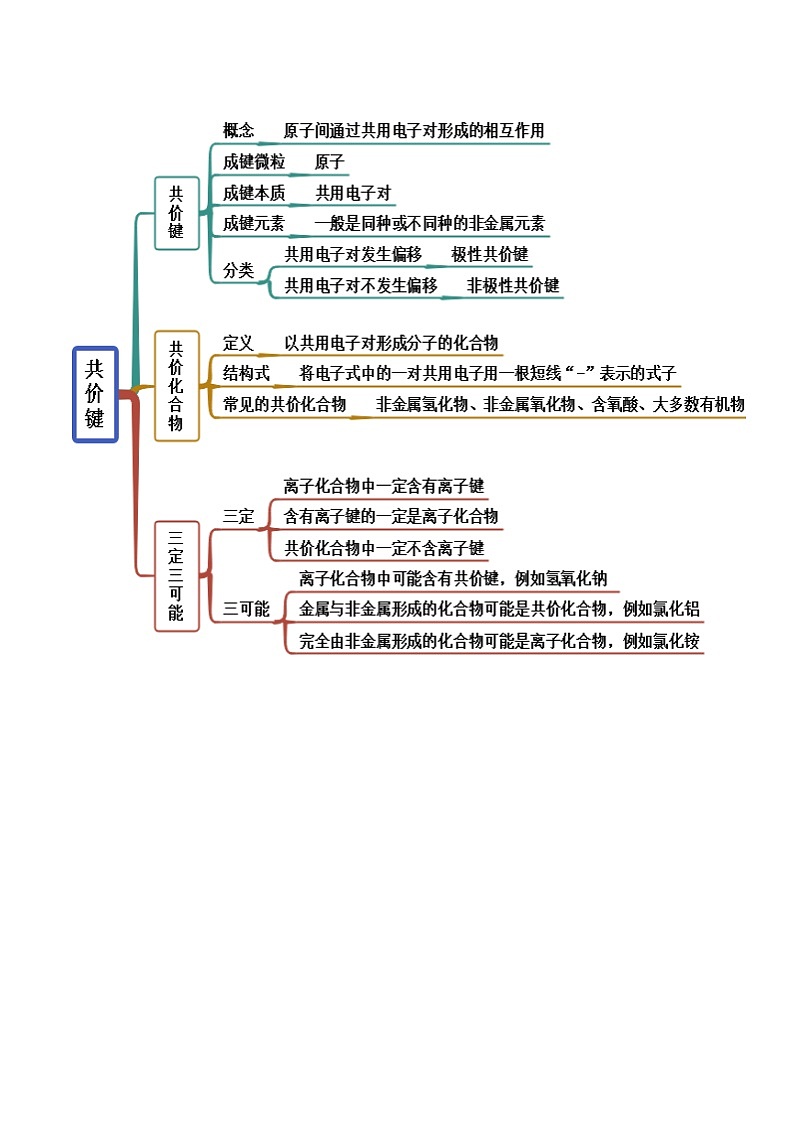
考点二 共价键
【例2-1】(2022·陕西渭南·高一期末)下列物质中属于含有共价键的离子化合物的是
A. SKIPIF 1 < 0 B. SKIPIF 1 < 0 C. SKIPIF 1 < 0 D. SKIPIF 1 < 0
【答案】C
【解析】A. SKIPIF 1 < 0 的结构为O=C=O,为共价化合物,A选项错误;
B. SKIPIF 1 < 0 为共价化合物,B选项错误;
C. SKIPIF 1 < 0 由Na+和CH3COO-构成,Na+和CH3COO-之间是离子键,CH3COO-中C-C、C-H为共价键,C选项正确;
D. SKIPIF 1 < 0 为离子化合物,但是无共价键,D选项错误;
答案选C。
【例2-2】.(2022·上海市第二中学)下列物质的电子式正确的是
A.氯化钙B.硫化氢
C.氯气D.甲烷
【答案】D
【解析】A.氯化钙为离子化合物,电子式为,A项错误;
B.硫化氢为共价化合物,电子式为,B项错误;
C.氯气为共价化合物,电子式为,C项错误;
D.甲烷为共价化合物,电子式为,D项正确;答案选D。
【一隅三反】
1.(2022·四川雅安·高一期末)下列化合物中,既有离子键又有非极性共价键的是
A. SKIPIF 1 < 0 B. SKIPIF 1 < 0 C. SKIPIF 1 < 0 D. SKIPIF 1 < 0
【答案】D
【解析】A. SKIPIF 1 < 0 既有离子键又有极性共价键,故A不符合题意;
B. SKIPIF 1 < 0 只有离子键,故B不符合题意;
C. SKIPIF 1 < 0 既有离子键又有极性共价键,故C不符合题意;
D. SKIPIF 1 < 0 既有离子键又有非极性共价键,故D符合题意;
综上所述,答案为D。
2.下列各组物质都是共价化合物的是( )
A.H2S和Na2O2B.H2O2和NH4Cl
C.NH3和N2D.HNO3和HCl
【答案】D
【解析】A. H2S为共价化合物,Na2O2为离子化合物,故A不符合题意;
B.H2O2为共价化合物,NH4Cl、Na2O2为离子化合物,故B不符合题意;
C.NH3为共价化合物, N2为单质,故C不符合题意;
D.HNO3和HCl都为共价化合物,故D符合题意;故选:D。
3.(2022·四川·乐山市教育科学研究所高一期末)下表中物质的化学键类型和物质类别完全正确的是
【答案】B
【解析】A.N2是N元素组成的单质,故A错误;
B. SKIPIF 1 < 0 由 SKIPIF 1 < 0 构成,含有离子键、共价键,属于离子化合物,故B正确;
C. SKIPIF 1 < 0 是共价化合物,只含共价键,故C错误;
D. SKIPIF 1 < 0 由 SKIPIF 1 < 0 构成,只含离子键,故D错误;选B。
4.(2022·北京昌平·高一期末)下列物质的电子式书写不正确的是
A.B.C.D.
【答案】A
【解析】A.二氧化碳为共价化合物,碳原子与两个氧原子分别共用2对电子,电子式为:,故A错误;
B.氯化氢为共价化合物,氢原子与氯原子通过共用1对电子结合,电子式为:,故B正确;
C.水分子中O原子分别与H原子以共价键结合,故电子式为,故C正确;
D.氢气中H原子之间以单键结合,故其电子式为H:H,故D正确;故答案选A。
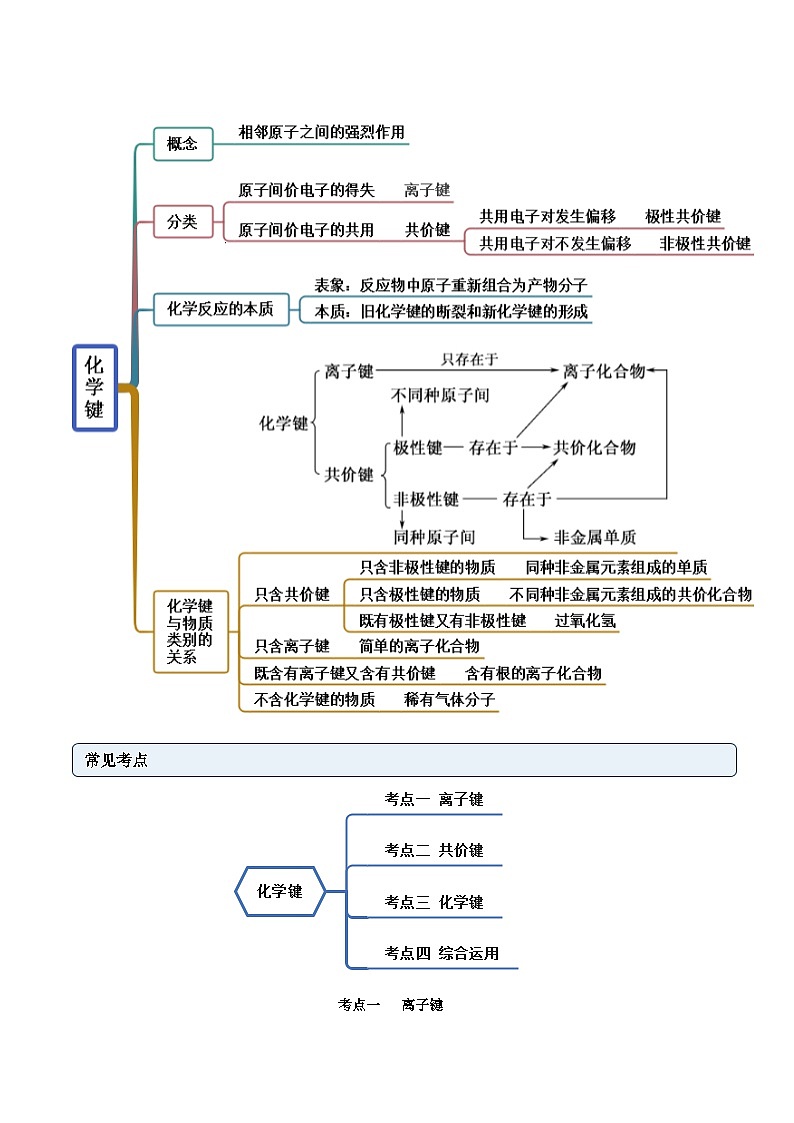
考点三 化学键
【例3】(2022·陕西宝鸡·高一期末)下列说法正确的是
A.离子化合物中不含共价键
B.共价化合物中可能含离子键
C.CO2和H2O2中均只含有共价键
D.CaCl2和H2SO4中含有的化学键类型相同
【答案】C
【【解析】A.离子化合物中可能含共价键,如氢氧化钠固体中含有离子键、共价键,故A错误;
B.共价化合物中只含共价键,不含离子键,故B错误;
C.CO2和H2O2都是共价化合物,均只含有共价键,故C正确;
D.CaCl2只含离子键,H2SO4中只含共价键,故D错误;选C。
【一隅三反】
1.(2022·陕西渭南·高一期末)下列各组化合物中,化学键类型完全相同的是
A. SKIPIF 1 < 0 、HClB.KOH、NaCl
C. SKIPIF 1 < 0 、 SKIPIF 1 < 0 D. SKIPIF 1 < 0 、 SKIPIF 1 < 0
【答案】D
【解析】A.CaF2中化学键为离子键,而HCl中化学键为共价键,两种化合物中的化学键类型不相同,A项不符合题意;
B.KOH中含有离子键、共价键,而NaCl中只含有离子键,因此两种化合物中的化学键类型不完全相同,B项不符合题意;
C.CO2中含有共价键,而Na2O2中含有离子键、共价键,因此两种化合物中的化学键类型不完全相同,C项不符合题意;
D.MgCl2、Na2S都是离子化合物,其中只含离子键,因此二者的化学键类型完全相同,D项符合题意;
答案选D。
2.(2022·四川自贡·高一期末)下列关于化学键的说法正确的是
①含有金属元素的化合物一定是离子化合物。
②第IA和第ⅦA族原子化合时,一定生成离子键。
③非极性键只存在双原子单质分子中。
④活泼金属单质与活泼非金属单质化合时,一般形成离子键。
⑤含有离子键的化合物一定是离子化合物。
⑥离子化合物中可能同时含有离子键和共价键。
A.①②⑤B.①③④C.④⑤⑥D.③④⑤
【答案】C
【解析】①含有金属元素的化合物不一定是离子化合物,如AlCl3为共价化合物,①错误;
②第IA族和第ⅦA族原子化合时,不一定生成离子键,如HCl为共价化合物,②错误;
③非极性键不是只存在双原子单质分子中,如过氧化氢中两个氧原子之间是非极性共价键,③错误;
④活泼金属与非金属化合时,一般形成离子键,如氯气和钠反应生成NaCl,④正确;
⑤离子化合物是阴阳离子通过离子键构成的化合物,故含有离子键的化合物一定是离子化合物,⑤正确;
⑥离子化合物中可能同时含有离子键和共价键,如NaOH既含有离子键,又含有共价键,⑥正确;
故只有④⑤⑥符合题意;
故选C。
3.(2022·四川成都·高一期末)下列说法错误的是
A.共价化合物只含共价键,离子化合物不一定只含离子键
B.离子化合物熔融一定能导电,共价化合物溶于水一定能导电
C.有化学键的断裂不一定发生了化学反应
D.离子化合物一定是电解质
【答案】B
【解析】A.共价化合物是有且只有共价键的化合物,只要含有离子键即为离子化合物,可能含有共价键,比如NaOH,所以,离子化合物不一定只含离子键,A正确;
B.离子化合物熔融状态下一定能导电是正确的,共价化合物溶于水不一定导电,如SiO2,B错误;
C.有化学键的断裂不一定发生了化学反应,比如NaCl溶于水,只有离子键断裂,无新键形成,C正确;
D.电解质是在熔融状态下或水溶液中能够导电的化合物,而离子化合物在熔融状态下能导电,所以离子化合物一定是电解质,D正确;
故选B。
考点四 综合运用
【例4】(2022·四川眉山·高一期末)A、B、C、D、E五种短周期主族元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体X,X可用于呼吸面具中作为氧气的来源;D的L层电子数等于K、M两个电子层上的电子数之和;C与E两元素单质反应生成Y。
(1)C在周期表中的位置是_______ , 离子半径大小B_______C(填“>”“<”或“=”)。
(2)写出X的电子式_______含有的化学键为_______。
(3)写出A、B两元素形成的化合物AB2与X反应的化学方程式,并用双线桥法表示电子转移方向和数目_______。
(4)Y属于_______(填“离子”或“共价”)化合物,用电子式表示其形成过程_______。
(5)A的单质与D的最高价氧化物对应的水化物(浓溶液)反应的化学方程式为_______。
【答案】(1) 第3周期第ⅠA族 >
(2) 离子键、共价键
(3)
(4) 离子
(5)C+2H2SO4(浓) SKIPIF 1 < 0 CO2↑+2SO2↑+2H2O
【解析】A原子的最外层上有4个电子,则A为6元素碳;淡黄色的固体X为Na2O2,B的阴离子和C的阳离子具有相同的电子层结构,则B为O元素,C为Na元素;D的L层电子数等于K、M两个电子层上的电子数之和,则D为S元素,E为Cl元素;C与E两元素单质反应生成Y,则Y为NaCl。从而得出A、B、C、D、E、X、Y分别为C、O、Na、S、Cl、Na2O2、NaCl。
(1)C为11号元素Na,在周期表中的位置是第3周期第ⅠA族,B、C分别为O、Na,O的核电荷数小于Na,则离子半径大小O2->Na+。答案为:第3周期第ⅠA族;>;
(2)X为Na2O2,由Na+和 SKIPIF 1 < 0 构成,电子式为,含有的化学键为离子键、共价键。答案为:;离子键、共价键;
(3)A、B分别为C、O元素,两元素形成的化合物AB2(CO2)与X(Na2O2)反应的化学方程式(用双线桥法表示电子转移方向和数目)为。答案为:;
(4)Y为NaCl,属于离子化合物,用电子式表示其形成过程为。答案为:离子;;
(5)A的单质为碳,D的最高价氧化物对应的水化物(浓溶液)为浓硫酸,反应的化学方程式为C+2H2SO4(浓) SKIPIF 1 < 0 CO2↑+2SO2↑+2H2O。答案为:C+2H2SO4(浓) SKIPIF 1 < 0 CO2↑+2SO2↑+2H2O。
【一隅三反】
1.填写空格
(1)写出下列物质的电子式:N2_______;HClO_______;
(2)写出下列物质的结构式:CH4_______;CO2_______。
(3)与Ar原子电子层结构相同的﹣2价阴离子的离子结构示意图_______。
(4)在1~18号元素组成的化合物中具有三核10个电子的共价化合物是_______;具有三核20个电子的离子化合物是_______;具有四核18个电子的两种化合物分别是_______、_______;既具有离子键又有非极性键和极性键的化合物是_______。
(5)下列叙述中所涉及元素是氧元素的有_______
a.质量数为18,原子核中有10个中子的核素
b.核电荷数等于最外层电子数的离子
c.质子数等于短周期同族元素原子序数一半的元素
d.原子的最外层电子数是内层电子数3倍的元素
e.能与H、C、N、Na、S、Fe等元素形成两种或两种以上的化合物的元素
f.形成化合物的种类最多的元素
g.Y和Z均由元素R组成,反应Y+2I﹣+2H+=I2+Z+H2O,其中的R元素。
【答案】(1)
(2) O=C=O
(3)
(4) H2O NaOH或LiHS H2O2 PH3 CH3COONa
(5)abcdeg
【解析】(1)氮原子最外层电子数为5,有三个单电子,所以氮原子与氮原子之间共用三个电子对,故N2的电子式为;
次氯酸为共价化合物,分子中原子通过共用电子对成键,次氯酸分子中,氢原子最外层有1个电子,氯原子最外层有7个电子,其中只有一个单电子可以形成共用电子对,氧原子最外层有6个电子,其中有两个单电子可以形成共用电子对,故HClO的电子式为;
(2)甲烷的分子式为CH4,其结构式为;二氧化碳中一个碳原子和两个氧原子之间各共用两对电子,形成碳氧双键,其结构式为O=C=O;
(3)Ar的核外为18个电子,故电子层结构相同的﹣2价阴离子为S2-,离子结构示意图为;
(4)在1―18号元素组成的化合物中具有三核10个电子的共价化合物为H2O;
Na+和OH-都是10个电子的离子,结合得到具有三核20个电子的离子化合物是NaOH,H2S是18个电子,用Li替代三核20个电子的离子化合物LiHS;
将H2O去掉一个H原子,将剩余部分结合可得四核18个电子的化合物H2O2,NH3是四核10个电子,P比N多8个电子,用P替代N,可得四核18个电子的化合物PH3;
有机酸形成的盐既具有离子键又有非极性键和极性键,满足条件的化合物是CH3COONa等;
(5)a、质量数为18,中子数为10的核素,质子数Z=18-10=8,属于氧元素,故a正确;
b、原子失电子形成阳离子,阳离子核电荷数一定大于最外层电子数,核电荷数等于最外层电子数的离子为阴离子,阴离子的最外层电子数是2或8,最外层电子数为2是H+,核电荷数不等于最外层电子数;最外层电子数为8时,核电荷数为8,是O2-,故b正确;
c、质子数等于短周期同族元素原子序数一半,应处于偶数族,IIA族、IVA族、VIA族,这3族原子序数相差8,所以原子处于VIA族,故为氧原子,属于氧元素,故c正确;
d、原子的最外层电子数是内层电子数3倍的元素,该原子有两个电子层,第一电子层有2个电子,最外层有6个电子,所以核内有8个质子,是氧原子,属于氧元素,故d正确;
e、能与H、C、N、Na、S、Fe等元素形成两种或两种以上的化合物的元素,该元素为非金属元素,显负化合价,有变价,只有氧元素符合,故e正确;
f、形成化合物的种类最多的元素是碳元素,故f错误;
g、由反应Y+2I﹣+2H+=I2+Z+H2O,根据质量守恒可知,Y含有氧元素,Y和Z均由元素R组成,所以R为氧元素,故g正确;
故答案为:abcdeg。
2.(2021·内蒙古包头·高一期末)下表是元素周期表的一部分,用化学用语回答下列问题:
(1)①-⑩号元素中元素的最高价氧化物对应的水化物中酸性最强的是_______,碱性最强的是_______(均用化学式表示)。
(2)④⑤⑥⑦的简单离子半径由大到小的顺序为_______(用离子符号和“>”表示)。
(3)②与④可以形成一种温室气体,用电子式表示其形成过程_______。
(4)由①③⑩三种元素形成的一种离子化合物的电子式_______。
(5)欲比较④和⑨两种元素的非金属性强弱,可以作为验证的证据是_______(填字母)。
A.比较这两种元素单质的沸点
B.比较这两种元素单质与氢气化合的难易
C.比较这两种元素的最高价氧化物对应水化物的酸性
(6)表中③和⑤可形成一种相对分子量为66的共价化合物Y,Y分子中各原子均达到“8电子稳定结构”,Y的结构简式为_______。
【答案】(1) SKIPIF 1 < 0 NaOH
(2) SKIPIF 1 < 0
(3)++→
(4)
(5)B
(6)F-N=N-F
【解析】根据元素在周期表中的结构可知,①为H,②为C,③为N,④为O,⑤为F,⑥为Na,⑦为Mg,⑧为Al,⑨为S,⑩为Cl。
(1)元素的非金属性越强,最高价氧化物对应的水化物的酸性越强;元素的金属性越强,最高价氧化物对应的水化物的碱性越强;①-⑩号元素中元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是NaOH。
(2)核外电子排布相同,核电荷数越小,离子半径越大;④⑤⑥⑦的简单离子半径由大到小的顺序为 SKIPIF 1 < 0 。
(3)②与④可以形成一种温室气体,是CO2,用电子式表示其形成过程为:++→。
(4)由①③⑩三种元素形成的一种离子化合物是NH4Cl,其电子式为。
(5)元素的非金属性越强,单质与氢气化合越容易,最高价氧化物对应的水化物的酸性越强;A.比较这两种元素单质的沸点,属于物理性质,与非金属性无关,故A错误;B.比较这两种元素单质与氢气化合的难易,故B正确;C.O无最高价氧化物对应的水化物,故C错误;故答案为B。
(6)表中③和⑤可形成一种相对分子量为66的共价化合物Y,Y分子中各原子均达到“8电子稳定结构”,Y为N2F2,其结构式为F-N=N-F。
选项
A
B
C
D
物质
SKIPIF 1 < 0
SKIPIF 1 < 0
SKIPIF 1 < 0
SKIPIF 1 < 0
化学键类型
共价键
离子键、共价键
离子键
离子键、共价键
物质类别
共价化合物
离子化合物
离子化合物
离子化合物
族
周期
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
1
①
2
②
③
④
⑤
3
⑥
⑦
⑧
⑨
⑩
4
高中化学人教版 (2019)选择性必修3第三节 核酸精品课后测评: 这是一份高中化学人教版 (2019)选择性必修3第三节 核酸精品课后测评,共15页。试卷主要包含了核酸的组成,核酸的结构,核酸的生物功能等内容,欢迎下载使用。
化学必修 第一册第二章 海水中的重要元素——钠和氯第二节 氯及其化合物课堂检测: 这是一份化学必修 第一册第二章 海水中的重要元素——钠和氯第二节 氯及其化合物课堂检测,共10页。
化学人教版 (2019)第四章 物质结构 元素周期律第三节 化学键优秀当堂达标检测题: 这是一份化学人教版 (2019)第四章 物质结构 元素周期律第三节 化学键优秀当堂达标检测题,共15页。试卷主要包含了离子键等内容,欢迎下载使用。













