人教版 (2019)必修 第一册第二节 金属材料优秀当堂检测题
展开常见考点
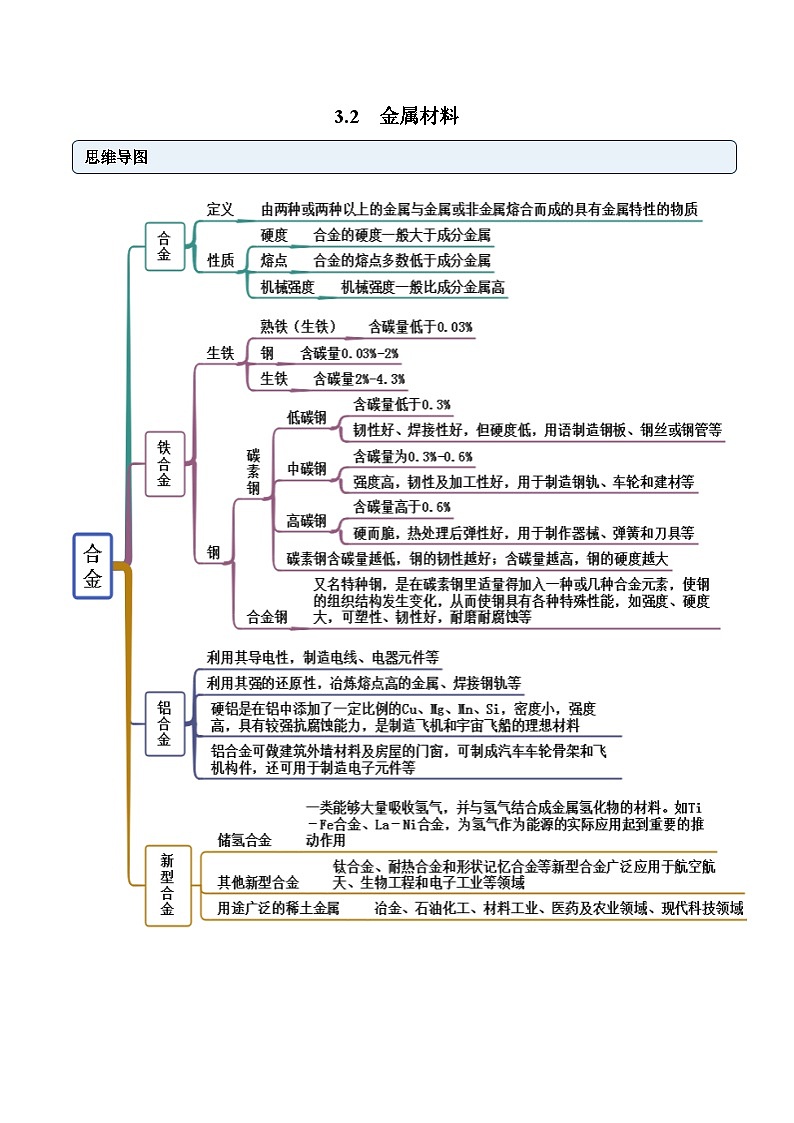
考点一 合金
【例1-1】(2022·江苏·无锡市教育科学研究院高一期末)下列关于合金的叙述正确的是
A.铝合金硬度比纯铝小
B.生铁是铁碳合金,钢是纯净的铁单质
C.硬铝密度小、强度高,常用于制造飞机外壳
D.不锈钢和钢都是铁合金,性质完全相同
【答案】C
【解析】A.合金的硬度比其任一组分都大,铝合金硬度比纯铝大,A错误;
B.生铁是铁碳合金,钢的含碳量比生铁低,也是铁碳合金,B错误;
C.硬铝密度小、强度高,常用于制造飞机外壳,C正确;
D.不锈钢和钢都是铁合金,但其内部结构和组分不同,性质不相同,D错误;
故选C。
【例1-2】.储氢合金是一种新型合金。下列关于储氢合金的说法,错误的是
A.储氢合金是一类能大量吸收 SKIPIF 1 < 0 ,并与 SKIPIF 1 < 0 结合成金属氢化物的材料
B.储氢合金吸收 SKIPIF 1 < 0 的过程属于物理变化
C.储氢合金 SKIPIF 1 < 0 中氢元素的化合价为-1
D.具有实用价值的储氢合金在室温下吸、放氢的速率快
【答案】B
【解析】A.储氢合金是一类能够大量吸收氢气,并与氢气结合成金属氢化物的材料.如镧镍合金,它吸收氢气可结合成金属氢化物,故A正确;
B.氢气在储存过程中与金属反应生成其他物质,是化学变化,故B错误;
C. SKIPIF 1 < 0 中Na是+1价,Al是+3价,则H为-1价,故C正确;
D.储氢合金储氢量大、吸放氢速率快,所以可用于氢燃料汽车,故D正确;
故选:B。
【一隅三反】
1.(2022·广西桂林·高一期末)下列物质不属于合金的是
A.不锈钢B.硬铝C.黄铜D.水银
【答案】D
【解析】A.不锈钢是铁合金,A错误;
B.硬铝是铝合金,B错误;
C.黄铜是铜锌合金,C错误;
D.水银是金属汞,为金属单质,不是合金,D正确;
答案选D。
2.下列关于新型合金材料说法不正确的是
A.镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料
B.钛合金生物相容性好,强度大,可作人造骨骼
C.生铁和钢是含碳量不同的两种铁碳合金,生铁的含碳量比钢的含碳量高
D.合金的熔点比其成分金属的熔点高
【答案】D
【解析】A.镧镍合金能大量吸收H2,并与H2结合成金属氢化物,金属氢化物稍稍加热又容易分解,所以可用作储氢材料,故A正确;
B.钛合金生物相容性好,强度大,常用作人造骨骼,故B正确;
C.生铁是含碳量大于2%的铁碳合金,钢是对含碳量在0.02%~2%之间的铁碳合金的统称,生铁的含碳量比钢高,故C正确;
D.合金的熔点比其成分金属的熔点低,故D错误;答案为D。
3.(2022·黑龙江·佳木斯一中高一期末)2022年世界冬奥会和冬残奥会在北京举行,其中短道速滑项目队员所穿的速滑冰刀采用合金材料——不锈钢制成。
下列关于合金的叙述,错误的是
A.通过增加原子层之间的相对滑动难度,使合金的硬度变大
B.不锈钢中添加镍(Ni)和铬(Cr)等元素,因此不含非金属元素
C.储氢合金属于新型合金,可用于以氢气为燃料的汽车
D.硬铝具有强度高、密度小、抗腐蚀能力强等优点,常用于制造飞机外壳
【答案】B
【解析】A.合金的硬度大于纯金属的硬度,不锈钢是通过增加原子层之间的相对滑动难度,导致合金的硬度变大,故A正确;
B.钢是铁和碳的合金,不锈钢中含有金属元素,还含有非金属元素碳,故B错误;
C.储氢合金与水反应释放的氢气具有可燃性,可作汽车的燃料,故C正确;
D.合金的硬度大、抗腐蚀性强,则飞机外壳大部分材料是铝合金,铝合金材料具有强度大、质量轻、抗腐蚀能力强等优点,故D正确;故选:B。
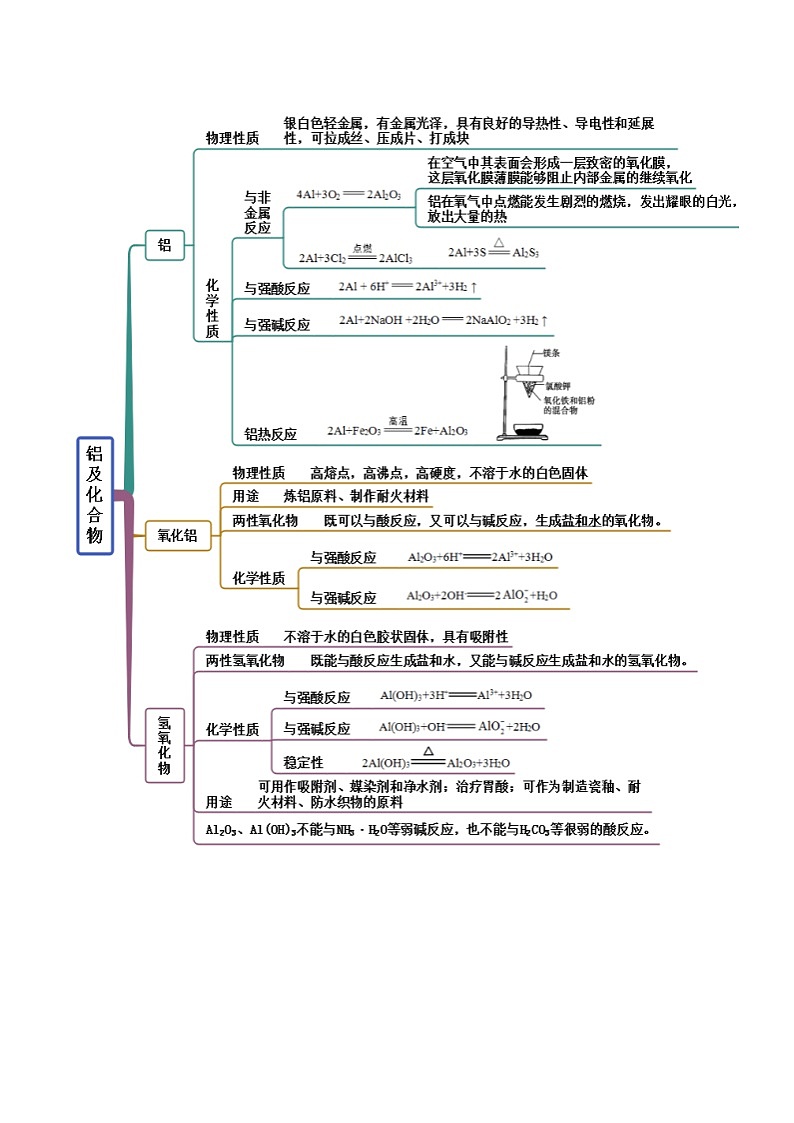
考点二 铝及其化合物
【例2-1】(2022·广西桂林·高一期末)Al分别与足量盐酸、氢氧化钠溶液反应,产生的 SKIPIF 1 < 0 在相同状态下体积相等时,消耗Al的质量比为
A.1∶1B.1∶2C.1∶3D.3∶1
【答案】A
【解析】Al分别与足量盐酸、氢氧化钠溶液反应的化学方程式为2Al+6HCl=2AlCl3+3H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,根据方程式可知,产生的 SKIPIF 1 < 0 在相同状态下体积相等(即物质的量相等)时,消耗的Al的物质的量相同,则消耗Al的质量比为1:1,故答案选A。
【例2-2】(2021·河北·邢台一中高一阶段练习)下列关于Al及其化合物叙述错误的是
A.铝既能与硫酸溶液反应,又能与烧碱溶液反应
B.Al(OH)3是难溶于水的白色胶状物质
C.Al(OH)3是两性氢氧化物,既能溶于酸,又能溶于碱
D.Al(OH)3加热分解生成Al2O3,但Al2O3不能与水反应生成Al(OH)3
【答案】C
【解析】A. 铝能与稀硫酸溶液反应生成硫酸铝和氢气,又能与烧碱溶液反应生成偏铝酸钠和氢气,A正确;
B. Al(OH)3难溶于水、是一种白色胶状沉淀,B正确;
C. Al(OH)3是两性氢氧化物,既能溶于酸,又能溶于强碱、但不溶于弱碱,C不正确;
D. Al(OH)3加热分解生成Al2O3,但Al2O3不溶于水、不能与水反应生成Al(OH)3,D正确;
答案选C。
【一隅三反】
1.下列关于铝及其化合物的说法中不正确的是
A.明矾可以用作净水剂和消毒剂B.铝可用作包装材料和建筑材料
C.氢氧化铝可与盐酸发生中和反应D.硬铝是制造宇宙飞船和飞机的理想材料
【答案】A
【解析】A.明矾是强酸弱碱盐能水解生成氢氧化铝胶体,胶体具有吸附性,所以可作净水剂,不能作消毒剂,故A错误;
B.铝具有良好的延展性,则铝可用作包装材料,铝合金密度小,硬度大,铝合金可作建筑材料,故B正确;
C.氢氧化铝具有弱碱性,能与盐酸发生中和反应生成氯化铝和水,故C正确;
D.硬铝属于合金,具有密度小、强度高、抗腐蚀能力强,是制造宇宙飞船和飞机的理想材料,故D正确;
故选A。
2.(2022·江苏宿迁·高一期末)金属铁和铝以及其相关制品在生活和生产中随处可见,用途十分广泛,如在电子、汽车、工业等领域也有各种各样的用途。工业上常利用铝热反应原理来焊接钢轨,化学方程式为: SKIPIF 1 < 0 。下列关于铝及其化合物说法正确的是
A.铝在常温下不能与氧气发生反应
B.铝制品有致密的氧化膜,可长时间盛放酸性或碱性食物
C.将氢氧化铝在高温下灼烧,即可得到氧化铝
D.等质量的铝分别与足量的盐酸和氢氧化钠溶液反应,放出 SKIPIF 1 < 0 的物质的量之比为3∶1
【答案】C
【解析】A.铝在常温下能与氧气发生反应生成氧化铝,故A错误;
B.氧化铝是两性氧化物,能与酸、碱反应,铝制品不能长时间盛放酸性或碱性食物,故B错误;
C.将氢氧化铝在高温下灼烧,氢氧化铝分解为氧化铝和水,故C正确;
D.铝分别与足量的盐酸和氢氧化钠溶液反应,铝元素化合价由0升高为+3,等质量的铝失电子的物质的量相等,所以放出 SKIPIF 1 < 0 的物质的量之比为1∶1,故D错误;
选C。
3.最高价氧化对应的水化物既能和盐酸反应又能与氢氧化钠反应
A. SKIPIF 1 < 0 B. SKIPIF 1 < 0 C. SKIPIF 1 < 0 D. SKIPIF 1 < 0
【答案】C
【解析】A. SKIPIF 1 < 0 是碱,只能与盐酸反应不能与氢氧化钠反应,方程式为:Mg(OH)2+2HCl=MgCl2+2H2O,A不合题意;
B. SKIPIF 1 < 0 是酸,只能与氢氧化钠反应,不能与盐酸反应,方程式为:H2SO4+2NaOH=Na2SO4+2H2O,B不合题意;
C. SKIPIF 1 < 0 是两性氢氧化物,既能与盐酸反应又能与氢氧化钠反应,方程式为:Al(OH)3+3HCl=AlCl3+3H2O、Al(OH)3+NaOH=NaAlO2+2H2O,C符合题意;
D. SKIPIF 1 < 0 是碱,只能与盐酸反应不能与氢氧化钠反应,方程式为:KOH+HCl=KCl+H2O,D不合题意;
故答案为:C。
4.将0.1ml镁和铝的混合物溶于100mL2ml·L-1硫酸中,然后滴加1ml·L-1NaOH溶液。回答下列问题:
(1)若在滴加NaOH溶液的过程中,沉淀质量随加入NaOH溶液体积的变化如图所示。
①有关反应的离子方程式为____。
②当V1=160时,金属粉末中n(Mg)=____ml,V2=___。
(2)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积为___。
(3)若混合物仍为0.1ml,其中镁粉的物质的量分数为a,用100mL2ml·L-1硫酸溶解此混合物后,再加入450mL1ml·L-1NaOH溶液,所得沉淀中无Al(OH)3,写出满足此条件的a的取值范围:____。
【答案】(1) OH-+H+=H2O、Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-= SKIPIF 1 < 0 +2H2O 0.06 440
(2)400
(3)0.5≤a<1
【解析】(1)①O点到V1点说明为H2SO4和NaOH反应。离子方程式为:OH-+H+=H2O,V1是开始生成沉淀,离子方程式为:Mg2++2OH-=Mg(OH)2↓,Al3++3OH-=Al(OH)3↓,然后沉淀减少,是由于Al(OH)3+OH-= SKIPIF 1 < 0 +2H2O,故在滴加NaOH溶液过程中有关反应的离子方程式为OH-+H+=H2O、Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-= SKIPIF 1 < 0 +2H2O,故答案为:OH-+H+=H2O、Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-= SKIPIF 1 < 0 +2H2O;
②当V1=160mL时,此时溶液是MgSO4、Al2(SO4)3和Na2SO4混合液,
由Na+离子守恒可知,n(Na2SO4)= SKIPIF 1 < 0 n(Na+)= SKIPIF 1 < 0 n(NaOH)= SKIPIF 1 < 0 ×0.16L×1ml/L=0.08ml,设MgSO4为xml,Al2(SO4)3为yml,则:根据Mg原子、Al原子守恒有:x+2y=0.1,根据 SKIPIF 1 < 0 离子守恒有:x+3y=0.2-0.08,联立方程解得:x=0.06、y=0.02,所以金属粉末中n(Mg)=0.06ml,n(Al)=2y=2×0.02ml=0.04ml,滴加NaOH溶液到体积V2时时,溶液是Na2SO4和NaAlO2混合液,根据SO42-离子、Na+离子和Al原子守恒有:n(NaOH)=2n(Na2SO4)+n(NaAlO2)=2n(H2SO4)+n(Al)=2×0.1L×2ml/L×+0.04ml=0.44ml,所以,V2= SKIPIF 1 < 0 =0.44L=440mL,故答案为:0.06;440;
(2)当溶液中Mg2+、Al3+恰好沉淀完全时,此时,溶液是Na2SO4溶液,根据 SKIPIF 1 < 0 离子和Na+离子守恒有:n(Na+)=2n(Na2SO4)=2(H2SO4)=2×0.1L×2ml/L=0.4ml,所以,V(NaOH)= SKIPIF 1 < 0 =0.4L=400mL,故答案为:400;
(3)若混合物仍为0.1ml,其中镁的物质的量分数为a,用100mL 2ml•L-1硫酸溶解后,再加入450mL 1ml•L-1氢氧化钠溶液,所得溶液无Al(OH)3沉淀,证明生成的氢氧化铝全部和氢氧化钠反应,由上述分析知:v1=400ml,再加入50mL 1ml•L-1氢氧化钠溶液,所得Al(OH)3沉淀完全溶于氢氧化钠生成偏铝酸钠,Al(OH)3+NaOH=NaAlO2+2H2O,Al(OH)3最大取值0.05ml,即0<n(Al)≤0.05ml,n(Mg)+n(Al)=0.1ml,则0.5≤n(Mg)<1,故答案为:0.5≤a<1;
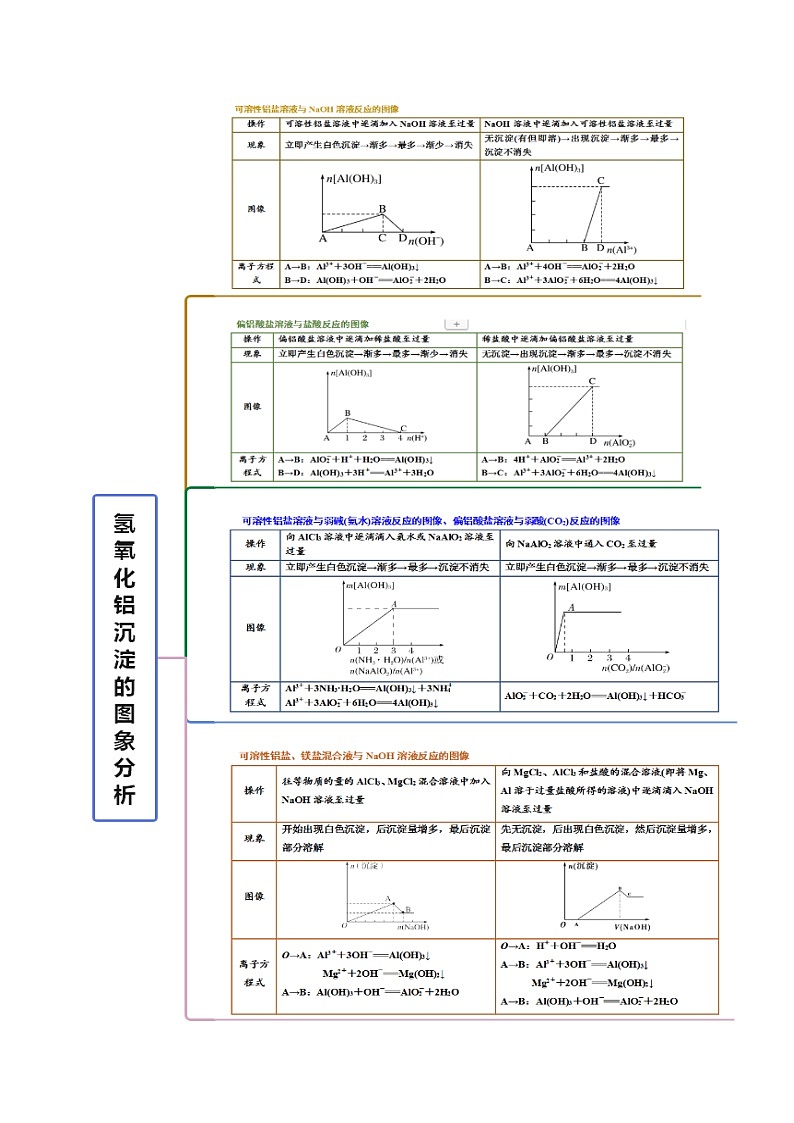
考点三 铝三角的图像分析
【例3】下列有关Al(OH)3的图像不正确的是
A.向氯化铝溶液中滴加氢氧化钠溶液
B.向氢氧化钠溶液中滴加氯化铝
C.向偏铝酸钠中通入二氧化碳
D.向氯化铝溶液中滴加氨水
【答案】C
【解析】向AlCl3溶液中滴加NaOH溶液先生成沉淀Al(OH)3,Al(OH)3可以溶解于NaOH溶液,后沉淀溶解,A对;向NaOH溶液中滴加AlCl3溶液,NaOH过量先生成NaAlO2,然后NaAlO2与AlCl3溶液发生水解生成Al(OH)3,B对;向NaAlO2溶液中通入CO2生成Al(OH)3,Al(OH)3不会溶解,C错;向AlCl3溶液中滴氨水生成Al(OH)3沉淀,Al(OH)3,不溶于氨水,D对,选C。
物质的反应和化学反应的图像。
【一隅三反】
1.下列图像与选项对应的是
A.氯化铝中滴加氢氧化钠溶液
B.氢氧化铝溶液中滴加硝酸钠
C.氯化铝中滴加氨水
D.氢氧化铝溶液中通入CO2
【答案】B
【解析】A、向氯化铝溶液中滴加氢氧化钠反应,发生的反应为:AlCl3+3NaOH=Al(OH)3↓+3NaCl,氢氧化钠过量后继续反应:Al(OH)3+NaOH=NaAlO2+2H2O,即消耗氢氧化钠溶液的体积是3:1,A错误;B、氢氧化铝与硝酸钠不反应,质量不变,图像正确,B正确;C、氯化铝和氨水反应生成氢氧化铝沉淀,但氢氧化铝不能溶解在弱碱氨水中,C错误;D、氢氧化铝不能溶解在弱酸碳酸中,D错误,答案选B。
点睛:掌握氢氧化铝的性质是解答的关键,注意氢氧化铝是两性氢氧化物,但不能溶解在弱酸或弱碱中。另外关于图像的答题需要注意:①看面:弄清纵、横坐标的含义。②看线:弄清线的变化趋势,每条线都代表着一定的化学反应过程。③看点:弄清曲线上拐点的含义,如与坐标轴的交点、曲线的交点、折点、最高点与最低点等。曲线的拐点代表着一个反应过程的结束和开始。
2.下列实验结果与图像不相符的是
A.向含有盐酸、氯化镁和氯化铝的溶液中逐渐加入氢氧化钠溶液直至过量
B.向澄清石灰水中通入二氧化碳气体直至过量
C.向氯化铝的溶液中逐渐加入氢氧化钠溶液直至过量
D.向氯化铝的溶液中逐渐加入氨水直至过量
【答案】A
【解析】A. 向含有盐酸、氯化镁和氯化铝的溶液中逐渐加入氢氧化钠溶液直至过量,开始没有沉淀产生,图像不符合,A正确;B. 向澄清石灰水中通入二氧化碳气体直至过量,开始生成碳酸钙沉淀,然后碳酸钙溶解转化为碳酸氢钙,图像符合,B错误;C. 向氯化铝的溶液中逐渐加入氢氧化钠溶液直至过量,发生的反应为Al3++3OH-===Al(OH)3↓、Al(OH)3+OH-===AlO2-+2H2O,图像符合,C错误;D. 向氯化铝的溶液中逐渐加入氨水直至过量生成氢氧化铝沉淀,氨水不能溶解氢氧化铝,图像符合,D错误,答案选A。
3.下列实验与对应示意图的关系正确的是
A.偏铝酸钠溶液中逐滴加入盐酸至过量
B.氯化铝溶液中逐滴滴入氨水至过量
C.明矾溶液中逐滴加入氢氧化钡至过量
D.澄清石灰水缓慢通入二氧化碳至过量
【答案】C
【解析】A.向偏铝酸钠溶液中加入稀盐酸:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,Al(OH)3+3HCl=AlCl3+3H2O,先产生沉淀,后沉淀溶解,所用稀盐酸溶液体积为1:3;A与图象不符,A错误;B.向AlCl3溶液中加氨水:AlCl3+3NH3•H2O=Al(OH)3↓+3NH4Cl,逐渐产生沉淀,且沉淀不溶解;B与图象不符,B错误;C.向KAl(SO4)2中滴加Ba(OH)2:先生成BaSO4和Al(OH)3,再加入Ba(OH)2生成BaSO4的同时Al(OH)3溶解(此时生成沉淀的速度比前面减小),最后Al(OH)3溶解完,只剩余BaSO4沉淀,产生沉淀先快,再慢,最后不变,C与图象相符,C正确;D.向石灰水中通入二氧化碳:CO2+Ca(OH)2=CaCO3↓+H2O,CaCO3+CO2+H2O=Ca(HCO3)2,先产生沉淀,后沉淀溶解,所用二氧化碳体积为1:1;D与图象不符,D错误;答案选C。
4.向NaOH、Na2CO3、NaAlO2溶液中(假设各1 ml),逐滴加入HCl溶液,产生沉淀的物质的量随HCl溶液体积变化的图象如下:
分析图象的变化情况,写出各阶段的离子方程式:
(1)OA:_______。
(2)AB:_______。
(3)BC:_______。
(4)CD:_______。
【答案】(1)OH-+H+=H2O
(2)AlO SKIPIF 1 < 0 +H++H2O=Al(OH)3↓
(3)CO SKIPIF 1 < 0 +H+=HCO SKIPIF 1 < 0 ,HCO SKIPIF 1 < 0 +H+=CO2↑+H2O
(4)Al(OH)3+3H+=Al3++3H2O
【解析】向NaOH、Na2CO3、NaAlO2溶液中(假设各1 ml),逐滴加入HCl溶液,首先HCl与NaOH发生中和反应产生NaCl、H2O;然后是NaAlO2与HCl、H2O发生反应产生NaCl、Al(OH)3沉淀,接着Na2CO3与HCl分步发生反应,最后是Al(OH)3沉淀与HCl发生中和反应,产生AlCl3、H2O。
(1)OA段HCl与NaOH反应产生NaCl、H2O,该反应的离子方程式为:OH-+H+=H2O;
(2)AB段NaAlO2与HCl、H2O发生反应产生NaCl、Al(OH)3沉淀,该反应的离子方程式为:AlO SKIPIF 1 < 0 +H++H2O=Al(OH)3↓;
(3)在BC段Na2CO3与HCl分步发生反应,首先是Na2CO3与HCl反应产生NaCl、NaHCO3,然后是反应产生的NaHCO3与HCl反应产生NaCl、CO2、H2O,相应反应的离子方程式为CO SKIPIF 1 < 0 +H+=HCO SKIPIF 1 < 0 ,HCO SKIPIF 1 < 0 +H+=CO2↑+H2O;
(4)在CD段Al(OH)3沉淀与HCl发生中和反应,产生AlCl3、H2O,反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O。
考点四 物质的量在计算中的运用
【例4-1】(2022·福建福州·高一期末)向10mL浓度均为2ml/L的硝酸与硫酸的混合溶液中加入过量的铜,充分反应后,设溶液体积仍为10mL,产生的气体在标准状况下的体积是
A.0.448LB.0.224LC.0.336LD.0.672L
【答案】C
【解析】n(H+)=2ml/L×0.01L×1+2ml/L×0.01L×2=0.06ml,n(NO SKIPIF 1 < 0 )=2ml/L×0.01L=0.02ml,根据反应3Cu+8H++2NO SKIPIF 1 < 0 =3Cu2++2NO↑+4H2O,可以知道H+完全反应,由反应的离子方程式可以知道:n(NO)=0.06ml× SKIPIF 1 < 0 =0.015ml,V(NO)=0.015ml×22.4L/ml=0.336L;
答案选C。
【例4-2】.在加热的条件下,用MnO2与100 mL物质的量浓度为12 ml/L的浓盐酸反应,制得氯气2.24 L(标准状况)。(已知MnO2+4HCl(浓) SKIPIF 1 < 0 MnCl2+Cl2↑+2H2O)
(1)需要消耗MnO2的质量是多少?___________
(2)被氧化的HCl的物质的量是多少?___________
(3)反应中氧化产物与还原产物的物质的量之比是多少?___________
(4)若反应后溶液的体积不变,则反应后溶液中Cl-的物质的量浓度是多少?___________
【答案】(1)8.7 g
(2)0.2 ml
(3)1∶1
(4)10 ml·L-1
【解析】(1)根据n= SKIPIF 1 < 0 ,可得 n(Cl2)= SKIPIF 1 < 0 = 0.1ml,根据MnO2+4HCl (浓) SKIPIF 1 < 0 MnCl2+Cl2↑+2H2O,可得MnO2~Cl2,n(MnO2)=n(Cl2)=0.1ml,m(MnO2)=nM=0.1ml×87g/ml=8.7g;
(2)因Cl元素的化合价升高时被氧化,氧化产物为氯气,则被氧化的HCl的物质的量n=2n (Cl2) =2×0.1ml=0.2ml;
(3)反应中若有4ml浓HCl被消耗,其中2mlHCl被氧化,得到1ml氯气,为氧化产物;1ml二氧化锰被还原,得到1ml氯化锰,作还原产物,则氧化产物与还原产物的物质的量之比1:1;
(4)反应后溶液中的Cl减少了2×n (Cl2) =0.2ml,反应后溶液中n (Cl-) =12ml/L×0.1L-0.2ml= 1.0ml,则c(Cl-)= SKIPIF 1 < 0 = SKIPIF 1 < 0 = 10 ml·L-1。
【一隅三反】
1.(2022·河北沧州·高一期末)将mgFe、Cu合金投入足量稀硝酸中,固体完全溶解,共收集到2.24L(标准状况)NO气体,向反应后的溶液中加入过量的NaOH溶液,下列判断正确的是
A.Fe、Cu和稀硝酸反应,稀硝酸只表现了氧化性
B.最终所得溶液中溶质只有一种
C.整个过程中有0.1ml电子发生转移
D.理论上沉淀的质量为(m+5.1)g
【答案】D
【解析】A.Fe、Cu和稀HNO3反应,稀硝酸既表现了氧化性又表现了酸性,A项错误;
B.所得溶液中溶质有NaNO3和过量的NaOH两种,B项错误;
C.NO的物质的量为0.1ml,合金与稀硝酸反应中转移0.3ml电子,C.项错误;
D.最后得到的沉淀是Fe(OH)3和Cu(OH)2,沉淀的质量等于合金的质量和增加的OH-的质量之和,而增加的OH-的物质的量也等于整个过程中转移电子的物质的量,即增加的OH-的物质的量也是0.3ml,所以理论上沉淀的质量为mg+0.3ml×17g/ml=(m+5.1)g,D项正确。故选D。
2.(2022·山西忻州·高一期末)甲、乙两烧杯中各盛有100 mL 4 ml/L的盐酸和氢氧化钠溶液,向两烧杯中分别加入m g的铝粉,反应结束后,测得生成的同温同压下的气体体积为甲:乙=2:3,下列说法正确的是
A.甲、乙烧杯中参加反应的铝的质量之比为3:2
B.乙烧杯中剩余NaOH的物质的量为0.3 ml
C.加入铝粉的质量m=3.6g
D.甲烧杯中产生H2的体积为4.48 L(标准状况下)
【答案】D
【解析】发生反应2Al+6HCl=2AlCl3+3H2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 铝粉质量一定,盐酸和氢氧化钠溶液中溶质的物质的量相同,若酸、碱足量,生成气体相同;若铝粉都过量,酸、碱不足,生成气体为1:3,而实际反应结束后测得生成的气体体积比为甲:乙=2:3,说明在两个反应中Al不能都反应,也不能都有剩余,由方程式可知相同物质的量的Al完全反应消耗HCl的物质的量比消耗的NaOH多,故Al与盐酸反应时盐酸不足,Al与碱反应时碱过量,结合方程式计算解答;
A.甲、乙两烧杯中生成氢气的体积之比为2:3,根据电子转移守恒,可知甲、乙烧杯中参加反应的铝的质量之比为2:3, A错误;
B.反应结束后测得生成的同温同压下气体体积为甲:乙=2:3,则乙中生成H2的物质的量为0.3 ml,根据关系式2Al~2NaOH~3H2,参加反应的NaOH的物质的量为0. 2 ml,剩余NaOH的物质的量为0. 2 ml,故剩余NaOH为0.4ml-0.2ml=0.2ml,B错误;
C.乙烧杯中Al不足,Al完全反应,n乙(H2) =0.3ml,由2Al+2NaOH+2H2O=2NaAlO2+3H2↑,可知消耗Al为0.3ml× SKIPIF 1 < 0 =0.2ml,故加入Al粉质量为0.2ml×27g/ml=5.4g,C错误;
D.由B中分析可知,甲烧杯中产生H2的物质的量为0.2ml,甲烧杯中产生H2的体积为=0.2ml×22.4L/ml=4.48 L,D正确;故选D。
3.(2022·河南·许昌市普通教育教学研究室高一期末)现有NaCl和NaBr的混合物共2.2g,溶于水并加入过量的 SKIPIF 1 < 0 溶液后,生成AgCl和AgBr沉淀共4.75g,则原混合物中含钠元素的质量为
A.0.31B.0.69C.1.17D.2.55
【答案】B
【解析】混合物中氯化钠和溴化钠和过量的硝酸银反应得到的是氯化银和溴化银,所以质量差量是钠转化为银所致,设钠元素的质量为a(统一阴离子为X),则有
SKIPIF 1 < 0
SKIPIF 1 < 0 ,解得a=0.69g,故选B。
4.(2022·江苏省天一中学高一期末)请回答下列问题:
(1)标准状况下,V L氯化氢(HCl)溶解在1 L水中(水的密度近似为1 g/mL)所得溶液的密度为ρ g/mL,则所得盐酸物质的量浓度为_______
(2)将a ml钠和a ml铝一同投入m g足量水中,所得溶液密度为d g·mL-1,该溶液中溶质质量分数为_______
(3)在200 mL氯化镁和氯化铝的混合溶液中,c(Mg2+)为0.2 ml·L-1,c(Cl-)为1.3 ml·L-1。要使Mg2+全部转化为沉淀分离出来,至少需加4 ml·L-1 NaOH溶液的体积为_______
(4)某铁的氧化物(FexO)1.52 g溶于足量盐酸中,向所得溶液中通入112 mL Cl2(标准状况下),恰好将Fe2+完全氧化。x值为_______
(5)向一定量的FeO、Fe、Fe3O4的混合物中加入100 mL 1 ml·L-1的盐酸,恰好使混合物完全溶解,放出224 mL(标准状况)的气体,在所得溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是_______
(6)某无色溶液中含有H+、Al3+、Mg2+三种阳离子,逐滴加入0.1 ml·L-1 NaOH溶液,消耗NaOH溶液体积和生成沉淀之间的关系如下图所示。则溶液中H+、Al3+、Mg2+三种阳离子的物质的量浓度之比为_______
【答案】(1)1000Vρ/(36.5V+22400)
(2) SKIPIF 1 < 0
(3)80mL
(4)0.80
(5)2.8g
(6)2∶2∶1
【解析】(1)标准状况下,V L氯化氢的物质的量为 SKIPIF 1 < 0 ml,故溶质质量m= SKIPIF 1 < 0 g,溶液质量为( SKIPIF 1 < 0 +1000)g,则所得盐酸溶液的体积为 SKIPIF 1 < 0 10-3L,则盐酸物质的量浓度c= SKIPIF 1 < 0 = SKIPIF 1 < 0 ,故答案为: SKIPIF 1 < 0 。
(2)钠与水反应生成氢氧化钠和氢气,铝再和氢氧化钠溶液反应生成偏铝酸钠和氢气,由反应关系可知, SKIPIF 1 < 0 , SKIPIF 1 < 0 ,
所得溶质NaAlO2的质量为82a g,溶液质量为(23+27)a g+m g-( SKIPIF 1 < 0 ) SKIPIF 1 < 0 2g=(46a+m)g,则该溶液中溶质(NaAlO2)质量分数为 SKIPIF 1 < 0 100%= SKIPIF 1 < 0 ,故答案为: SKIPIF 1 < 0 。
(3)溶液中n(Cl-)=0.2L SKIPIF 1 < 0 1.3 ml·L-1=0.26ml,n(Mg2+)=0.2L SKIPIF 1 < 0 0.2 ml·L-1=0.04ml,根据电荷守恒,溶液中n(Al3+)= SKIPIF 1 < 0 =0.06ml,将200 mL此混合溶液中的Mg2+全部转化为沉淀分离出来,反应后的溶液为NaCl和NaAlO2的混合溶液,由原子守恒可知n(NaOH)= n(Na)= n(Cl)+n(Al)= 0.26ml+0.06ml=0.32ml,所以至少需加4 ml·L-1 NaOH溶液的体积为 SKIPIF 1 < 0 =0.08L=80mL,故答案为:80mL。
(4)根据得失电子守恒可知,FexO被氧化为Fe3+转移的电子数和Cl2被还原为Cl-转移的电子数相等,标准状况下112 mL Cl2反应转移电子的物质的量= SKIPIF 1 < 0 =0.01ml,则有 SKIPIF 1 < 0 (3- SKIPIF 1 < 0 ) SKIPIF 1 < 0 x=0.01,解得x=0.80,故答案为:0.80。
(5)盐酸恰好使混合物完全溶解,盐酸没有剩余,向反应所得溶液中加入KSCN溶液无血红色出现,说明溶液为FeCl2溶液,根据氯元素守恒可知n(FeCl2)= SKIPIF 1 < 0 n(HCl)= SKIPIF 1 < 0 0.1L SKIPIF 1 < 0 1 ml·L-1=0.05ml;用足量的CO在高温下还原相同质量的此混合物得到铁,根据铁元素守恒可知n(Fe)= n(FeCl2)=0.05ml,质量为0.05ml SKIPIF 1 < 0 56g/ml=2.8g,故答案为:2.8g。
(6)向混合溶液中加入NaOH溶液,NaOH先与H+反应,该反应过程没有沉淀生成,由图可知与H+反应的NaOH溶液的体积为10mL,溶液中H+的物质的量为0.01L SKIPIF 1 < 0 0.1 ml·L-1=0.001ml;当H+消耗完之后再加入NaOH溶液,会与Al3+和Mg2+反应生成沉淀,随着NaOH溶液的加入沉淀越来越多,但是当沉淀完全时,再加入NaOH溶液,由于氢氧化铝溶于NaOH溶液,所以沉淀的质量会减少,即图中的B-C段,此段消耗的NaOH溶液是10mL,根据氢氧化铝与氢氧化钠的反应方程式得出氢氧化铝的物质的量为0.01L SKIPIF 1 < 0 0.1 ml·L-1=0.001ml,溶液中Al3+的物质的量为0.001ml,参与生成沉淀的NaOH溶液在生成沉淀最多时消耗的NaOH溶液的体积是50mL-10mL=40mL,NaOH的物质的量为0.004ml,根据生成的氢氧化铝的物质的量可以得出与Al3+结合的氢氧根的物质的量为0.003ml,所以与Mg2+结合的氢氧根的物质的量为0.004ml-0.003ml=0.001ml,所以氢氧化镁的物质的量为0.0005ml,所以溶液中H+、Al3+、Mg2+三种阳离子的物质的量浓度之比为0.001: 0.001: 0.0005=2:2:1,故答案为:2:2:1。
人教版 (2019)必修 第二册第三节 无机非金属材料精品课后作业题: 这是一份人教版 (2019)必修 第二册第三节 无机非金属材料精品课后作业题,共21页。试卷主要包含了二氧化硅,硅酸,硅及硅化合物的综合运用,硅酸盐材料与无机非金属材料等内容,欢迎下载使用。
化学必修 第一册第二章 海水中的重要元素——钠和氯第二节 氯及其化合物课堂检测: 这是一份化学必修 第一册第二章 海水中的重要元素——钠和氯第二节 氯及其化合物课堂检测,共10页。
人教版 (2019)必修 第一册第三节 化学键精品巩固练习: 这是一份人教版 (2019)必修 第一册第三节 化学键精品巩固练习,共15页。














