






- 新教材适用2023_2024学年高中化学第3章铁金属材料第2节金属材料第1课时铁合金铝和铝合金新型合金课件新人教版必修第一册 课件 0 次下载
- 新教材适用2023_2024学年高中化学第3章铁金属材料第2节金属材料第2课时物质的量在化学方程式计算中的应用课件新人教版必修第一册 课件 0 次下载
- 新教材适用2023_2024学年高中化学第4章物质结构元素周期律实验活动3同周期同主族元素性质的递变课件新人教版必修第一册 课件 0 次下载
- 新教材适用2023_2024学年高中化学第4章物质结构元素周期律微专题5元素金属性非金属性强弱的比较课件新人教版必修第一册 课件 0 次下载
- 新教材适用2023_2024学年高中化学第4章物质结构元素周期律微专题6微粒半径大小的比较课件新人教版必修第一册 课件 0 次下载
人教版 (2019)必修 第一册第二节 金属材料教学演示ppt课件
展开一、金属重要性质的多角度考查1.以下7种化合物中,不能通过化合反应直接生成的有( )①Fe3O4 ②Fe(OH)3 ③FeCl2 ④Na2O2 ⑤Al(OH)3 ⑥Na2CO3 ⑦NaHCO3 A.1种B.2种 C.3种D.4种
2.下列关于金属元素特征的叙述正确的是( )A.金属元素的原子只有还原性,离子只有氧化性B.金属元素在化合物中一定显正价C.金属单质都可以和酸反应置换出氢气D.金属元素的单质在常温下均为固体
3.下列关于钠、铝、铁、铜和氧气的反应,不正确的是( )A.铁在氧气中燃烧,产物为四氧化三铁B.铝表面很容易被氧气氧化,生成致密的氧化物保护膜C.钠常温下和氧气反应,生成淡黄色的过氧化钠D.铜可以在加热的条件下和氧气反应,生成氧化铜
二、铁的重要化合物的综合4.(2023·西安市阎良区关山中学高一质检)下列铁单质及其化合物的性质与用途具有对应关系的是( )A.Fe2O3能与酸反应,可用作红色颜料B.K2FeO4具有强氧化性,可用于水体的消毒C.FeSO4具有还原性,可用作补血剂D.铁粉具有磁性,可用作食品袋内的抗氧化剂
解析:氧化铁为红棕色,可用作红色颜料,与其能与酸反应无关,A项错误;K2FeO4具强氧化性,能使蛋白质变性,可用于水体消毒,B项正确;FeSO4用作补血剂,与还原性无关,C项错误;铁粉具有还原性,可用做食品袋内的抗氧化剂,D项错误。
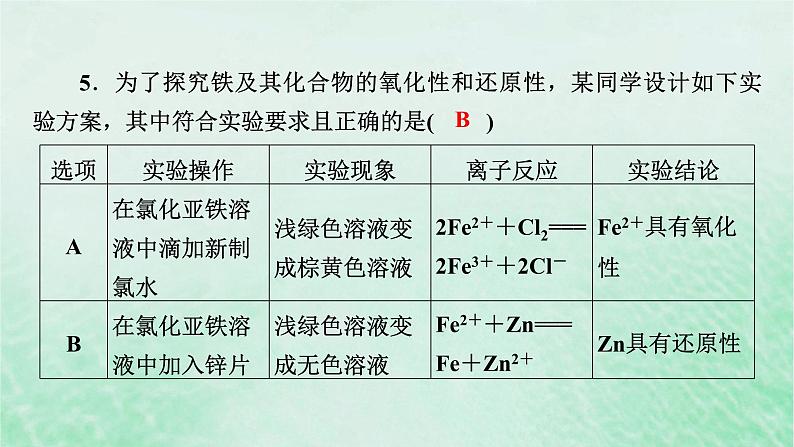
5.为了探究铁及其化合物的氧化性和还原性,某同学设计如下实验方案,其中符合实验要求且正确的是( )
6.向一定质量FeCl2和CuCl2的混合溶液中逐渐加入足量的锌粒,下列图像不能正确反映对应关系的是( )
解析: 金属的活动性是锌>铁>铜,故锌先与氯化铜反应,当氯化铜反应完全后再与氯化亚铁反应:Zn+CuCl2===Cu+ZnCl2 溶液增量65 64 65-64=1Zn+FeCl2===Fe+ZnCl2 溶液增量65 56 65-56=9锌先与氯化铜反应,生成铜的质量不断增加,直至氯化铜反应完全,A项正确;由上述分析可知,前者溶液增加的幅度小于后者,B项正确;随着锌与氯化亚铁反应,氯化亚铁的质量逐渐减小,完全反应后为0,故C项正确;原溶液中不存在氯化锌,起始点应为0,故D项错误。
8.Mg、Al组成的混合物与足量盐酸反应,产生标准状况下的氢气4.48 L。下列推断中不正确的是( )A.参加反应的Mg、Al共0.2 mlB.参加反应的HCl为0.4 mlC. Mg、Al在反应中共失去0.4 ml电子D.若与足量的稀硫酸反应能产生0.2 ml H2
9.如图是某学校实验室从化学试剂商店买回来的氢氧化钠试剂标签上的部分内容。某同学从该试剂瓶中取出24.0 g固体,配成1 L溶液,请计算:氢氧化钠 化学纯(CP)500 g品名:氢氧化钠化学式:NaOH相对分子质量:40
(1)所得氢氧化钠溶液的物质的量浓度为_________________。(2)从所得氢氧化钠溶液中取出200 mL于一烧杯中,投入足量的金属铝,完全反应后,产生的气体在标准状况下的体积为___________。
10.将5 g钠、铝合金投入200 mL的水中,固体完全溶解,产生4.48 L(标准状况下)气体,溶液中只有一种溶质。回答下列问题:(1)处理计算问题,可以用图示分析的方法。
写出化学式:A_______,B___________,C_______________。经过分析得出钠、铝合金中两金属的物质的量之比为_________。(2)所得溶液的物质的量浓度为________________________。(假设反应前后溶液体积变化忽略不计)
11.镁铝合金具有很好的强度、刚性和尺寸稳定性,常用来制作又轻又薄的笔记本电脑、手机等的外壳。把10.2 g镁铝合金的粉末放入过量的烧碱溶液中,在标准状况下生成6.72 L氢气。试计算:(1)该合金中铝的质量分数是______________。(2)该合金中镁与铝的物质的量之比是_________。(3)该合金溶于足量的盐酸中,标准状况下产生氢气的体积是______________。
(3)设由铝生成的氢气为V1(H2),由镁生成的氢气为V2(H2),由铝和镁与盐酸的反应可知:2Al+6HCl===2AlCl3+3H2↑2 ml 3×22.4 L0.2 ml V1(H2)解得:V1(H2)=6.72 L,Mg+2HCl===MgCl2+H2↑1 ml 22.4 L0.2 ml V2(H2)解得:V2(H2)=4.48 L,V总(H2)=V1(H2)+V2(H2)=6.72 L+4.48 L=11.2 L。
12.2.3 g钠投入97.8 g水中,反应完毕后,得到100 mL溶液,计算:(1)产生的氢气在标准状况下的体积。(2)所得氢氧化钠溶液的溶质质量分数。(3)所得氢氧化钠溶液中溶质的物质的量浓度。答案:(1)1.12 L (2)4.0% (3)1 ml·L-1
人教版 (2019)必修 第一册第二节 元素周期律教课内容课件ppt: 这是一份人教版 (2019)必修 第一册第二节 元素周期律教课内容课件ppt,共22页。PPT课件主要包含了阶段重点突破练六等内容,欢迎下载使用。
化学必修 第一册第二节 金属材料教课ppt课件: 这是一份化学必修 第一册第二节 金属材料教课ppt课件,共35页。PPT课件主要包含了第二节金属材料,粒子个数,物质的量,随堂演练•知识落实等内容,欢迎下载使用。
化学必修 第一册第三章 铁 金属材料第二节 金属材料备课ppt课件: 这是一份化学必修 第一册第三章 铁 金属材料第二节 金属材料备课ppt课件,共33页。PPT课件主要包含了第二节金属材料,铁合金,碳素钢,合金钢,②碳素钢,耐腐蚀,抗腐蚀,铝和铝合金,氧化铝,逐渐溶解等内容,欢迎下载使用。













