






课件 高考化学一轮复习第一单元 物质及其变化 第五讲 氧化还原反应的配平与计算
展开第5讲 氧化还原反应的配平与计算
考点一 氧化还原反应方程式的配平考点二 电子守恒法计算及应用经典真题·明考向作业手册
夯实必备知识 | 提升关键能力
考点一 氧化还原反应方程式的配平
1. 氧化还原反应方程式的配平
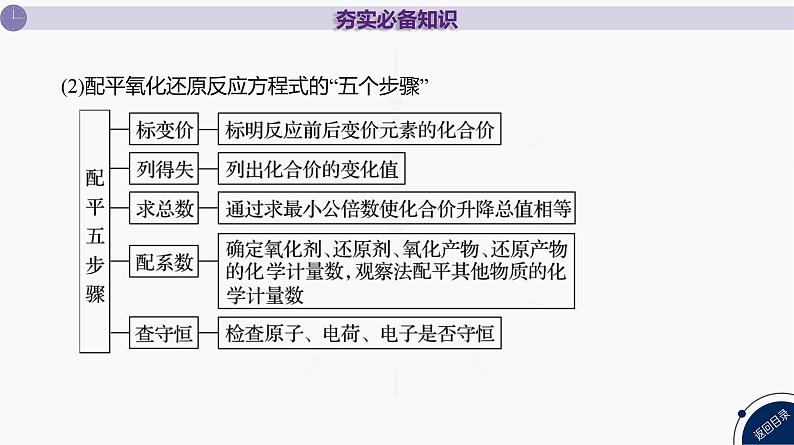
(2)配平氧化还原反应方程式的“五个步骤”
题组 氧化还原反应方程式的配平
2.重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3。对于制备过程中涉及的反应FeO·Cr2O3+Na2CO3+NaNO3 Na2CrO4+Fe2O3+CO2↑+NaNO2(未配平),配平后FeO·Cr2O3与NaNO3的化学计量数之比为 。
第三步:求总数确定氧化剂(或还原产物)和还原剂(或氧化产物)的化学计量数。第四步:配化学计量数先配平变价元素,再利用Na、C原子守恒配平其他物质。2FeO·Cr2O3+4Na2CO3+7NaNO3 4Na2CrO4+Fe2O3+4CO2↑+7NaNO2第五步:查守恒检查剩余O原子是否守恒。FeO·Cr2O3的化学计量数为2,NaNO3的化学计量数为7,故FeO·Cr2O3与NaNO3的化学计量数之比为2∶7。
【方法技巧】 “三步法”配平缺项氧化还原反应方程式
考点二 电子守恒法计算及应用
1. 电子得失守恒法的基本依据
得到电子总数= 失去电子总数。
2. 氧化还原反应的计算步骤
(2)多步连续进行的氧化还原反应的有关计算有的试题反应过程多,涉及的氧化还原反应也多,数量关系较为复杂,若用常规方法求解比较困难,若抓住失电子总数等于得电子总数这一关系,则解题就变得很简单。解这类试题时,注意不要遗漏某个氧化还原反应,要理清具体的反应过程,分析在整个反应过程中化合价发生变化的元素原子得电子数目和失电子数目。
判断正误(正确的打“√”,错误的打“×”)(1)在反应KIO3+6HI = KI+3I2+3H2O中,每生成3 ml I2,转移的电子数为6NA (设NA为阿伏伽德罗常数的值)( ) (2)(NH4)2PtCl6晶体受热分解,生成氮气、氯化氢、氯化铵和金属铂,在此分解反应中,氧化产物与还原产物的物质的量之比是2∶3( )(3)反应11P+15CuSO4+24H2O = 5Cu3P+6H3PO4+15H2SO4,氧化产物和还原产物的物质的量之比为6∶5( )
题组一 一步反应电子守恒计算
1.多硫化钠Na2Sx(x≥2)在结构上与Na2O2、FeS2、CaC2等有相似之处。Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,反应中Na2Sx与NaClO的物质的量之比为1∶16,则x的值是( )A.2B.3 C.4D.5
2.[2022·辽宁卷节选] 取2.50 g H2O2产品,加蒸馏水定容至100 mL,摇匀。取20.00 mL于锥形瓶中,用0.050 0 ml·L-1酸性KMnO4标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为19.98 mL、20.90 mL、20.02 mL。假设其他杂质不干扰结果,产品中H2O2质量分数为 。
题组二 多步反应电子守恒计算
3.取m g铜镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生8960 mL的NO2气体和672 mL 的N2O4气体(均已折算为标准状况),在反应后的溶液中加入足量的氢氧化钠溶液,生成沉淀质量为17.02 g,则m等于( )
[解析] (1)KIO3将Sn2+反应完全后,开始将I-氧化为I2,故滴定终点的现象为当加入最后半滴KIO3标准溶液时,溶液由无色变为蓝色,且半分钟内不褪色。
当加入最后半滴KIO3标准溶液时,溶液由无色变为蓝色,且半分钟内不褪色
(2)称取m g SnO2样品,用上述方法滴定,若滴定终点时消耗0.010 00 ml·L-1 KIO3标准溶液V mL,则测得SnO2纯度为 %。
1. [2021·北京卷] 用电石(主要成分为CaC2,含CaS和Ca3P2等)制取乙炔时,常用CuSO4溶液除去乙炔中的杂质。反应为①CuSO4+H2S = CuS↓+H2SO4②11PH3+24CuSO4+12H2O = 3H3PO4+24H2SO4+8Cu3P↓下列分析不正确的是( )A.CaS、Ca3P2发生水解反应的化学方程式:CaS+2H2O = Ca(OH)2+H2S↑、Ca3P2+6H2O = 3Ca(OH)2+2PH3↑B.不能依据反应①比较硫酸与氢硫酸的酸性强弱C.反应②中每24 ml CuSO4氧化11 ml PH3D.用酸性KMnO4溶液验证乙炔还原性时,H2S、PH3有干扰
[解析] 水解过程中元素的化合价不变,根据水解原理结合乙炔中常混有H2S、PH3可知CaS的水解方程式为CaS+2H2O = Ca(OH)2+H2S↑;Ca3P2的水解方程式为Ca3P2+6H2O = 3Ca(OH)2+2PH3↑,A项正确。反应①能发生是因为有不溶于水也不溶于酸的CuS生成,因此反应①不能说明H2S的酸性强于H2SO4,事实上硫酸的酸性强于氢硫酸,B项正确。反应②中Cu元素化合价从+2价降低到+1价,得到1个电子,P元素化合价从-3价升高到+5价,失去8个电子,则24 ml CuSO4完全反应时,可氧化PH3的物质的量是24 ml÷8=3 ml,C项错误。H2S、PH3均可被酸性KMnO4溶液氧化,所以会干扰酸性KMnO4溶液对乙炔性质的检验,D项正确。
溶液蓝色消失,且半分钟内不恢复原来的颜色
1. ClO2是新一代饮用水的消毒剂,许多发达国家的自来水厂采用ClO2代替Cl2来进行自来水消毒。我国成功研制出制取ClO2的新方法,其反应的微观过程如图所示: 下列有关该反应的叙述中正确的是( )A.该反应是复分解反应B.该反应的化学方程式为Cl2+2NaClO2 = 2ClO2+2NaClC.反应中Cl2既是氧化剂,又是还原剂D.氧化性:Cl2
[解析] 该反应中,KMnO4是氧化剂,Cl2是氧化产物,则氧化性:KMnO4>Cl2,A错误;Mn元素的化合价由+7价降低到+2价,HCl中部分Cl元素的化合价由-1价升高到0价,根据化合价升降总数相等配平化学方程式可得2KMnO4+16HCl(浓) = 2KCl+2MnCl2+5Cl2↑+8H2O,B正确;
该反应中,部分HCl生成MnCl2和KCl,表现出酸性,部分HCl被氧化生成Cl2,作为还原剂,表现出还原性,C错误;氧化性:KMnO4>Cl2,而Cl2的氧化性强于Fe3+,故该反应不能发生,D错误。
3. 氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:(1)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为 。
[解析] (1)根据题意,Cl2与HgO反应中,Cl2中Cl元素的化合价既升高又降低,所以反应的化学方程式为2Cl2+HgO = HgCl2+Cl2O。
2Cl2+HgO = HgCl2+Cl2O
(2)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 ml ClO2消耗NaClO2的量为 ml;产生“气泡”的化学方程式为 。
NaHCO3+NaHSO4 = CO2↑+Na2SO4+H2O
(3)“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是 (用离子方程式表示)。工业上是将氯气通入30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000 kg该溶液需消耗氯气的质量为 kg (保留整数)。
ClO-+Cl-+2H+ = Cl2↑+H2O
4. MnO2是重要化工原料,由软锰矿制备MnO2的一种工艺流程如下:[资料]软锰矿的主要成分为MnO2,主要杂质有Al2O3和SiO2。(1)电解。Mn2+纯化液经电解得MnO2。生成MnO2的电极反应式是 。
[解析] (1)电解时,溶液呈酸性,Mn2+失电子,与水反应生成二氧化锰和H+,则电极反应式为Mn2+-2e-+2H2O = MnO2+4H+。
Mn2+-2e-+2H2O = MnO2+4H+
考点一 氧化还原反应的配平及分析
2. 在有氧条件下,硫杆菌可将黄铁矿(主要成分为FeS2)和单质S分别氧化为硫酸,其中FeS2发生反应的化学方程式为FeS2+O2+H2O → FeSO4+H2SO4(未配平),下列说法正确的是( )A.根据反应可推断任何条件下O2都不能将Fe2+氧化为Fe3+B.温度越高,该反应的速率越快C.反应中氧化剂与还原剂的物质的量之比为2∶7D.该环境中,单质S反应的化学方程式为2S+3O2+2H2O = 2H2SO4
6. [2023·浙江金丽衢十二校联考] 已知酸性KMnO4溶液能被Na2SO3溶液还原成Mn2+而使溶液褪色。欲使20.00 mL 1.000×10-2 ml·L-1酸性KMnO4溶液恰好褪色,需消耗25.00 mL Na2SO3溶液,则该Na2SO3溶液的物质的量浓度(单位:ml·L-1)为( )×10-2×10-×10-2×10-2
8. [2024·湖南益阳四校联考] 三氟化溴有强氧化性和强反应活性,是一种良好的非水溶剂,遇水立即发生如下反应:3BrF3+5H2O = HBrO3+Br2+9HF+O2↑,下列有关该反应的说法不正确的是( )A.当0.5 ml H2O被氧化时,生成0.1 ml O2B.氧化剂与还原剂的物质的量之比为2∶3C.当转移6 ml电子时,生成的还原产物为1 mlD.当生成2.7 ml HF时,被BrF3还原的BrF3为0.2 ml
10. [2023·湖北部分重点校联考] 一定量的某磁黄铁矿(主要成分FexS,S为-2价)与100 mL盐酸恰好完全反应(矿石中其他成分不与盐酸反应),生成3.2 g硫单质、0.4 ml FeCl2和一定量H2S气体,且溶液中无Fe3+。则下列说法正确的是( )A.该盐酸的物质的量浓度为4.0 ml·L-1B.该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为2∶1C.生成的H2S气体在标准状况下的体积为8.96 LD.该磁黄铁矿中FexS的x=0.85
11. [2024·辽宁沈阳二十中一模] 38.4 g Cu与一定量浓硝酸恰好完全反应生成氮氧化物,这些氮氧化物恰好溶解在NaOH溶液中得到NaNO3和NaNO2的混合溶液,反应过程及有关数据如图所示。下列有关该过程的判断不正确的是( )A.氮氧化物和NaOH溶液反应时,NO作还原剂B.0.9 ml混合气体中N2O4的物质的量是0.2 mlC.若浓硝酸体积为200 mL,则其物质的量浓度为11 ml·L-1D.欲使上述0.9 ml氮氧化物完全被水吸收,理论上至少需要通入标准状况下的O2体积为6.72 L
[解析] 电氮氧化物和NaOH溶液反应生成硝酸钠和亚硝酸钠,两钠盐中N元素的化合价分别为+5价、+3价,NO中N元素的化合价为+2价,NO2、N2O4中N元素的化合价为+4价,由价态可知NO作还原剂,A正确;由题意可知0.9 ml氮氧化物转化为钠盐的物质的量为0.5 L×2 ml·L-1=1 ml,所以混合气体中N2O4的物质的量是0.1 ml,B错误;
0.9 ml 氮氧化物完全被水吸收,可知氮氧化物与氧气恰好完全反应生成硝酸,总过程可视为Cu与氧气、硝酸反应最终生成硝酸铜和水,根据得失电子守恒可知,转移电子物质的量为n(e-)=2n(Cu)=1.2 ml,1 ml O2反应转移4 ml电子,则消耗0.3 ml O2,标准状况下体积为6.72 L,D正确。
12. [2023·湖南益阳质检] 中科院发现深海处在微生物作用下的含硫物质的变化过程如图所示(已略去部分不含硫物质)。有关转化过程说法错误的是( )A.CN-中含有的σ键与π键的数目之比为1∶2B.x=21,y=24C.SCN-既被氧化又被还原D.理论上每产生1 ml HS-,转移44 ml e-
考点三 氧化还原反应综合考查
CO2溶于水后呈酸性,可以提供H+,有利于pH维持在4.0~6.0
PPT课件 高考化学一轮复习第一单元物质的分类及转化 第五讲 氧化还原反应的配平与计算: 这是一份PPT课件 高考化学一轮复习第一单元物质的分类及转化 第五讲 氧化还原反应的配平与计算,共60页。PPT课件主要包含了夯实必备知识,1配平原则,对点自测,H2O,提升关键能力,OH-,氧化剂,还原剂,1一般步骤,还原产物等内容,欢迎下载使用。
PPT课件 高考化学一轮复习第一单元物质的分类及转化 第五讲 氧化还原反应的配平与计算: 这是一份PPT课件 高考化学一轮复习第一单元物质的分类及转化 第五讲 氧化还原反应的配平与计算,共60页。PPT课件主要包含了夯实必备知识,1配平原则,对点自测,H2O,提升关键能力,OH-,氧化剂,还原剂,1一般步骤,还原产物等内容,欢迎下载使用。
2024年高考化学一轮复习氧化还原反应的配平与计算课件: 这是一份2024年高考化学一轮复习氧化还原反应的配平与计算课件,共35页。PPT课件主要包含了本节目录,基础重现等内容,欢迎下载使用。












