





还剩16页未读,
继续阅读
所属成套资源:高一化学同步精品课件(苏教版2019必修第一册)
成套系列资料,整套一键下载
专题1 第3单元 课题2 电解质溶液 高一化学同步精品课件(苏教版2019必修第一册)
展开
这是一份专题1 第3单元 课题2 电解质溶液 高一化学同步精品课件(苏教版2019必修第一册),共24页。
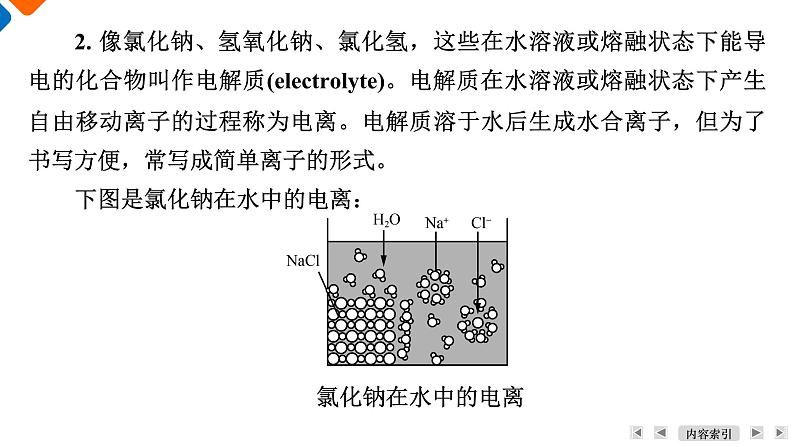
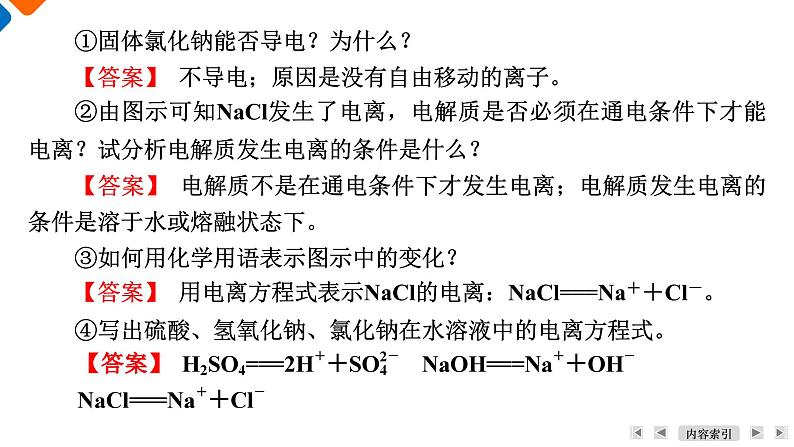
学 习 目 标1. 知道电解质和非电解质的概念。2. 认识酸、碱、盐等电解质在水溶液中或熔融状态下能发生电离。3. 能用电离方程式表示某些酸、碱、盐的电离。活 动 方 案1. 氯化钠、氢氧化钠、氯化氢等物质溶于水为什么有导电性?氯化钠、氢氧化钠等熔融状态时为什么有导电性?【答案】 NaCl、NaOH和HCl等物质溶于水后,在水分子的作用下产生能够自由移动的水合离子,从而使溶液具有导电性。NaCl、NaOH等固体加热至熔融状态,它们也会产生自由移动的离子,也具有导电性。活动一:从微观角度探究可溶性酸、碱、盐的导电性2. 像氯化钠、氢氧化钠、氯化氢,这些在水溶液或熔融状态下能导电的化合物叫作电解质(electrolyte)。电解质在水溶液或熔融状态下产生自由移动离子的过程称为电离。电解质溶于水后生成水合离子,但为了书写方便,常写成简单离子的形式。下图是氯化钠在水中的电离:氯化钠在水中的电离①固体氯化钠能否导电?为什么?【答案】 不导电;原因是没有自由移动的离子。②由图示可知NaCl发生了电离,电解质是否必须在通电条件下才能电离?试分析电解质发生电离的条件是什么?【答案】 电解质不是在通电条件下才发生电离;电解质发生电离的条件是溶于水或熔融状态下。③如何用化学用语表示图示中的变化?【答案】 用电离方程式表示NaCl的电离:NaCl===Na++Cl-。④写出硫酸、氢氧化钠、氯化钠在水溶液中的电离方程式。3. 根据下列化合物置于水中的导电情况,写出其在水中粒子存在形式的化学符号。Mg(OH)2K+、OH-BaSO4Fe2O3(1) 上述在水溶液中能导电的物质具有什么特征?【答案】 易溶于水,且在水中能电离出可以自由移动的离子。(2) 写出上述能导电的化合物在水中的电离方程式。HCl、H2SO4等酸在水溶液中都能电离出H+,而且溶液中所有的阳离子都是H+。从电离的角度看,酸是电离时生成的阳离子全部是H+的化合物。NaOH、Ca(OH)2等碱在水溶液中都能电离出OH-,而且溶液中所有的阴离子都是OH-。从电离的角度看,碱是电离时生成的阴离子全部是OH-的化合物。NaCl、(NH4)2SO4等盐在水溶液中都能电离出金属阳离子(或铵根离子)和酸根阴离子。活动二:从电解质电离角度探究酸、碱、盐的概念(1) 书写氯化氢、氢氧化钡、硫酸铁等物质溶于水的电离方程式。(2) NaHCO3、NaHSO4在水中如何电离?二者属于酸、碱、盐中哪类物质?1. 蔗糖、酒精等化合物的水溶液不导电,熔融状态下也不能导电,这种化合物属于非电解质。那么从微观看,非电解质在水溶液或熔融状态下以什么形式存在呢?非电解质分子本身一般在水溶液或熔融状态下能否电离?【答案】 蔗糖、酒精等化合物,无论是在水溶液中,还是在熔融状态下均以分子形式存在。非电解质分子本身一般在水溶液或熔融状态下不能电离。活动三:学习非电解质的概念2. 在哪个层面更深入的考查溶液的组成,可以解释电解质、非电解质溶液的性质差异?【答案】 从离子、分子层面考察溶液的组成,更能解释电解质、非电解质溶液的性质差异。课 堂 反 馈24513761. (2022·连云港期末)分类是学习和研究化学的一种重要方法。下列物质中,属于非电解质的是( )A. 铜 B. 食盐水C. 氯化氢 D. 二氧化碳【答案】 D【解析】 电解质首先是化合物,铜是单质,食盐水是混合物。酸、碱、盐是电解质。故选D。2451376【答案】 A【解析】 酸的通性指能与碱(B)、碱性氧化物(C)、盐(D)等反应。2453763. 下列四项都能导电,其中一项与其他三项导电原理不同的是( )A. 氯化钠熔化导电 B. 液态汞导电C. 硫酸溶液导电 D. 熔融状态氢氧化钾导电1【答案】 B【解析】 电解质硫酸、氯化钠、氢氧化钾溶于水或熔融状态下,都能电离产生自由移动的离子而导电;金属汞是自由电子定向移动而导电。2453761【答案】 A2453765. 下列关于纯净物、混合物、电解质、非电解质的正确组合为( )1245376【答案】 B1【解析】 盐酸为氯化氢和水的混合物,不是纯净物,A错误;冰水混合物为纯净物,蔗糖溶液为混合物,氧化铝为金属氧化物,熔融时电离出阴、阳离子,属于电解质,二氧化硫溶于水生成亚硫酸导电,但是二氧化硫为非电解质,B正确;电解质研究的范围为化合物,铁为单质,C错误;浓硫酸中含有极少量的水,为混合物,不是纯净物,碳酸钠为电解质,不是非电解质,D错误。2453766. (2022·安康期中)下列叙述中,正确的是( )A. 硫酸钡在水中溶解度很小,所以硫酸钡不是电解质B. NH3的水溶液能导电,但NH3是非电解质C. 电解质在通电时才能发生电离D. 硫酸不能导电,但硫酸溶液能导电,所以硫酸溶液是电解质1【答案】 B【解析】 盐是电解质,与溶解度大小无关,A错误;NH3是非电解质,溶于水能导电是生成NH3·H2O,NH3·H2O是电解质,B正确;电解质在水溶液或熔融状态下能电离,通电是电解,C错误;硫酸是电解质,硫酸溶液是混合物,既不是电解质也不是非电解质,D错误。2453767. (1) 现有下列物质:①铁片、②饱和食盐水、③稀硫酸、④酒精、⑤干冰、⑥熔融KNO3、⑦BaSO4固体、⑧氢氧化钠固体,其中属于非电解质的是_______(填序号,下同),不能导电但属于电解质的是______。(2) 写出下列物质的电离方程式。①KAl(SO4)2:__________________________________________;②NH4NO3:________________________________。1④⑤⑦⑧谢谢观看Thank you for watching
学 习 目 标1. 知道电解质和非电解质的概念。2. 认识酸、碱、盐等电解质在水溶液中或熔融状态下能发生电离。3. 能用电离方程式表示某些酸、碱、盐的电离。活 动 方 案1. 氯化钠、氢氧化钠、氯化氢等物质溶于水为什么有导电性?氯化钠、氢氧化钠等熔融状态时为什么有导电性?【答案】 NaCl、NaOH和HCl等物质溶于水后,在水分子的作用下产生能够自由移动的水合离子,从而使溶液具有导电性。NaCl、NaOH等固体加热至熔融状态,它们也会产生自由移动的离子,也具有导电性。活动一:从微观角度探究可溶性酸、碱、盐的导电性2. 像氯化钠、氢氧化钠、氯化氢,这些在水溶液或熔融状态下能导电的化合物叫作电解质(electrolyte)。电解质在水溶液或熔融状态下产生自由移动离子的过程称为电离。电解质溶于水后生成水合离子,但为了书写方便,常写成简单离子的形式。下图是氯化钠在水中的电离:氯化钠在水中的电离①固体氯化钠能否导电?为什么?【答案】 不导电;原因是没有自由移动的离子。②由图示可知NaCl发生了电离,电解质是否必须在通电条件下才能电离?试分析电解质发生电离的条件是什么?【答案】 电解质不是在通电条件下才发生电离;电解质发生电离的条件是溶于水或熔融状态下。③如何用化学用语表示图示中的变化?【答案】 用电离方程式表示NaCl的电离:NaCl===Na++Cl-。④写出硫酸、氢氧化钠、氯化钠在水溶液中的电离方程式。3. 根据下列化合物置于水中的导电情况,写出其在水中粒子存在形式的化学符号。Mg(OH)2K+、OH-BaSO4Fe2O3(1) 上述在水溶液中能导电的物质具有什么特征?【答案】 易溶于水,且在水中能电离出可以自由移动的离子。(2) 写出上述能导电的化合物在水中的电离方程式。HCl、H2SO4等酸在水溶液中都能电离出H+,而且溶液中所有的阳离子都是H+。从电离的角度看,酸是电离时生成的阳离子全部是H+的化合物。NaOH、Ca(OH)2等碱在水溶液中都能电离出OH-,而且溶液中所有的阴离子都是OH-。从电离的角度看,碱是电离时生成的阴离子全部是OH-的化合物。NaCl、(NH4)2SO4等盐在水溶液中都能电离出金属阳离子(或铵根离子)和酸根阴离子。活动二:从电解质电离角度探究酸、碱、盐的概念(1) 书写氯化氢、氢氧化钡、硫酸铁等物质溶于水的电离方程式。(2) NaHCO3、NaHSO4在水中如何电离?二者属于酸、碱、盐中哪类物质?1. 蔗糖、酒精等化合物的水溶液不导电,熔融状态下也不能导电,这种化合物属于非电解质。那么从微观看,非电解质在水溶液或熔融状态下以什么形式存在呢?非电解质分子本身一般在水溶液或熔融状态下能否电离?【答案】 蔗糖、酒精等化合物,无论是在水溶液中,还是在熔融状态下均以分子形式存在。非电解质分子本身一般在水溶液或熔融状态下不能电离。活动三:学习非电解质的概念2. 在哪个层面更深入的考查溶液的组成,可以解释电解质、非电解质溶液的性质差异?【答案】 从离子、分子层面考察溶液的组成,更能解释电解质、非电解质溶液的性质差异。课 堂 反 馈24513761. (2022·连云港期末)分类是学习和研究化学的一种重要方法。下列物质中,属于非电解质的是( )A. 铜 B. 食盐水C. 氯化氢 D. 二氧化碳【答案】 D【解析】 电解质首先是化合物,铜是单质,食盐水是混合物。酸、碱、盐是电解质。故选D。2451376【答案】 A【解析】 酸的通性指能与碱(B)、碱性氧化物(C)、盐(D)等反应。2453763. 下列四项都能导电,其中一项与其他三项导电原理不同的是( )A. 氯化钠熔化导电 B. 液态汞导电C. 硫酸溶液导电 D. 熔融状态氢氧化钾导电1【答案】 B【解析】 电解质硫酸、氯化钠、氢氧化钾溶于水或熔融状态下,都能电离产生自由移动的离子而导电;金属汞是自由电子定向移动而导电。2453761【答案】 A2453765. 下列关于纯净物、混合物、电解质、非电解质的正确组合为( )1245376【答案】 B1【解析】 盐酸为氯化氢和水的混合物,不是纯净物,A错误;冰水混合物为纯净物,蔗糖溶液为混合物,氧化铝为金属氧化物,熔融时电离出阴、阳离子,属于电解质,二氧化硫溶于水生成亚硫酸导电,但是二氧化硫为非电解质,B正确;电解质研究的范围为化合物,铁为单质,C错误;浓硫酸中含有极少量的水,为混合物,不是纯净物,碳酸钠为电解质,不是非电解质,D错误。2453766. (2022·安康期中)下列叙述中,正确的是( )A. 硫酸钡在水中溶解度很小,所以硫酸钡不是电解质B. NH3的水溶液能导电,但NH3是非电解质C. 电解质在通电时才能发生电离D. 硫酸不能导电,但硫酸溶液能导电,所以硫酸溶液是电解质1【答案】 B【解析】 盐是电解质,与溶解度大小无关,A错误;NH3是非电解质,溶于水能导电是生成NH3·H2O,NH3·H2O是电解质,B正确;电解质在水溶液或熔融状态下能电离,通电是电解,C错误;硫酸是电解质,硫酸溶液是混合物,既不是电解质也不是非电解质,D错误。2453767. (1) 现有下列物质:①铁片、②饱和食盐水、③稀硫酸、④酒精、⑤干冰、⑥熔融KNO3、⑦BaSO4固体、⑧氢氧化钠固体,其中属于非电解质的是_______(填序号,下同),不能导电但属于电解质的是______。(2) 写出下列物质的电离方程式。①KAl(SO4)2:__________________________________________;②NH4NO3:________________________________。1④⑤⑦⑧谢谢观看Thank you for watching
相关资料
更多









