


广西南宁市武鸣区2023-2024学年高三上学期开学调研测试(8月月考)化学试题(Word版含答案)
展开南宁市武鸣区2023-2024学年高三上学期开学调研测试(8月月考)
化 学
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 P-31 K-39 Mn-55
一、选择题:本题共 15 小题,每小题 3 分,共 45 分。每小题只有一个选项符合题目要求。
1.中华民族文明源远流长,众多珍贵文物折射出五千年璀璨文明。下列文物的主要成分属于无机非金属材料的是
文物 | ||||
选项 | A.西汉素纱禅衣 | B.清紫檀雕花宝座 | C.五羊方尊 | D.青玉交龙钮玉玺 |
A.A B. B C.C D. D
2.近年来,我国的航天技术发展迅速,天宫、天和、天问、神舟等体现了中国的强大科技力量。下列说法不正确的是
A. “天宫二号”部分零部件使用钛合金,钛合金中存在金属键
B. “天和号”使用砷化镓(GaAs)太阳能电池,供电时砷化镓发生氧化还原反应
C. “天问一号”隔热材料使用SiO2纳米气凝胶,SiO2属于酸性氧化物
D."神州十三号”耐高温材料使用酚醛树脂,酚醛树脂属于合成高分子
3.湖南的美食有臭豆腐、葱油粑粑、糖油坨坨、茶颜悦色等。下列有关叙述错误的是
A. “臭豆腐”的原材料之一为豆腐,豆腐在制作过程中涉及胶体的聚沉
B. “葱油粑粑”中的“油”属于酯类,是高分子
C. “茶颜悦色”中的奶油可通过植物油的氢化获得
D. 我国规定商家不得无偿提供塑料袋,目的是减少聚乙烯等难降解的“白色污染”
4.下列有关化学用语表示正确的是
.
A. 氨基的电子式:H:N:H B. 基态铬原子的价层电子排布式:3d4 4s2
‥
C. H2O 的 VSEPR 模型: D. 葡萄糖的实验式:C6H12O6
5.设 NA为阿伏伽德罗常数的值,下列说法错误的是
A. 常温常压下,12g金刚石含有的C-C键数目为2NA
B. 标准状况下,11.2L HF含有0.5NA个 HF 分子
C. 30 g C2H6中含有极性共价键的数目为6NA
D. 1mol硝基与46g二氧化氮所含的电子数均为23NA
6.常温下,下列各离子组在指定溶液中能大量存在的是
A. 无色溶液:K+、MnO4-、NO3- B.c(Fe3+) =0.1mol/L的溶液:H+、I-、Br-
C. 使石蕊变红的溶液:NH4+、NO3-、Cl- D. PH=13的溶液中:Na+、ClO-、HCO3-
7.下列指定反应的离子方程式错误的是
A. 明矾溶液中加入少量的Ba(OH)2:2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓
B. 向氯化铁中加入少量的H2S:2Fe3++H2S=2Fe2++S↓+2H+
C. 四氯化钛的浓溶液制备水合二氧化钛:Ti4++(x+2)H2O=TiO2·x H2O↓ +4H+
D. 次氯酸钠溶液中通入少量CO2:2 ClO-+ CO2+H2O=2HClO+ CO32- (已知酸性H2CO3>HClO> HCO3-)
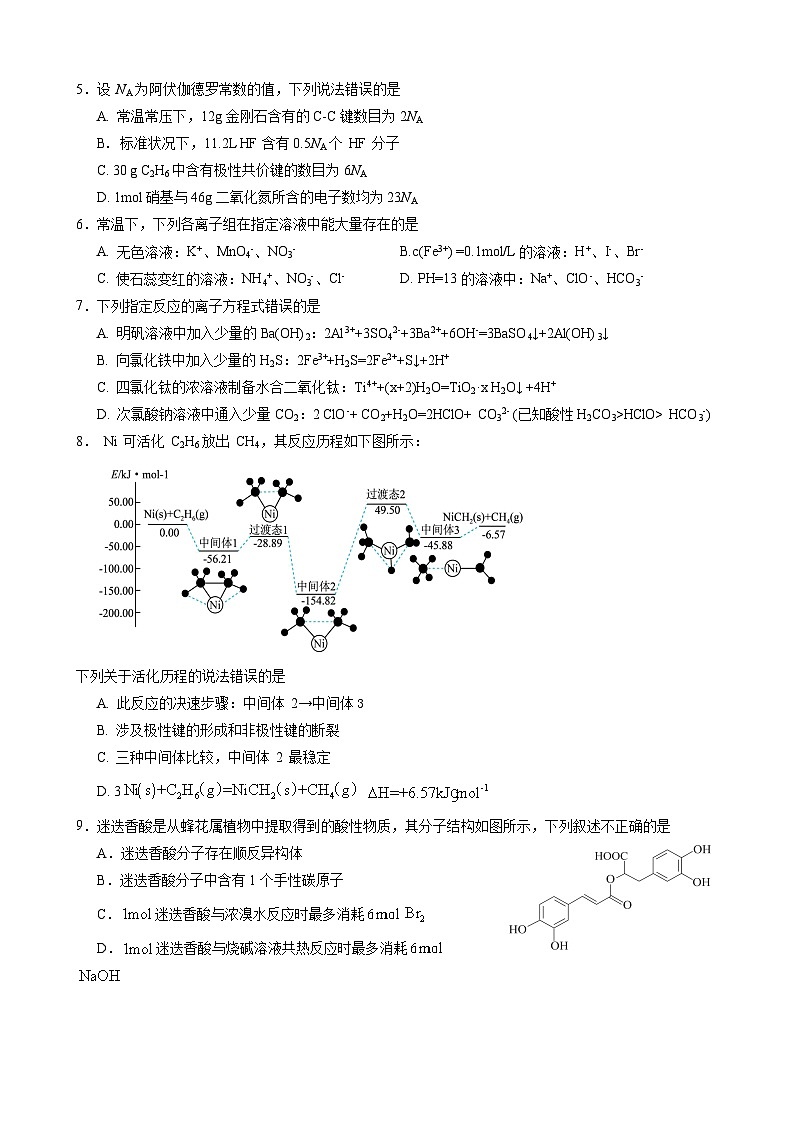
8. Ni 可活化 C2H6放出 CH4,其反应历程如下图所示:
下列关于活化历程的说法错误的是
A. 此反应的决速步骤:中间体 2→中间体3
B. 涉及极性键的形成和非极性键的断裂
C. 三种中间体比较,中间体 2 最稳定
D. 3
9.迷迭香酸是从蜂花属植物中提取得到的酸性物质,其分子结构如图所示,下列叙述不正确的是
A.迷迭香酸分子存在顺反异构体
B.迷迭香酸分子中含有1个手性碳原子
C.迷迭香酸与浓溴水反应时最多消耗
D.迷迭香酸与烧碱溶液共热反应时最多消耗
10.五羰基铁[]是一种具有三角双锥结构的黄色黏稠状液体,结构如图所示,已知其熔点为﹣20 ℃,沸点为103 ℃。下列推测不合理的是
A.五羰基铁晶体属于分子晶体
B.五羰基铁不溶于水,易溶于苯
C.五羰基铁隔绝空气受热分解生成Fe和CO
D.每个粒子中含σ键的个数为20
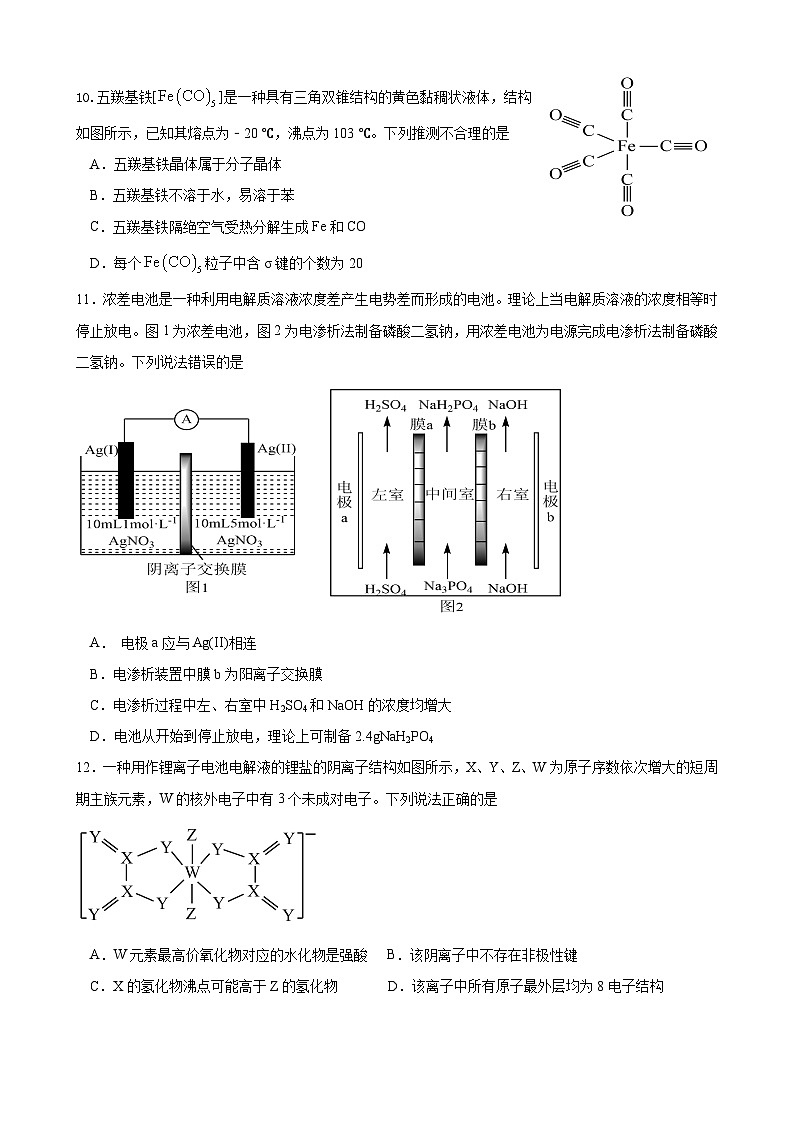
11.浓差电池是一种利用电解质溶液浓度差产生电势差而形成的电池。理论上当电解质溶液的浓度相等时停止放电。图1为浓差电池,图2为电渗析法制备磷酸二氢钠,用浓差电池为电源完成电渗析法制备磷酸二氢钠。下列说法错误的是
A. 电极a应与Ag(II)相连
B.电渗析装置中膜b为阳离子交换膜
C.电渗析过程中左、右室中H2SO4和NaOH的浓度均增大
D.电池从开始到停止放电,理论上可制备2.4gNaH2PO4
12.一种用作锂离子电池电解液的锂盐的阴离子结构如图所示,X、Y、Z、W为原子序数依次增大的短周期主族元素,W的核外电子中有3个未成对电子。下列说法正确的是
A.W元素最高价氧化物对应的水化物是强酸 B.该阴离子中不存在非极性键
C.X的氢化物沸点可能高于Z的氢化物 D.该离子中所有原子最外层均为8电子结构
13.利用下列实验装置完成对应的实验,能达到实验目的的是
选项 | A | B | C | D |
目的 | 验证苯与液溴发生取代反应 | 探究酒精脱水生成乙烯 | 证明酸性:碳酸>苯酚 | 制备乙酸乙酯并提高产率 |
实验方案 |
A. A B. B C.C D.D
14.下列有关物质结构的说法不正确的是
A. C-C 键比 Si-C 键键长短,故金刚石比金刚砂熔点更高、硬度更大
B. 氯化钠晶体与氯化铯晶体中,Cl-的配位数均为 6
C. 干冰晶体采用分子密堆积,每个 CO2周围紧邻 12 个 CO2
D. O3是极性分子,但由于极性微弱,它在 CCl4中的溶解度高于在水中的溶解度
15.常温下,向溶液中逐滴加入等浓度溶液,所得溶液中含A元素的微粒的物质的量分数与溶液的关系如图,下列说法正确的是
A.的水解离子方程式为A2-+H2OHA-+OH-,
B.室温下,Na2A水解常数Kh=10-11
C.溶液中存在
D.常温下,等物质的量浓度的NaHA与Na2A溶液等体积混合后溶液的PH=3.0
二、非选择题:本题共 4 小题,共 55 分。
16.(10分)苯甲酸是一种化工原料,常用作制药和染料的中间体,也用于制取增塑剂和香料等。实验室合成苯甲酸的原理及有关数据及装置示意图如下:
反应过程:
已知:
(1)苯甲酸 100 ℃左右开始升华。
(2)反应试剂、产物的物理常数如下:
名称 | 性状 | 熔点 | 沸点/C | 密度/g·mL-1 | 溶解度/g(室温) | |
水 | 乙醇 | |||||
甲苯 | 无色液体、易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 互溶 |
苯甲酸 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 |
按下列合成步骤回答问题:
步骤Ⅰ:按图在 250 mL 仪器 a 中放入 2.7 mL 甲苯和 100 mL 水,控制温度为 100℃,搅拌溶液,在石棉网上加热至沸腾。从冷凝管上口分批加入 8.5 g 高锰酸钾(加完后用少量水冲洗冷凝管内壁),继续搅拌约 4~5h,反应完全后,停止加热。
步骤 II:在反应结束后混合物中加入一定量亚硫酸氢钠溶液,产生黑色沉淀,趁热过滤、热水洗涤沉淀,合并滤液与洗涤液,再将其放在冰水浴中冷却,然后用浓盐酸酸化至苯甲酸全部析出;将析出的苯甲酸减压过滤,再用少量冷水洗涤苯甲酸固体,挤压除去水分,将制得的苯甲酸固体放在沸水浴上干燥,得到粗产品。
(1)仪器 a 的名称___________________ 。
(2)步骤Ⅰ中反应完全的现象为___________________ 。
(3)步骤 II 在反应混合物中加入一定量亚硫酸氢钠溶液,亚硫酸氢钠溶液的作用是___________________;还可以用______ (填选项)代替亚硫酸氢钠溶液。
A. H2O2 B.NaHCO3 C.Na2C2O4
(4)步骤 II 中干燥苯甲酸晶体时,若温度过高,可能出现的结果是___________________。
(5)若将苯甲酸粗产品进一步提纯,可用 ___________________方法。
17.(16分)钴产品的湿法生产中会生成大量的铜锰渣,主要含有CuO、MnO2,还含有少量的Co2O3、Fe2O3、Al2O3、CaO、MgO等。以铜锰渣为原料制备Cu2(OH)2CO3和MnCO3的工艺流程如下图所示:
已知:相关金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Cu2+ | Co2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ |
开始沉淀时pH | 8.1 | 5.2 | 7.1 | 7.5 | 2.2 | 3.7 | 8.9 |
完全沉淀时pH | 10.1 | 7.2 | 9.1 | 9.0 | 3.2 | 4.7 | 10.9 |
(1)“还原浸出”发生的最主要反应的离子方程式为___________
(2)“净化除杂I”需先加入双氧水,再加入氨水调高pH除掉铁、铝杂质,应调节溶液pH范围为___________。
(3)“沉铜”操作中,通过加入MnCO3调控溶液酸碱性实现Cu2+与其他金属离子的有效分离,该过程产生气体,写出“沉铜”的离子方程式___________
(4)“净化除杂II”除了能深度除钙,还能起到的作用是___________(用离子方程式表示)。
(5)“沉钴”操作中,加入的(NH4)2S溶液浓度不宜过大,理由是___________。
(6)“沉锰”后的母液中存在的主要溶质为___________(写化学式)。
(7)某种MnOx晶体的晶胞如下图所示,该晶体中Mn元素的化合价为__________。已知该晶胞底面是边长为的正方形,以晶胞参数为单位长度建立坐标系,A、B、C处的原子坐标参数分别为、、,则Mn与O形成化学键的键长为__________cm(用含a、m、n的代数式表示)。
18.(14分)为了实现“碳达峰”和“碳中和”的目标,将CO2转化成可利用的化学能源的“负碳”技术是世界各国关注的焦点。
方法I:CO2催化加氢制甲醇。
以CO2、H2为原料合成CH3OH涉及的反应如下:
反应i: CO2(g) + 3H2(g) ⇌ CH3OH(g) + H2O(g) △H1
反应ii: CO2(g) + H2(g) ⇌ CO(g) + H2O(g) △H2 = +41.0 kJ·mol-1
反应iii:CO(g) + 2H2(g) ⇌ CH3OH(g) △H3 = -90.0 kJ·mol-1
(1)计算反应i的△H1 = _______。
(2)一定温度和催化剂条件下,0.73mol H2、0.24mol CO2和0.03mol N2(已知N2不参与反应)在总压强为3.0MPa的密闭容器中进行上述反应,平衡时CO2的转化率、CH3OH和CO的选择性随温度的变化曲线如图所示。
①图中曲线b表示物质_______的变化(填“CO2”“CH3OH”或“CO”)。
②上述反应体系在一定条件下建立平衡后,下列说法不正确的有_______ (填字母)。
A.降低温度,反应i~iii的正、逆反应速率都减小
B.向容器中再通入少量N2,CO2的平衡转化率下降
C.移去部分H2O(g),反应iii平衡不移动
D.选择合适的催化剂能提高CO2的平衡转化率
E.平衡时CH3OH的体积分数一定小于50%
③某温度下,t1 min反应到达平衡,测得容器中CH3OH的体积分数为12.5%。此时用CH3OH的分压表示0-t1时间内的反应速率v(CH3OH)=_______ MPa·min-1。设此时n(CO) = a mol,计算该温度下反应ii的平衡常数Kx =_______ (用含有a的代数式表示)。 [已知:分压 = 总压 × 该组分物质的量分数;对于反应mA(g) + nB(g) ⇌ pC(g) + qD(g),,x为物质的量分数。]
方法II:CO2电解法制甲醇
利用电解原理,可将CO2转化为CH3OH,其装置如图所示:
(3)双极膜B侧为_______(填“阴离子”或“阳离子”)交换膜。
(4)TiO2电极上电极反应方程式:______________。
方法III:CO2催化加氢制低碳烯烃(2~4个C的烯烃)
某研究小组使用Zn-Ga-O/SAPO-34双功能催化剂实现了CO2直接合成低碳烯烃,并给出了其可能的反应历程(如图所示)。H2首先在Zn-Ga-O表面解离成2个H*,随后参与到CO2的还原过程;SAPO-34则催化生成的甲醇转化为低碳烯烃。
注:☐表示氧原子空位,*表示吸附在催化剂上的微粒。
(5)理论上,反应历程中消耗的H*与生成的甲醇的物质的量之比为_______。
19.(15分)化合物M是一种治疗抑郁症和焦虑症的药物,某研究小组以化合物I为原料合成化合物X的路线如下(部分反应条件省略):
已知:
n-BuLi:CH3CH2CH2CH2Li DMF:HCON(CH3)2
(1)化合物M中含氧官能团有___________(写名称)
(2)下列说法正确的是___________。
A. 化合物I在水中的溶解度比间苯二酚大 B. 可以用红外光谱鉴别化合物I和化合物Ⅳ
C. 化合物V中所有碳原子一定共平面 D. Ⅵ→Ⅶ的反应属于还原反应
(3)已知I→Ⅱ的反应是原子利用率100%的反应,且化合物a能使Br2的CCl4溶液褪色,则化合物a的结构简式为___________。
(4)Ⅲ→Ⅳ的化学方程式是___________。
(5)化合物Ⅷ有多种同分异构体,同时符合下列条件的有___________种,其中核磁共振氢谱有三组峰,且峰面积之比为9:2:2的结构简式为___________。
条件:a)含有一个苯环且苯环上有两个取代基,其中一个为硝基;b)不能使酸性高锰酸钾溶液褪色。
(6)根据上述信息,写出以苯酚为原料合成水杨酸(邻羟基苯甲酸)的路线__________。(可使用本题中出现的有机试剂,无机试剂任选)
重庆市梁平区2023-2024学年高三上学期第二次调研考试化学试题+Word版含答案: 这是一份重庆市梁平区2023-2024学年高三上学期第二次调研考试化学试题+Word版含答案,共32页。
重庆市梁平区2023-2024学年高三上学期第二次调研考试化学试题+Word版含答案: 这是一份重庆市梁平区2023-2024学年高三上学期第二次调研考试化学试题+Word版含答案,共32页。
广西壮族自治区桂林市等3地2023-2024学年高三上学期10月月考化学试题(Word版含答案): 这是一份广西壮族自治区桂林市等3地2023-2024学年高三上学期10月月考化学试题(Word版含答案),共15页。试卷主要包含了10,56,8 0等内容,欢迎下载使用。












