






化学第三节 化学反应的方向备课课件ppt
展开水总是自发地从高处流向低处
借助水泵,持续消耗电能
水从低处流向高处是不能自发进行
模块一 自发过程与自发反应
一、自发过程与自发反应
在温度和压强一定条件下,不借助光、电等外部力量就能自动进行的过程
体系趋向于从高能状态转变为低能状态
(这时体系会对外部做功或者释放热量)
在密闭条件下,体系有从有序自发地转变为无序的倾向
在给定的条件下,可以自发进行到显著程度的化学反应,就称为自发反应。
即在一定条件下反应的某个方向是自发进行的,其逆方向在相同条件下一定不能自发进行
但不一定能够实际发生,发生时速率也不一定大,非自发反应在一定条件下也可能发生。如煤的燃烧是自发反应,但在常温下不能自发进行。
模块二 反应进行方向的判断方法
二、反应进行方向的判断方法
Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s) △H= -216.8 kJ·ml-1
2H2(g) +O2(g) =2H2O(l) △H= -571.6 kJ·ml-1
放热反应过程中体系能量降低,因此具有自发反应的倾向
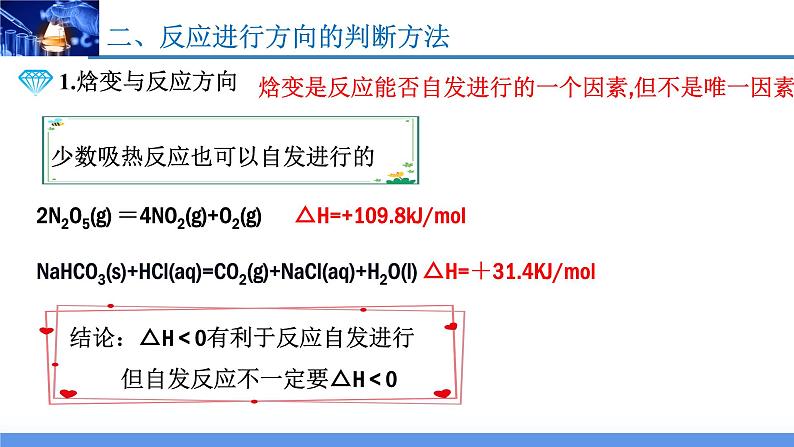
NaHCO3(s)+HCl(aq)=CO2(g)+NaCl(aq)+H2O(l) △H=+31.4KJ/ml
2N2O5(g) =4NO2(g)+O2(g) △H=+109.8kJ/ml
焓变是反应能否自发进行的一个因素,但不是唯一因素。
硝酸铵溶于水的过程可以自发进行
这些过程都是自发地从混乱度小(有序)向混乱度大(无序)的方向进行。
单位:J·ml-1·K-1
体系混乱度越大,熵值越大;体系混乱度越小,熵值越小。
描述体系混乱度的物理量
同种物质:S(g) > S(l) > S(s)。
△S=S(产物)-S(反应物)
体系趋向于从有序状态转变为无序状态,因此熵增反应(△S>0 )具有自发进行的倾向 。
Zn(s)+ H2SO4(aq)=ZnSO4(aq)+ H2(g)
2KClO3(s)=2KCl(s)+ 3O2(g)
2NO(g)+2CO(g)=N2(g)+2CO2(g)
4Fe(OH)2(s)+O2(g)+2H2O(l)=4Fe(OH)3(s)
熵变是反应能否自发进行一个因素,但不是唯一因素。
研究表明:在等温、等压条件下封闭体系中,自由能的变化综合反应了体系的焓变和熵变对自发过程的影响:
( G :自由能 T:绝对温度)
化学反应总是向着自由能减小的方向进行,直到体系达到平衡
△G 不仅与焓变和熵变有关,还与温度有关
∆H>0 ∆S>0高温下反应自发进行
∆H>0 ∆S<0所有温度下反应不能自发进行
∆H<0 ∆S>0所有温度下反应自发进行
∆H<0 ∆S<0低温下反应自发进行
化学反应进行方向的判据
能量降低的方向,就是反应容易进行的方向(H<0)
熵增的方向,就是反应容易进行的方向(S>0)
吉布斯自由能减小的方向,就是反应容易进行的方向(G<0)
1.在下列变化中,体系的熵将发生怎样的变化? A.少量的食盐溶解于水中 B.气态水变成液态水 C. 2Na2SO3(s)+O2(g)===2Na2SO4(s) D.CaCO3(s)受热分解为CaO(s)和CO2(g) E. HCl(g) + NH3(g) = NH4Cl (s)
2.下列反应中,熵显著增加的反应是( ) A.CO(g)+2H2(g)===CH3OH(g) B.3NO2(g)+H2O(l)===2HNO3(aq)+NO(g) C.2C(s)+O2(g) === 2CO (g) D.2Hg(l)+O2(g)===2HgO(s)
3.以下自发过程可用焓判据来解释的是( )A.硝酸铵自发地溶于水B.两种理想气体自发混合时热效应为0C.(NH4)2CO3(s)===NH4HCO3(s)+NH3(g) ΔH=+74.9 kJ·ml-1D.2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·ml-1
高中化学第二节 化学反应的速率与限度备课ppt课件: 这是一份高中化学第二节 化学反应的速率与限度备课ppt课件,共36页。PPT课件主要包含了化学反应速率,反应物浓度的减少量,生成物浓度的增加量,均取正值,模块三活化能,HI→H2+2I·,I·→I2,自由基,基元反应,又称反应机理等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第二节 化学平衡备课ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第二节 化学平衡备课ppt课件,共23页。PPT课件主要包含了模块一速率图像,m+np+q,模块二平衡图像,正反应吸热,两个变量影响平衡等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第二节 化学平衡备课课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第二节 化学平衡备课课件ppt,共28页。PPT课件主要包含了V正≠V逆,V正V逆≠0,条件改变,建立新平衡,破坏旧平衡,一定时间,化学平衡移动,实验2-1,硫氰化铁,正反应等内容,欢迎下载使用。













