





高中化学苏教版 (2019)选择性必修1第二单元 化学反应的方向与限度精品ppt课件
展开1.知道化学反应是有方向的。2.知道化学反应的方向与反应的焓变和熵变有关。
自发反应指的是在一定温度、压强下,不需借助外力就能自动进行的反应。
①具有方向性,即许多反应的某个方向在一定条件下是自发的,则其逆反应在该条件下肯定不自发。②体系趋向于从高能量状态转变为低能量状态。③体系趋向于从有序体系转变为无序体系。
知识点一 · 自发反应
1.下列不属于自发进行的变化是( )A.红墨水加到清水中使整杯水变红B.冰在室温下融化成水C.水电解生成氢气和氧气D.铁器在潮湿的空气中生锈
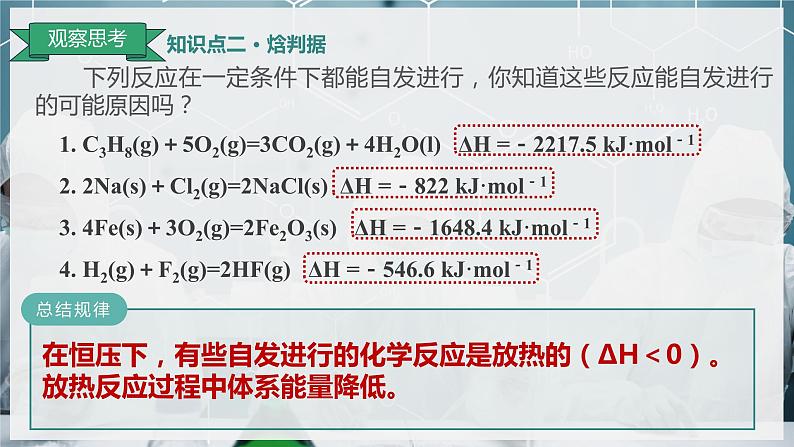
下列反应在一定条件下都能自发进行,你知道这些反应能自发进行的可能原因吗?
1. C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH =-2217.5 kJ·ml-12. 2Na(s)+Cl2(g)=2NaCl(s) ΔH =-822 kJ·ml-13. 4Fe(s)+3O2(g)=2Fe2O3(s) ΔH =-1648.4 kJ·ml-14. H2(g)+F2(g)=2HF(g) ΔH =-546.6 kJ·ml-1
在恒压下,有些自发进行的化学反应是放热的(ΔH<0)。放热反应过程中体系能量降低。
考察化学反应能否自发进行,不能直接用放热(ΔH<0)或吸热(ΔH>0)作为判断依据。
焓变是判断反应能否自发进行的一个因素,但不是唯一因素。
分析下列过程能自发进行的可能原因:
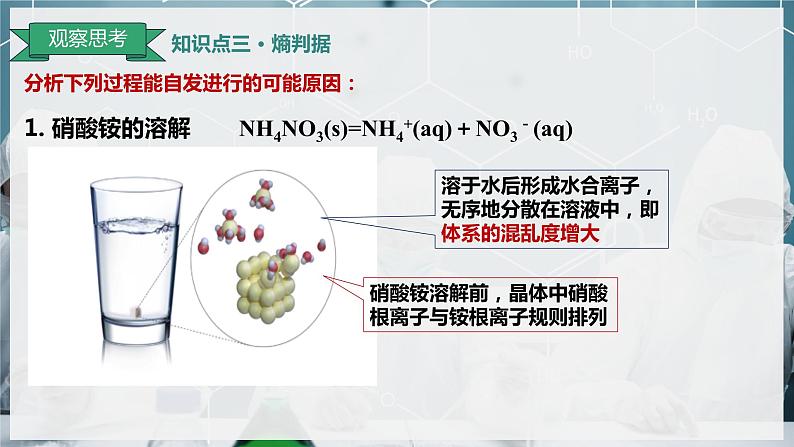
1. 硝酸铵的溶解 NH4NO3(s)=NH4+(aq)+NO3-(aq)
溶于水后形成水合离子,无序地分散在溶液中,即体系的混乱度增大
硝酸铵溶解前,晶体中硝酸根离子与铵根离子规则排列
2. 碳酸钙的分解 CaCO3(s)=CaO(s)+CO2(g)3. 氯化铵晶体与氢氧化钡晶体的反应2NH4Cl(s)+Ba(OH)2·8H2O(s)=2NH3(g)+BaCl2(s)+10H2O(l)
碳酸钙分解成二氧化碳气体,氯化铵晶体与氢氧化钡晶体反应生成氨气,气体的产生会导致体系的混乱度增大。
①对于同一物质:S(g)>S(l)>S(s)
衡量一个体系混乱度的物理量,符号:S。
反应前后体系熵的变化,符号:ΔS。如果发生变化后体系的混乱度增大,那么该过程的ΔS>0;反之,ΔS<0。
②常见的增熵过程:固态→液态→气态
2.试判断下列反应的熵变大小
①2CO+O2=2CO
②N2+3H2⇄2NH3
正反应,ΔS<0逆反应,ΔS>0
ΔS<0体系的混乱度减小,不利于反应自发进行,但有些ΔS<0的化学反应也能自发进行。
熵变是判断反应能否自发进行的一个因素,但不是唯一因素。
氢气在氧气中点燃生成水、氨气与氯化氢反应生成氯化铵固体等
1.焓变是判断反应能否自发进行的一个因素,ΔH<0体系的能量减小,有利于反应自发进行,但不是唯一因素。
2.熵变是判断反应能否自发进行的一个因素,ΔS>0体系的混乱度增大,有利于反应自发进行,但不是唯一因素。
3.体系能量减小和混乱度增加都能促使反应自发进行,焓变和熵变共同制约着化学反应进行的方向。
知识点四 · 复合判据ΔG
1876年,吉布斯提出自由能变化ΔG,并认为化学反应总是向着自由能减小(ΔG<0)的方向进行,直至达到平衡。
在等温、等压条件的封闭体系中,
T为热力学温度,为正值
当T低于某一温度时,ΔG<0
当T高于某一温度时,ΔG<0
所有温度下都能自发进行
所有温度下都不能自发进行
焓负熵正定自发;正正时高温自发。负负时低温自发;焓正熵负不自发。
《课本》P57表2-5
1.预习《2.2.2 化学平衡状态》
化学选择性必修1第二单元 化学反应的方向与限度试讲课课件ppt: 这是一份化学选择性必修1第二单元 化学反应的方向与限度试讲课课件ppt,共25页。PPT课件主要包含了直接标志,间接标志,化学平衡常数,生成物浓度幂之积,反应物浓度幂之积,同底数幂相乘,Ka·Kb,Ka+b,幂的乘方,Kab等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修1第二单元 化学反应的方向与限度试讲课课件ppt: 这是一份高中化学苏教版 (2019)选择性必修1第二单元 化学反应的方向与限度试讲课课件ppt,共29页。PPT课件主要包含了总结归纳,习题研究,作业布置等内容,欢迎下载使用。
高中化学鲁科版 (2019)选择性必修1第1节 化学反应的方向教课内容课件ppt: 这是一份高中化学鲁科版 (2019)选择性必修1第1节 化学反应的方向教课内容课件ppt,共28页。PPT课件主要包含了目录索引,必备知识,自我检测等内容,欢迎下载使用。













