


高中化学苏教版 (2019)必修 第一册第一单元 含硫化合物的性质优秀练习
展开4.1 含硫化合物的性质 同步练习 2022-2023学年高一化学苏教版(2020)必修第一册
一、单选题
1.常温下,不能用铝制容器盛放的是
A.浓硫酸 B.稀硫酸 C.浓硝酸 D.Fe2O3
2.常温下,下列溶液可用铁制容器盛装的是( )
A.稀盐酸 B.稀硫酸 C.浓硫酸 D.稀硝酸
3.将SO2和H2S混合,有浅黄色固体出现,该反应中H2S表现出
A.还原性 B.碱性 C.酸性 D.氧化性
4.下列物质的性质和用途的对应关系正确的是
选项 | 性质 | 用途 |
A | 氢氟酸具有酸性 | 氢氟酸可用于雕刻玻璃 |
B | SO2有漂白性 | SO2可用于漂白纸浆 |
C | NH3极易溶于水 | NH3可用作制冷剂 |
D | NaHCO3能与碱反应 | 小苏打可做焙制糕点的膨松剂 |
A.A B.B C.C D.D
5.对下列实验现象或操作解释正确的是
| 现象或操作 | 解释 |
A | KI淀粉溶液中滴入氯水变蓝,再通入SO2,蓝色褪去 | SO2具有漂白性 |
B | 配制FeCl3溶液时,先将FeCl3溶于适量浓盐酸,再用 蒸馏水稀释,最后在试剂瓶中加入少量的铁粉 | 抑制Fe3+水解,并防止Fe3+变质 |
C | 某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 不能说明该溶液中一定含有SO42– |
D | 向含有Cu(NO3)2和AgNO3的溶液中滴加Na2S溶液,生成黑色沉淀 | Ksp(Ag2S)<Ksp(CuS) |
A.A B.B C.C D.D
6.下列实验中,依据实验操作及现象,得出的结论正确的是
| 操 作 | 现 象 | 结 论 |
A | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
B | 将稀硝酸加入过量铁粉中,充分反应后再滴加KSCN溶液 | 有气体生成,溶液不呈血红色 | 稀硝酸将Fe氧化为Fe2+ |
C | 向蔗糖中加入浓硫酸 | 蔗糖变成疏松多孔的海绵状炭 | 浓硫酸具有吸水性 |
D | 向5 mL KI溶液中加入1 mL相同浓度FeCl3溶液,充分反应后滴入KSCN溶液 | 溶液变血红色 | KI与FeCl3的反应有一定限度 |
A.A B.B C.C D.D
7.市场上销售的劣质干鱼片,看上去洁白如雪,但放置几个月后便会变黄,恢复鱼片原有的颜色,由此猜想漂白干鱼片的气体可能是

A.SO2 B.![]() C.
C.![]() D.
D.![]()
8.化学与生活密切相关。下列说法错误的是
A.施肥时,草木灰可以与![]() 混合使用 B.
混合使用 B.![]() 可用于生产光导纤维
可用于生产光导纤维
C.高纯硅可用于制作光感电池 D.硫酸钡可用于胃肠X射线造影检查
9.浓H2SO4在下列反应中,既表现氧化性,又表现酸性的是( )
A.Cu+2H2SO4(浓)→CuSO4 + SO2↑+ 2H2O
B.C +2H2SO4(浓)→CO2 + 2SO2↑+2H2O
C.2NaOH +H2SO4(浓)→Na2SO4 + 2H2O
D.Fe2O3 +3H2SO4(浓)→Fe2(SO4)3+3H2O
10.下列说法不正确的是
A.玻璃、水泥、陶瓷是三大传统的无机非金属材料
B.![]() 可漂白纸浆,不可用于杀菌、消毒
可漂白纸浆,不可用于杀菌、消毒
C.中学实验室中可以将未用完的钠、钾、白磷放回原试剂瓶
D.工业上用焦炭还原石英砂制取粗硅原理:![]()
11.实验室制备下列气体时,只能用排水法收集的是( )
A.H2 B.SO2 C.NO2 D.NO
12.下列所加物质的作用与其还原性无关的是
A.果蔬饮料中加入维 C B.红酒中添加 SO2
C.月饼脱氧剂包中有铁粉 D.生活用水消毒加入次氯酸钙
13.SO2既是大气主要污染物之一,又在生产生活中具有广泛应用,如可生产SO3并进而制得硫酸等,其反应原理为:2SO2(g)+O2(g)=2SO3(g) ΔH=-196.6 kJ·mol-1。实验室可用铜和浓硫酸制取SO2。实验室制取SO2时,下列装置能达到实验目的的是
A.生成SO2 B.干燥SO2
B.干燥SO2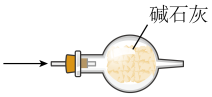
C.收集SO2 D.吸收SO2
D.吸收SO2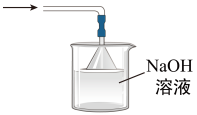
14.蔗糖遇浓硫酸生成黑色物质,体积膨胀为疏松多孔状,体现浓硫酸的性质有
A.脱水性 B.强氧化性
C.吸水性 D.脱水性、强氧化性
二、填空题
15.SO2从组成和性质看属于酸性氧化物,从化合价来看具有氧化性和还原性,请完成并配平下列化学反应方程式
(1)SO2+H2O _______
(2)SO2+CaO _______
(3)SO2+Ca(OH)2 _______
(4)SO2+H2S _______
(5)SO2+H2O2 _______
(6)Cl2+SO2+H2O _______
(7)SO2 +H2O+KMnO4 _______
从离子角度看,反应(7)中的氧化产物是_______,还原产物是________(均填写离子符号)。
16.SO2是常见的大气污染物,燃煤是产生SO2的主要原因。工业上有多种方法可以减少SO2的排放。
(1)往煤中添加一些生石灰,可使燃煤过程中产生的SO2转化成硫酸钙。该反应的化学方程式为____。
(2)可用多种溶液做燃煤烟气中SO2的吸收液。
①分别用等物质的量浓度的Na2SO3溶液和NaOH溶液做吸收液,当生成等物质的量NaHSO3时,两种吸收液体积比V(Na2SO3)∶V(NaOH)=____。
②NaOH溶液吸收了足量的SO2后会失效,可将这种失效的溶液与一定量的石灰水溶液充分反应后过滤,使NaOH溶液再生,再生过程的离子方程式为____。
(3)甲同学认为BaCl2溶液可以做SO2的吸收液。为此甲同学设计如图实验(夹持装置和加热装置略,气密性已检验):

已知:Na2SO3(固体)+H2SO4(浓)=Na2SO4+SO2↑+H2O反应开始后,A中Na2SO3固体表面有气泡产生同时有白雾生成;B中有白色沉淀。甲认为B中白色沉淀是SO2与BaCl2溶液反应生成的BaSO3,所以BaCl2溶液可做SO2吸收液。
乙同学认为B中的白色沉淀是BaSO4,产生BaSO4的原因是
①A中产生的白雾是浓硫酸的酸雾,进入B中与BaCl2溶液反应生成BaSO4沉淀。
②____。
为证明SO2与BaCl2溶液不能得到BaSO3沉淀,乙同学对甲同学的实验装置做了如图改动并实验(夹持装置和加热装置略,气密性已检验):
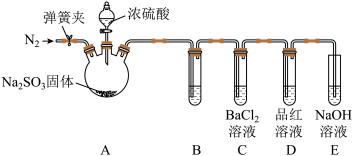
反应开始后,A中Na2SO3固体表面有气泡产生同时有白雾生成;B、C试管中除了有气泡外,未见其他现象;D中红色褪去。
③试管B中试剂是溶液____;滴加浓硫酸之前的操作是____。
④通过甲乙两位同学的实验,得出的结论是____。
三、计算题
17.将1.95g由Na2SO4和Na2CO3组成的混合物溶于水得溶液A,在A中加入10mL未知的BaCl2溶液恰好完全反应,过滤得沉淀B,向B中加入足量稀盐酸,充分反应后剩余沉淀2.33g。计算:
(1)原混合物中Na2SO4的物质的量___。
(2)碳酸钠的质量分数___。
18.已知NO不溶于水,NO2易溶于水,且与水发生反应3NO2+H2O=2HNO3+NO。把盛有48 mL NO和NO2混合气体的容器倒置于水中(保持同温同压),待液面稳定后,容器内气体的体积变为24 mL,则:
(1)原混合气中,NO是_______ mL,NO2是_______ mL。
(2)若在剩余的24 mL气体中,通入6 mL O2,待液面稳定后,反应后容器内剩余气体体积为_______ mL。
(3)若在剩余的24 mL气体中,通入24 mL O2,待液面稳定后,反应后容器内剩余气体体积为_______ mL。
(4)若在原48 mL NO、NO2中,通入_______ mL O2再倒置于水中,气体会全部被吸收。
四、实验题
19.I.为观察铜和浓硫酸的反应现象并探究SO2与Fe3+之间的氧化还原反应,某化学兴趣小组按下图装置进行实验(夹持、加热仪器已略去)。同学们查阅资料后了解,浓硫酸(常规质量分数为98.3%,密度为1.84 g/cm3)的沸点为338℃,加热过程中可能产生酸雾。请回答下列问题:

(1)搭建好实验装置后,紧接着要进行的一步操作是_____;试剂a是______;
(2)写出装置A中反应的化学方程式______;
(3)对于上述实验描述正确的是_____(填序号);
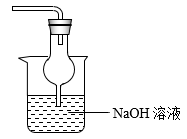
A.在加热条件下充分反应,A装置烧瓶中溶液呈蓝色
B.C中溶液酸性增强,说明SO2与Fe3+之间发生了氧化还原反应
C.向C中加入几滴KMnO4溶液,紫红色褪去,说明C溶液中生成了Fe2+
D.尾气处理可以选择如上图装置
(4)SO2气体通入C装置充分反应,请设计实验证明氧化产物中阴离子的存在_____。
II.我国国家标准规定葡萄酒中的最大使用量为0.25 g/L。该小组测定某干白葡萄酒中的的含量(以游离计),将200 mL葡萄酒和足量盐酸共热,使全部逸出并与H2O2完全反应,除去过量的H2O2后,与0.0600 mol/LNaOH标准溶液反应,恰好消耗NaOH溶液20.00 mL,请回答:
(5)该葡萄酒中SO2的含量为_____![]() ,该测定结果比实际值偏高,原因是______。
,该测定结果比实际值偏高,原因是______。
参考答案:
1.B
2.C
3.A
4.B
5.C
6.D
7.A
8.A
9.A
10.B
11.D
12.D
13.D
14.D
15. SO2 + H2O =H2SO3 SO2 + CaO =CaSO3 SO2 + Ca(OH)2=CaSO3↓ + H2O SO2 +2 H2S= 3S↓ +2 H2O SO2 + H2O2=H2SO4 Cl2 + SO2 + 2H2O=2HCl+H2SO4 5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4 SO![]() Mn2+
Mn2+
16.(1)2CaO+2SO2+O2![]() 2CaSO4
2CaSO4
(2) 1∶2 Ca2++OH-+HSO![]() =CaSO3↓+H2O
=CaSO3↓+H2O
(3) A中产生的SO2与装置内空气中的O2进入B中与BaCl2溶液反应生成BaSO4沉淀 饱和NaHSO3 打开弹簧夹,通入N2,一段时间后关闭弹簧夹 不能用BaCl2溶液做吸收SO2的吸收液(或SO2与BaCl2溶液不能得到BaSO3沉淀)
17. 0.01mol 27.2%
18. 12 36 16 6 18
19.(1) 检查装置气密性 饱和NaHSO3溶液
(2)![]()
(3)D
(4)取少量C中溶液于试管中,加入足量稀盐酸后,再滴加几滴BaCl2溶液,若生成白色沉淀,则证明有![]() 生成
生成
(5) 0.192 挥发的HCl也会消耗NaOH
苏教版 (2019)必修 第一册第一单元 含硫化合物的性质课堂检测: 这是一份苏教版 (2019)必修 第一册第一单元 含硫化合物的性质课堂检测,共13页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
化学第一单元 含硫化合物的性质课后复习题: 这是一份化学第一单元 含硫化合物的性质课后复习题,共13页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
苏教版 (2019)必修 第一册第一单元 含硫化合物的性质复习练习题: 这是一份苏教版 (2019)必修 第一册第一单元 含硫化合物的性质复习练习题,共15页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。













