


苏教版2019 高中化学 必修一 3.3 海洋化学资源的综合利用 同步练习(含解析)
展开3.3 海洋化学资源的综合利用 同步练习 2022-2023学年高一 化学苏教版(2019)必修第一册
一、单选题
1.下列说法正确的是
A.1molN2中含有的分子数为2×6.02×1023 B.电解饱和食盐水可得到金属钠
C.常温下,铝片能溶于浓硝酸 D.常温下,淀粉溶液遇I2变成蓝色
2.下列有关海水提镁的说法不正确的是( )
A.贝壳在海水提镁的工业流程中主要经历了![]() 的过程
的过程
B.利用![]() 将
将![]() 转化为
转化为![]() 沉淀,然后电解
沉淀,然后电解![]() 制备纯镁
制备纯镁
C.工业生产中是利用电解熔融的![]() 制备镁
制备镁
D.在海水提镁的工业流程中,氯气可以循环利用,用于制备盐酸,再溶解![]()
3.化学与生活息息相关。下列说法正确的是
A.可用淀粉试纸检验真假碘盐
B.自来水可用氯气来杀菌消毒,说明氯气无毒
C.含次氯酸钠的溶液是生活中常用的消毒剂
D.漂白粉可以和洁厕灵(含盐酸)混合使用
4.下列开发利用自然资源制取化学品,其途径较合理的是
A.海水![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
B.石油![]() 苯、甲苯、二甲苯、酚等
苯、甲苯、二甲苯、酚等
C.铝土矿![]() Al(OH)3
Al(OH)3![]() Al2O3
Al2O3![]() Al
Al
D.海洋生物![]() I2
I2
5.在给定的条件下,下列选项所示的物质间转化均能实现的是
A.![]() B.
B.![]()
C.![]() D.
D.![]()
6.镁、铝单质的化学性质以相似性为主,但也存在某些较大差异性,下列物质能用于证明二者存在较大差异性的是
①CO2 ②盐酸 ③NaOH溶液 ④水
A.①④ B.②③ C.①③ D.②③④
7.下列物质中,能用于萃取溴水中的溴的是( )
A.直馏汽油
B.裂化汽油
C.酒精
D.氢氧化钠
8.下列叙述中,正确的是
A.铝比铁活泼,但铝制品比铁制品更耐腐蚀
B.碱金属都保存在煤油中
C.碘保存在细口玻璃瓶中
D.液氯能使干燥的红布条褪色
9.“空气吹出法”海水提溴的工艺流程如下:

下列说法不正确的是
A.进入吹出塔前,Br-被氧化为Br2
B.两次通入水蒸气的作用都是参加反应
C.经过吸收塔后,溴元素得到富集
D.从吸收塔流出的溶液主要含HBr和H2SO4
10.下列关于金属及非金属的制备,正确的是
A.冶炼铝:铝土矿![]() NaAlO2
NaAlO2![]() 无水AlCl3
无水AlCl3![]() Al
Al
B.制钠:以海水为原料制得精盐,再电解精盐的水溶液制取钠
C.制碘:海带![]() 海带
海带![]() I2(aq)
I2(aq)![]() I2
I2
D.制铁:以铁矿石为原料,CO还原得铁
11.加碘盐中碘元素可来自于海带,下列说法正确的是( )
A.加碘盐中的碘以KI的形式存在
B.在实验室里,可将干海带置于蒸发皿中灼烧,再加水溶解并过滤以分离出I-
C.可用双氧水将I-氧化为单质碘
D.可用酒精萃取碘单质以制备“碘酒”
12.生产、生活离不开化学。下列说法中不正确的是
A.不需要通过化学反应就能从海水中获得淡水
B.开发和推广新能源汽车是实现低碳生活的途径之一
C.寻找高效催化剂,利用太阳能分解水是制取氢气的较理想方法
D.高纯硅是工业上制造光导纤维的主要原料
13.化学与生活、社会密切相关。 下列说法正确的是
A.明矾净水时包含化学变化和物理变化,起杀菌、消毒作用
B.由 △H-T△S 及相关数据分析,加装汽车尾气净化器能将 NO、CO 转化为 N2、CO2
C.在厨房里用米汤可直接检验食盐中是否含有碘
D.热的纯碱溶液可用于洗涤食用油、柴油等油污
14.海水中水资源和化学资源的利用有非常广阔的前景。下列生产中,属于水资源利用的是( )
A.海水淡化 B.海水提盐 C.海水提溴 D.海水提镁
二、填空题
15.海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
已知:①海水中溴元素(以Br-表示)的浓度0.068g/L;
②Br2的沸点为59 ℃,微溶于水,有毒性和强腐蚀性。

(1)请写出一种海水淡化的方法:_____________。
(2)海水中溴离子的物质的量浓度为__________________。
(3)步骤Ⅰ中已获得低溶度的含Br2溶液,步骤Ⅱ中又将Br2还原为Br-,步骤Ⅲ又得到Br2,其目的为________________。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为_________________________________________________。
(5)工业溴提纯可用蒸馏法,蒸馏时加热方法最好采用_______________,蒸馏装置中仪器连接均不能用橡胶塞和橡胶管,其原因是_________________________________。
16.为除去粗盐中的Ca2+、Mg2+、SO![]() 及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
称取粗盐![]()
![]()
![]()
![]()
![]() 滤液
滤液![]()
![]() 精盐
精盐
(1)第①步中,操作A是__________,第⑤步中,操作B是__________。
(2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为氯化钙)__________、_________。
(3)若先用盐酸调溶液至中性,再过滤,将对实验结果产生影响,其原因是______。
(4)判断氯化钡已过量的方法是_________。
三、计算题
17.将0.1 mol的镁、铝混合物溶于100 mL 2mol/LH2SO4溶液中,然后再滴加1 mol/L NaOH溶液。请回答:

⑴若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如下图所示。当V1=160mL时,则金属粉末中n(Mg)=______________mol,V2=______________mL。
⑵若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)_________mL。
⑶若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL 2 mol/L的硫酸溶解此混合物后,再加入450 mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是:______________。
18.甲、乙、丙各取300mL同浓度的盐酸,加入不同质量的同一镁铝合金粉末进行下列实验,有关数据列表如下:
实验序号 | 甲 | 乙 | 丙 |
合金质量/mg | 510 | 765 | 918 |
(标准状况)气体体积/mL | 560 | 672 | 672 |
求:(1)盐酸的物质的量浓度是多少___?
(2)合金中镁铝的质量分数各是多少___、___?
四、实验题
19.体操运动员在完成单杠、吊环项目时常用“镁粉”搓手,以起到防滑效果。某种“镁粉”中可能含有Mg、MgO、Mg(OH)2、MgCO3中的一种或两种固体,实验小组对其成分展开了探究。
已知:MgO+2HCl=MgCl2+H2O、MgCO3+2HCl=MgCl2+H2O+CO2↑。
(1)探究“镁粉”中是否含有Mg和MgCO3
①取少量样品,如图所示进行实验。观察到a试管中有气泡产生,b试管中产生的现象是澄清石灰水变浑浊,则证明“镁粉”中一定含有______。

②为证明“镁粉”中是否含有Mg,小明将燃着的木条放在图中b试管口上方,木条熄灭。但同学们指出,该实验不能达成实验目的,需要将图中的澄清石灰水替换成浓NaOH溶液,目的是______________。小明按照修改后的实验方案重复上述实验,观察到b试管中无明显现象,证明“镁粉”中______________。
(2)探究“镁粉”中是否还含有MgO及Mg(OH)2
【实验过程】
Ⅰ.用MgO、Mg(OH)2和MgCO3三种固体分别做性质实验。分别取0.5g三种固体粉末,每次取样方法如图2所示:
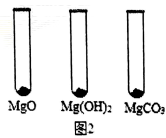
逐滴加入相同溶质质量分数的稀盐酸直至粉末恰好消失。在下表中记录消耗的同浓度稀盐酸的体积(以下体积均在同一条件下测定,且保留到小数点后1位)
| MgO | Mg(OH)2 | MgCO3 |
消耗稀盐酸的体积/mL | 10.4 | 7.2 | 5.0 |
Mg(OH)2与盐酸发生中和反应的化学方程式为_____________。
Ⅱ.取“镁粉”样品0.5g,加入上述稀盐酸至粉末恰好溶解。此时消耗稀盐酸的体积约为5.3mL。
【实验分析及结论】
“镁粉”不只含有MgCO3。理由是____________________________________。
【实验反思】
为确定“镁粉”的具体成分,同学们认为还需要补充如下实验:分别取0.5g“镁粉”和0.5g_________,加入足量稀盐酸,测定生成的气体体积分别为119mL和140mL。由此可知“镁粉”中含有MgCO3的质量分数为___________。
参考答案:
1.D
2.B
3.C
4.D
5.C
6.C
7.A
8.A
9.B
10.D
11.C
12.D
13.B
14.A
15. 蒸馏法(或电渗析法、离子交换法) 0.00085mol/L 富集溴元素 Br2+SO2+2H2O=4H++SO42-+2Br- 水浴加热 Br2腐蚀橡胶
16. 溶解 过滤 CaCl2+Na2CO3=CaCO3↓+2NaCl BaCl2+Na2CO3=2NaCl+BaCO3↓ ③和④中生成的沉淀与盐酸反应而溶解,杂质无法除去 在反应后上层清液中,再滴入几滴氯化钡溶液,若无沉淀生成,表明氯化钡已过量
17. 0.06 mol 440 mL 400 mL ![]() ≤a<1
≤a<1
18. 0.20mol·L-1 47.1% 52.9%
19. MgCO3 把二氧化碳全部吸收 没有Mg Mg(OH)2+2HCl=MgCl2+2H2O 0.5g“镁粉”消耗稀盐酸的体积与0.5gMgCO3消耗稀盐酸的体积不相等 MgCO3 85%
高中化学苏教版 (2019)必修 第一册第三单元 海洋化学资源的综合应用练习题: 这是一份高中化学苏教版 (2019)必修 第一册第三单元 海洋化学资源的综合应用练习题,共25页。试卷主要包含了单选题,填空题,实验探究题等内容,欢迎下载使用。
高中化学苏教版 (2019)必修 第一册第三单元 海洋化学资源的综合应用一课一练: 这是一份高中化学苏教版 (2019)必修 第一册第三单元 海洋化学资源的综合应用一课一练,共15页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
高中化学苏教版 (2019)必修 第一册专题3 从海水中获得的化学物质第三单元 海洋化学资源的综合应用同步训练题: 这是一份高中化学苏教版 (2019)必修 第一册专题3 从海水中获得的化学物质第三单元 海洋化学资源的综合应用同步训练题,共12页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。













