



- 苏教版(2019)高中化学必修一教案:专题5 微观结构与物质的多样性 元素周期表 ( Word版含解析,2课时打包) 教案 1 次下载
- 苏教版(2019)高中化学必修一教案:专题5 微观结构与物质的多样性 同素异形现象 ( Word版含解析,2课时打包) 教案 1 次下载
- 苏教版(2019)高中化学必修一教案:专题5 微观结构与物质的多样性 晶体 非晶体 ( Word版含解析,2课时打包) 教案 1 次下载
- 苏教版(2019)高中化学必修一教案:专题5 微观结构与物质的多样性 共价键 ( Word版含解析,2课时打包) 教案 1 次下载
- 苏教版(2019)高中化学必修一教案:第一单元 物质的分类( 2课时打包) 教案 2 次下载
苏教版(2019)高中化学必修一教案:专题5 微观结构与物质的多样性 离子键 ( Word版含解析,2课时打包)
展开![]() 5.2.1离子键
5.2.1离子键
![]()
本课时帮助学生初步认识原子是怎样构成物质的,了解物质中微粒之间存在的作用,认识离子键、共价键、分子间作用力。教材从学生熟悉的物质氯化钠入手,帮助学生认识活泼金属元素和活泼非金属元|素原子![]() 间能形成典型的离子键,了解元素原子是怎样彼此结合的。学习应用电子式来说明离子键的形成,表示离子化合物。引用了多种化学用语和结构模型。要求学习电子式、结构式的含义与书写,认识分子的球棍模型、比例模型三维空间结构模型。这些化学用语和模型能帮学生直观地理解离子键的形成与物质的微观结构。不仅是技能的华习,更重要的是让学生在运用中加深对化学键理论的理解。运用结构模型,能形象地展示物质中微粒的排列、空间相对位置和微粒之间的相互作用,可以提高学生的空间想像力。
间能形成典型的离子键,了解元素原子是怎样彼此结合的。学习应用电子式来说明离子键的形成,表示离子化合物。引用了多种化学用语和结构模型。要求学习电子式、结构式的含义与书写,认识分子的球棍模型、比例模型三维空间结构模型。这些化学用语和模型能帮学生直观地理解离子键的形成与物质的微观结构。不仅是技能的华习,更重要的是让学生在运用中加深对化学键理论的理解。运用结构模型,能形象地展示物质中微粒的排列、空间相对位置和微粒之间的相互作用,可以提高学生的空间想像力。
![]()
1、宏观辨识与微观探析:能运用电子式说明物质的组成及其变化。
2、变化观念与平衡思想:能从物质的微观结构说明同类物质的共性表和不同类物质性质的差异及其原因。
3、证据推理与模型认知:会分析离子键的形成,建立判断离子键和离子化合物的思维模型。
4、科学探究与创新意识:培养学生的归纳比较能力,学会由个别到一般的研究问题的方法。通过分子构型的教学培养学生的空间想象能力,学会从宏观到微观、从现象到本质的认识事物的科学方法。
5、科学精神与社会责任:培养学生科学严谨的学习态度和探究能力,学生会从微观角度分析物质的性质与结构的关系。
![]()
1.通过氯化钠的形成过程,理解离子键的形成过程与形成条件
2.知道离子键、离子化合物的概念
3.能用电子式表示离子化合物的形成过程
![]()
教学视频、课件、相关图片
![]()
思考引入:PPT展示图片
1、构成物质的微粒有哪些?
2、构成物质的微粒间是怎样结合在一起形成物质的?
3、微粒间的作用力有什么特点?为什么物质在外在形态和功能上不同呢?
板书:一、离子键和离子化合物
提问:氯化钠的组成微粒是什么?微粒是怎样形成氯化钠的,微粒间作用力有什么特点?
讲解:钠是活泼的金属元素,最外层只有一个电子,在反应中失去最外层电子,形成钠离子;氯是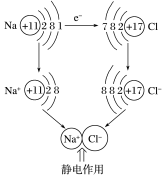
活泼的非金属元素,最外层有7个电子,在反应中得到1个电子,形成氯离子;钠离子与氯离子之间通过静电作用结合在一起,形成稳定的氯化钠。
板书:化学键:物质中直接相邻的原子或离子之存在的强烈的相互作用
PPT展示:氯化钠形成过程图片和视频
思考:什么是离子键?构成微粒有哪些?离子键的实质是什么?
板书:(一)离子键
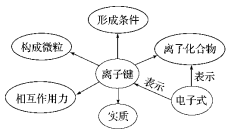
1、化学键:
1、定义:阴、阳离子间强烈的相互作用,称为离子键。
2、构成微粒:阴、阳离子
3、实质:静电作用(包括静电引力和静电斥力,是静电引力和斥力达平衡状态)
思考:离子键的形成条件和原因是什么?
板书:
4、形成条件:泼金属的原子失去其最外层上的电子形成阳离子,活泼非金属的原子获得电子形成阴离子,阴、阳离子间通过静电作用形成离子键。
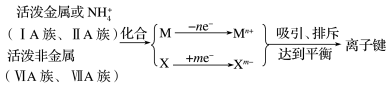 5、形成原因:原子间相互得失电子达到稳定结构;体系的总能量降低。
5、形成原因:原子间相互得失电子达到稳定结构;体系的总能量降低。
思考:怎样表示氯化钠的形成过程呢?
学生活动:阅读教材第128页
板书:(二)电子式
1、定义:在元素符号周围用“·”或“×”表示原子或离子的最外层电子的式子
课堂练习:PPT展示 写出下列原子或离子的电子式
氢原子________、钠原子________、氮原子___________、氯原子_________
钠离子________、镁离子________、
2、电子式书写规则:(PPT展示)
(1)原子的电子式:氢原子H、钠原子Na、氮原子![]() 、氯原子
、氯原子![]() 。
。
(2)简单阳离子的电子式:简单阳离子是原子失去最外层电子后形成的,其电子式就是其阳离子符号,例Na+、Mg2+等。
(3)简单阴离子的电子式:氯离子![]() 、氧离子
、氧离子![]() 。
。
(4)复杂阴、阳离子的电子式
复杂阴、阳离子要标明电子,用[ ]括上,并在[ ]右上角标明电性和电量,例如:
![]()
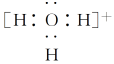
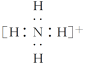
水合氢离子 铵根离子 氢氧根离子 过氧根离子
思考:用电子式怎样表示氯化钠的形成过程呢?
学生活动:练习书写
板书:3、用电子式表示形成过程(以氯化钠为例)
![]()
练习:用电子式表示氟化镁的形成过程。
PPT展示:![]()
小结:
(1)连接号必须使用“――→”,不能用等号。
(2)左边写出原子的电子式并用箭头标出电子转移情况,右边构成离子化合物的每个离子的电子式都要单独写,不能合并。
(3)离子的电子式要标离子所带的电荷数,阴离子的电子式要用[__]表示。
(4)要和化学方程式区别开,形成过程只是表示由原子形成离子的过程,左侧不能写成物质的化学式。
过度:由阴、阳离子形成的化合物属于哪一类物质呢?
板书:(二)离子化合物
1、定义:由阴、阳离子形成的化合物,
2、作用力:离子键(静电作用)
提问:哪些物质属于离子化合物?
板书:3、类型:(1)活泼金属氧化物:例Na2O、MgO、CaO等
(2)绝大多数盐:NaCl、KNO3、Na2SO4、CaCO3、NH4Cl等
小结:
①离子化合物中一定含有离子键;
②含有离子键的物质一定是离子化合物;
③离子化合物中一定含有阴离子和阳离子。
④离子化合物中不一定含有金属元素,如NH4Cl、NH4NO3等;
⑤含有金属元素的化合物不一定是离子化合物,如AlCl3。
![]()
本节课围绕着两个核心的问题展开教学:一是离子键是什么?二是微粒之间是如何形成化学键进而相互作用的?为了解决这两个问题,设置了一系列的问题或问题链。首先,为了让学生形象化地感知微观粒子之间存在相互作用力,引导学生分析NaCl中化学键的形成过程,并最终得出离子键的概念、实质、形成原因,并在学生练习的基础上帮助学生进行了整理归纳,有助于学生加深理解和知识网络的构建。









